Введение
Макролидные антибиотики зарегестрированы более 50 лет назад с появления первого препарата данного ряда – эритромицина [1]. В течение последующих лет разработка новых групп макролидов значительно снизилась по сравнению с другими группами антибактериальных препаратов (АБП). Интерес к макролидным антибиотикам возрос с появлением на фармацевтическом рынке 14- и 15-членных макролидов, а также доказательной базы внутриклеточных патогенов (Chlamydia spp., Legionella spp. и др.) в ряде инфекций и возникновением проблемы вторичной лекарственной устойчивости микроорганизмов в первую очередь к β-лактамным антибиотикам [2].
В основе механизма действия макролидных антибиотиков лежит их способность нарушать синтез белка микробной клетки. При этом в терапевтических концентрациях макролиды оказывают преимущественно бактериостатическое действие, однако в высоких концентрациях эти препараты могут действовать бактерицидно [3, 4]. После выхода на фармацевтический рынок более новых препаратов группы макролидов использование эритромицина значительно снизилось. Это объясняется фармакокинетическими и фармакодинамическими преимуществами «новых» макролидов по сравнению с эритромицином: снижение кратности введения препарата и степени влияния компонентов пищи на биодоступность препаратов, более широкий спектр действия некоторых 14-, 15- и 16-членных представителей группы, а также менее выраженные побочные эффекты и лекарственные взаимодействия. Однако для сравнительной оценки антимикробной эффективности макролидных антибиотиков проводится их сопоставление именно с эритромицином, который принято считать «стандартным препаратом группы макролидов» [5].
В настоящее время известно 14 макролидов, из них в России зарегистрировано 8 представителей данного класса антибиотиков [6]. Наиболее распространенным является рокситромицин – первый полусинтетический 14-членный макролид. Препарат был разработан фармацевтической компанией Hoechst Uclaf и появился на фармацевтическом рынке в 1987 г. [2]. Рокситромицин обладает особенностями, отличающими его от других представителей класса макролидов, прежде всего эритромицина, что позволяет рассматривать его в качестве клинически значимого АБП при лечении многих заболеваний.
Фармакологические свойства рокситромицина
Рокситромицин – полусинтетический антибиотик группы макролидов для приема внутрь. Оказывает бактериостатическое действие: связываясь с 50S-субъединицей рибосом, подавляет реакции транслокации и транспептидации, процесс образования пептидных связей между аминокислотами и пептидной цепью; тормозит синтез белка рибосомами, в результате чего угнетает рост и размножение бактерий. Рокситромицин проявляет свою активность за счет создания более высоких внутриклеточных концентраций [7, 8]. Химическая структура рокситромицина представлена на рис. 1 [9].
Спектр активности рокситромицина приближается к таковому эритромицина, но при этом имеет ряд преимуществ. Модификация лактонного кольца привела к появлению трех кардинальных отличий рокситромицина от эритромицина: расширение спектра антибактериальной активности, прежде всего за счет грамотрицательной флоры (Haemophilus influenzae, Neisseria spp. и некоторых других грамотрицательных палочек), более высокая кислотоустойчивость и улучшенная всасываемость в желудочно-кишечном тракте (ЖКТ), способность создавать более высокие концентрации в клетках и увеличение продолжительности периода полувыведения [3, 9].
Фармакокинетика
Рокситромицин имеет более высокую биодоступность при приеме внутрь, более устойчив к действию соляной кислоты, лучше и быстрее, чем другие макролиды, всасывается в ЖКТ. Пища не влияет на полноту абсорбции рокситромицина, но, как правило, замедляет ее скорость [6]. Это одно из преимуществ рокситромицина перед другими макролидами, например азитромицином, который следует принимать только натощак, т.к. пища уменьшает степень его адсорбции почти в 2 раза.
Важной фармакокинетической особенностью рокситромицина является достижение наиболее высоких по сравнению с другими макролидными антибиотиками концентраций в крови. Максимальная концентрация в плазме (Cmax) после перорального приема 150 мг препарата развивается через 2 часа и достигает в среднем 6,6–7,9 мг/л (табл. 1) [7, 10, 11].
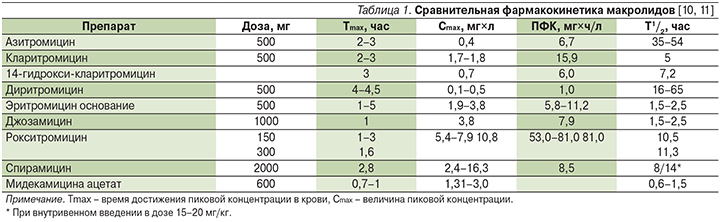
Макролиды в различной степени связываются с белками плазмы, главным образом с α1-гликопротеинами. Наибольшим связыванием характеризуется рокситромицин (92–96%) (рис. 2) [10].
Рокситромицин хорошо распределяется в организме. Высокие концентрации, сопоставимые с уровнем в плазме и превышающие МПК90 для чувствительных микроорганизмов, создаются в ЛОР-органах (в миндалинах, среднем уху, в околоносовых пазухах) и слюне, в легких, слезной жидкости, предстательной железе, миометрии, эндометрии, синовиальной жидкости, коже, в других органах и средах [12].
У детей как после однократного приема (2,5 мг/кг), так и при курсовом применении (2,5 мг/кг 2 раза в сутки) высокие уровни рокситромицина определяются в миндалинах, аденоидах и экссудате среднего уха [12].
Рокситромицин способен аккумулироваться в нейтрофилах [13], при этом соотношение концентраций антибиотика в их цитоплазме и внеклеточной жидкости составляет 21,9 (джозамицина – 15,5 и эритромицина – 6,6). Накопление рокситромицина отмечается также и в альвеолярных макрофагах. По степени аккумуляции в нейтрофилах рокситромицин превосходит эритромицин и джозамицин [13].
Рокситромицин в организме почти не подвергается биотрансформации. Не более 5% введенной дозы экскретируется в метаболизированном виде. Значительная часть препарата выделяется через ЖКТ и не более 10% – с мочой. До 15% может элиминироваться через легкие [7]. Рокситромицин в меньшей степени, чем эритромицин, угнетает цитохром-Р450, поэтому его взаимодействие с препаратами, метаболизирующимися в печени при участии микросомальных ферментов, менее вероятно. Не выявлено клинически значимого взаимодействия данного антибиотика с карбамазепином, варфарином, дизопирамидом, пероральными контрацептивами, что очень важно для пациентов, которые принимают данные препараты.
Период полувыведения у взрослых в среднем составляет 8–10 часов и может увеличиваться до 15 часов при выраженной почечной недостаточности (клиренс креатинина <10 мл/мин), но коррекции дозы в этом случае не требуется, как и для пациентов, находящихся на диализе [14]. Длительный период полувыведения позволяет назначать рокситромицин взрослым 1 раз в сутки, что очень удобно для пациента. У детей период полувыведения имеет, как правило, бóльшую продолжительность, чем у взрослых.
Спектр антимикробной активности рокситромицина
Рокситромицин высокоэффективен при лечении инфекций верхних дыхательных путей (ИДП): острого синусита (ОС) и хронического синусита, острого среднего отита (ОСО) и хронического среднего отита, наружного отита, острого тонзиллофарингита (ОТФ), эпиглотита; инфекций нижних дыхательных путей: бронхита, пневмонии, а также ородентальных и урогенитальных инфекций.
Грамположительные кокки. Рокситромицин активен в отношении Staphylococcus aureus (метициллиночувствительных штаммов – MSSA), Streptococcus pneumoniae, включая пенициллинорезистентные штаммы, β-гемолитического стрептококка группы А (БГСА).
Грамположительные палочки. Рокситромицин активен в отношении Listeria monocytogenes (МПК50 – 0,25 мг/л), Corynebacterium diphtheriae (МПК50 – 0,008 мг/л), Lactobacillus spp. (МПК50 – 0,06 мг/л). По уровню активности in vitro в отношении данных возбудителей рокситромицин несколько превосходит азитромицин [7, 15].
Грамотрицательные кокки. Рок-ситромицин высокоактивен в отношении Moraxella catarrhalis (МПК50 – 0,12 мг/л) [15].
Грамотрицательные палочки. Как и другие макролиды, рокситромицин активен в отношении Haemophilus ducreyi, Bordetella pertussis, Campylobacter jejuni и Gardnerella vaginalis, H. influenzае.
Внутриклеточные патогены. Рок-ситромицин высокоактивен in vitro в отношении Mycoplasma pneumoniae, Chlamydia pneumoniae и Legionella spp. [15–17].
Анаэробы. Рокситромицин, как и другие макролиды, проявляет активность в отношении Porphyromonas spp., Propionibacterium spp. и Fusobacterium spp. [9,18].
Природная активность АБП, в т.ч. рокситромицина, в отношении основных бактериальных возбудителей ИДП, представлена в табл. 2 [19].

Место рокситромицина при ИДП
Высокая эффективность макролидов при ИДП обусловлена несколькими факторами. Во-первых, спектр их антимикробной активности включает большинство основных респираторных патогенов, таких как S. pyogenes, S. pneumoniae, M. catarrhalis, H. inf-luenzae, причем в отношении пневмококков макролиды проявляют отчетливый постантибиотический эффект. Как известно, многие штаммы M. catarrhalis и H. influenzae обладают способностью вырабатывать β-лактамазы, вследствие чего могут быть устойчивыми к аминопенициллинам. Для действия макролидов наличие этого механизма бактериальной защиты не имеет значения. Во-вторых, макролиды обладают благоприятными фармакокинетическими особенностями, позволяющими создавать высокие концентрации в соответствующих очагах воспаления.
И в-третьих, они активны в отношении «атипичных» возбудителей. У штаммов C. pneumoniae и M. pneumoniae в настоящее время отсутствует клинически значимая антибиотикорезистентность (АБР) к макролидам [20], однако все β-лактамы в отношении этих атипичных возбудителей не активны.
Для лечения ИДП бактериальной природы применяются два основных класса антибиотиков – β-лактамы и макролиды. Соответственно, наибольший практический интерес представляют данные об активности различных представителей именно этих классов АБП в отношении ведущих возбудителей инфекций. У типичных бактериальных возбудителей возможно развитие резистентности как к β-лактамам, так и к макролидам. Поэтому возможность эффективного применения макролидов для лечения ИДП во многом определяется частотой выделения возбудителей, имеющих различные механизмы приобретенной АБР в конкретном регионе.
В России действует уникальная система мониторинга АБР (причем на уровне не только страны, но и отдельных регионов и городов) – карта АБР Российской Федерации (AMRmap). Этот интернет-ресурс (http://map.antibiotic.ru) со свободным доступом представляет результаты многоцентровых исследований АБР, полученных НИИ антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России совместно с Межрегиональной ассоциацией по клинической микробиологии и антимикробной химиотерапии, и открывает новые возможности комплексного оперативного мониторинга состояния АБР в РФ и актуальной информации об АБР в конкретном регионе, способствует рациональному выбору АБТ при инфекциях разной локализации [21].
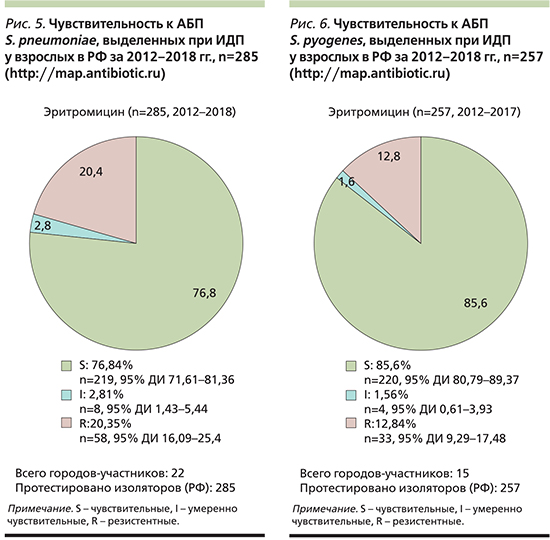
Информация о чувствительности респираторных патогенов представлена на рис. 3–6.
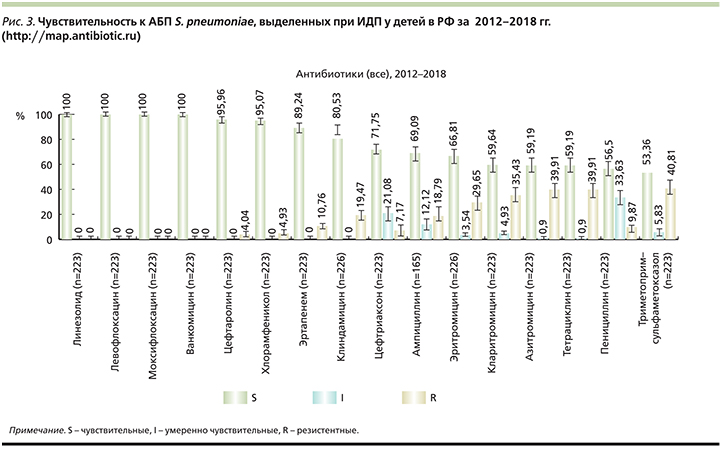
Наибольшую активность in vitro в отношении штаммов БГСА проявляют β-лактамные антибиотики, к которым случаев развития приобретенной резистентности у S. рyogenes не отмечено, т.е. сохраняется 100%-ная чувствительность [14]. Частота приобретенной АБР к макролидам у штаммов пиогенного стрептококка невысокая, составляет у детей в РФ 11,32% (резистентных – 11,08%, умеренночувствительных – 0,24%). У взрослых пациентов РФ данные показатели аналогичны – 14,4% (резистентных – 12,84%, умеренночувствительных – 1,56%). Данные результаты позволяют рассматривать макролиды в качестве приемлемой альтернативы пенициллинам при инфекциях стрептококковой этиологии.

При анализе данных о распространенности резистентности пневмококков у детей РФ к макролидам выявлено, что частота выделения штаммов S. pneumoniae, не чувствительных к эритромицину, достигает 33,19% (резистентных – 29,65%, умеренночувствительных – 3,54%). У взрослых пациентов РФ доля пневмококков, не чувствительных к эритромицину, несколько ниже и составляет 23,16% (резистентных – 20,35%, умеренночувствительных – 2,81%). Во многих странах мира, в т.ч. пограничных с РФ, показатели резистентности к макролидам у S. pneumoniae и S. pyogenes существенно выше, чем в нашей стране [22]. Следовательно, при разработке рекомендаций по лечению инфекций, вызванных перечисленными микроорганизмами, следует обязательно учитывать российские особенности АБР возбудителей ИДП.
В исследовании in vitro продемонстрирована способность рокситромицина препятствовать образованию биопленок штаммами, а также вызывать уменьшение массы и толщины уже сформированной биопленки. Поскольку образование биопленок считается одним из ведущих механизмов, обеспечивающих персистенцию и хронизацию бактериальной инфекции, эти данные могут служить дополнительным основанием к назначению рокситромицина при ИДП [23].
Постантибиотический эффект рокситромицина
Рокситромицину присущ постантибиотический эффект, под которым понимается персистирующее ингибирование жизнедеятельности бактерий после их кратковременного контакта с антибактериальным препаратом [24]. В основе эффекта лежат необратимые изменения в рибосомах микроорганизма, следствием чего служит стойкий блок транслокации. За счет этого общее антибактериальное действие препарата усиливается и пролонгируется, сохраняясь в течение срока, необходимого для ресинтеза новых функциональных белков микробной клетки [25] (табл. 3).

Наиболее отчетливый постантибиотический эффект, причем более длительный, чем у бензилпенициллина, рокситромицин проявляет в отношении S. pneumoniae, S. pyogenes и H. influenzae [26].
Предполагается, что длительная терапия макролидами видоизменяет характер взаимодействия патогена с макроорганизмом, трансформируя его из инфекции в относительно доброкачественную колонизацию. А у некоторых больных при этом наблюдается и эрадикация возбудителя. С феноменом «трансформации инфекции в колонизацию» может быть связано нередко наблюдаемое при длительном применении макролидов более быстрое улучшение клинических и лабораторных показателей по сравнению с бактериологическими параметрами [27].
Клиническое применение рокситромицина: данные клинических исследований
Основной областью применения рокситромицина являются ИДП, инфекции кожи и мягких тканей, а также ородентальные и урогенитальные инфекции.
Инфекции верхних дыхательных путей. Стрептококковый тонзиллофарингит (ТФ) – заболевание, при котором показана АБТ только в случае выделения БГСА. С учетом универсальной чувствительности БГСА к β-лактамам АБП выбора в терапии БГСА-ТФ являются аминопенициллины, при наличии в анамнезе аллергических реакций на β-лактамы –макролиды и линкозамиды [28].
За последние годы в литературе зафиксированы случаи неэффективности пенициллина для эрадикации S. pyogenes со слизистой оболочки миндалин и задней стенки глотки, частота которых может достигать 30–40% [29, 30]. Объединенные данные двух рандомизированных многоцентровых исследований [29, 31] показали, что несмотря на стопроцентную чувствительность пиогенного стрептококка к пенициллину, микробиологическая неэффективность (отсутствие эрадикации БГСА из носоглотки на 10–14-й или 29–31-й день) отмечена среди 35% пациентов, получавших феноксиметилпенициллин, и у 37% больных, получавших бензилпенициллин [31].
Основными причинами неудачной эрадикации БГСА отмечают повторное заражение стрептококками от инфицированных членов семьи, разрушение пенициллина ко-патогенами полости рта, недостаточное проникновение антибиотика в ткань миндалин и внутрь эпителиальных клеток [29].
В ходе исследования, выполненного на культуре эпителиальных клеток слизистой оболочки глотки человека (HEp-2), показано, что БГСА, локализованные внутри клеток, сохраняли жизнеспособность, несмотря на воздействие аминопенициллина [31]. В то же время антибиотики группы макролидов обладали бактерицидным действием в отношении данных микроорганизмов.
Клиническая эффективность рокситромицина, назначенного 10-дневным курсом, была сопоставимой с эффективностью β-лактамов (амоксициллин/клавуланат, цефаклор) и других макролидов (азитромицин, кларитромицин) при лечении острого фарингита, тонзиллита [32]. В другом клиническом исследовании эффективность рокситромицина, назначенного однократно (300 мг/сут) пациентам с ТФ, сравнивалась с амоксициллином/клавуланатом (1,0 г) дважды в сутки. По окончании терапии эффективность лечения рокситромицином составила 82%, амоксициллином/клавуланатом – 78% [33].
Клиническая и бактериологическая эффективность рокситромицина была продемонстрирована и в многоцентровом контролируемом исследовании, включившем 205 детей с тонзиллитом, фарингитом, ринофарингитом, пневмококковой пневмонией, импетиго и пиодермией [34]. Клиническое выздоровление при приеме препарата в дозе 6 мг/кг/сут в течение 8 дней наблюдалось у 87,5–100% больных. В группе пациентов, получавших рокситромицин, была отмечена высокая степень эрадикации S. pyogenes, S. pneumoniae, S. aureus, H. influenzae и М. рnеumoniae.
Высокая эффективность и наилучшая переносимость рокситромицина получили еще одно подтверждение в клиническом исследовании Т.И. Гаращенко (РГМУ). Рокситромицин и другие макролиды назначались детям при обострении хронического тонзиллита [35].
Рокситромицин в дозе 150 мг/сут был приемлемой альтернативой пенициллину и эритромицину для профилактики наиболее частого осложнения ОТФ – ревматической лихорадки [36].
Средний отит. Основные возбудители СО – S. pneumoniae, M. catarrhalis, H. influenzae. У детей старшего возраста также может быть выделен пиогенный стрептококк. Для лечения ОСО на основании данных по АБР респираторных патогенов в РФ есть два класса АБП: β-лактамы (амоксициллин, АМК и цефалоспорины II–III поколений), при аллергии – современные макролиды [37].
В многочисленных контролируемых сравнительных исследованиях [33, 38] показано, что рокситромицин не уступает амоксициллину/клавуланату, цефаклору, другим новым макролидам (азитромицину и кларитромицину), а нередко превосходит некоторые препараты, особенно пенициллины, по эффективности или безопасности. Так, в рандомизированной работе с участием 85 пациентов в возрасте от 18 и 91 года с ОСО рокситромицин показал выше эффективность по сравнению с амоксициллин/клавуланатом. Эффективность рокситромицина (300 мг/сут) была оценена по сравнению с амоксициллином/клавуланатом (1,0 г 2 раза в сутки). При суммарном анализе по окончании терапии эффективность лечения рокситромицином составила 82%, амоксициллином/клавуланатом – 78% [33]. Согласно данным еще одного исследования, рокситромицин не отличается по эффективности от амоксициллина/клавуланата при ЛОР-инфекциях различной локализации, но, как правило, лучше переносился [38]. В крупном международном несравнительном открытом исследовании, в которое были включены 40 тыс. пациентов, терапия рокситромицином продолжительностью от 7 до 14 дней сопровождалась клиническим эффектом более чем у 95% пациентов с инфекциями верхних и нижних отделов дыхательных путей (выздоровление или улучшение). При этом частота отмеченных побочных эффектов не превышала 4% [33, 39].
Рокситромицин 300 мг 1 раз в сутки сравнивали с кларитромицином 250 мг дважды в сутки в открытом рандомизированном исследовании 200 пациентов с инфекциями верхних дыхательных путей (синусит, фарингит и средний отит). Средняя продолжительность лечения составила 9 дней. Рокситромицин был более эффективным (р<0,01), особенно при лечении среднего отита и фарингита, и лучше переносился (только 4% побочных эффектов, р<0,05) [40].
Эффективность рокситромицина у детей с ОСО оказалась одинаково высокой при применении как 2, так и 1 раз в сутки. Детям с массой тела менее 10 кг рокситромицин назначали в дозе 5 мг/кг/сут, более 10 кг – 10 мг/кг/сут [41].
В ряде других исследований показана высокая клиническая эффективность рокситромицина при инфекциях верхних и нижних отделов дыхательных путей – ОСО (91–96%), пневмонии и фарингите (100%) [42–45].
Синусит. Наиболее частые бактериальные возбудители ОС – это S. pneumoniae (30–66%), H. influenzae (20–30%) и M. сatarrhalis (12–28%). Реже в качестве этиологических агентов выступают S. pyogenes, Streptococcus spp., S. aureus, анаэробы и др. Макролиды рассматриваются как альтернативные препараты при аллергии на β-лактамы [46, 47].
В открытом рандомизированном исследовании, в котором приняли участие 60 пациентов с острым и рецидивирующим синуситом, бактериологическая и клиническая эффективность рокситромицина 150 мг дважды в сутки сравнивалась с амоксициллином/клавуланатом 625 мг трижды в сутки. Клиническая эффективность составила у 93,1% пациентов, получавших рокситромицин, и у 88,8% получавших амоксициллин/клавуланат. Переносимость была значительно лучше в группе рокситромицина: 3,4% больных имели легкие побочные эффекты со стороны ЖКТ. Побочные эффекты в группе амоксициллин/клавуланата были зарегистрированы у 25,9% пациентов (р<0,05). Таким образом, рокситромицин продемонстрировал клиническую и бактериологическую эффективность, аналогичную с амоксициллином/клавуланатом, но с лучшей переносимостью для лечения острого и рецидивирующего синусита [48].
Рокситромицин активен в отношении одонтогенных синуситов [49].
По результатам многоцентрового двойного слепого исследования пациентов с острыми ородентальными инфекциями рокситромицин, назначавшийся в дозе 150 мг 2 раза в сутки, оказался сопоставимым по клинической эффективности с эритромицином этилсукцинатом, который применялся по 1,0 г 2 раза в сутки со средней продолжительностью терапии 8 дней, – 94 и 91 % соответственно [50].
Инфекции нижних дыхательных путей
При обострении хронического бронхита клиническая эффективность рокситромицина не отличалась от таковой доксициклина – 81 и 80 % соответственно [51]. В крупном международном несравнительном открытом исследовании, в которое были включены 40 тыс. пациентов, терапия рокситромицином продолжительностью от 7 до 14 дней сопровождалась клиническим эффектом более чем у 95% пациентов с инфекциями верхних и нижних отделов дыхательных путей (выздоровление или улучшение). При этом частота отмеченных побочных эффектов не превышала 4% [44].
По клинической эффективности при лечении атипичной пневмонии рокситромицин сопоставим с азитромицином и кларитромицином [52]. Несмотря на невысокую активность рокситромицина in vitro в отношении H. influenzae, его клиническая эффективность для пациентов с респираторными инфекциями, вызванными данным микроорганизмом, составляет, по данным мета-анализа нескольких контролируемых исследований, около 80 % [53].
Инфекции кожи и мягких тканей
Эффективность и хорошая переносимость рокситромицина были продемонстрированы при рожистом воспалении и угревой сыпи [54]. В результате двойных слепых рандомизированных исследований пациентов с acne vulgaris применение рокситромицина в дозе 150 мг 2 раза в сутки в течение 4 недель также характеризовалось высокой клинической эффективностью [55].
Урогенитальные инфекции
В рандомизированном клиническом исследовании при урогенитальном хламидиозе и неспецифическом уретрите рокситромицин был сопоставим с доксициклином как по клинической (81 и 85% соответственно), так и по бактериологической эффективности (92 и 100% соответственно). Однако в группе пациентов, принимавших доксициклин, было зарегистрировано намного больше побочных эффектов, чем в группе рокситромицина (35 и 19% соответственно) [56]. При негонорейном уретрите рокситромицин был одинаково эффективен при применении дозы 300 мг как в один, так и в два приема – по 150 мг [57].
Иммуномодулирующее и противовоспалительное действия
Рокситромицин может воздействовать на ряд механизмов воспаления, в т.ч. миграцию нейтрофилов, процессы окислительного метаболизма в фагоцитах и продукцию провоспалительных цитокинов [58]. В экспериментальных исследованиях рокситромицин проявлял противовоспалительный эффект, сопоставимый с таковым нимесулида, и значительно превосходил в этом отношении другие макролиды, особенно азитромицин, практически лишенный этого свойства. Противовоспалительному действию макролидов придается в настоящее время крайне большое значение как при лечении острых ИДП, например внебольничной пневмонии, так и при хронических воспалительных заболеваниях легких [59].
Безопасность рокситромицина
Макролиды рассматриваются как одна из самых безопасных групп лекарственных средств, а рокситромицин отличается наилучшей переносимостью среди макролидов, что является одним из важнейших его достоинств [60–62].
Побочные лекарственные эффекты развиваются только у 3–4% пациентов. Как правило, доминируют симптомы со стороны ЖКТ – абдоминальные боли, тошнота, диарея. Улучшенная переносимость рокситромицина по сравнению с эритромицином безусловно связана со значительно менее выраженным влиянием на кишечную флору и моторику ЖКТ. Рокситромицин очень редко вызывает аллергию, может использоваться больными бронхиальной астмой и другими заболеваниями аллергической природы [45, 61, 62].
Макролиды, в частности рокситромицин, плохо проникают через плаценту, и в связи с этим создают низкие концентрации в кровотоке плода – 3,0; 2,6% соответственно от концентрации в крови матери. В то же время уровень кларитромицина достигает 6,1% от концентрации в крови матери [63].
В крупном клиническом исследовании не было выявлено статистически значимого повышения частоты встречаемости аномалий развития при использовании рокситромицина беременными, тогда как применение олеандомицина ассоциировалось с трехкратным повышением риска рождения незрелого плода [64].
Однократный прием в сутки препарата Эспарокси® 300 мг обеспечивает более высокую приверженность и представляется наиболее оптимальным для взрослых. Согласно данным проведенного многоцентрового рандомизированного исследования, включившего 1588 пациентов с инфекциями различной локализации, эффективность рокситромицина одинаково высока независимо от того, назначается ли он однократно в дозе 300 мг/сут или в два приема по 150 мг [65].
Заключение
В настоящее время на фармацевтическом рынке препарат представлен под торговым названием Эспарокси®, производителем которого является Эспарма ГмбХ, Германия. Рокситромицин удовлетворяет критериям эффективности, безопасности, удобства применения, фармакоэкономическим параметрам, что обеспечивает высокую приверженность пациентов и эффективность лечения как для взрослых пациентов, так и для детей.



