Введение
Акромегалия (АМ) – тяжелое хроническое нейроэндокринное заболевание, обусловленное хронической гиперпродукцией гормона роста, сопровождающееся рядом сопутствующих состояний, приводящее к ранней инвалидизации и преждевременной смерти [1].
АМ характеризуется прогрессирующей инвалидизацией и сокращением продолжительности жизни. Смертность среди больных АМ в 10 раз выше, чем в популяции. Приблизительно 50% нелеченых больных умирают в возрасте до 50 лет. К основным причинам повышенной смертности и сокращения продолжительности жизни относятся осложнения, вызванные длительной гиперпродукцией гормона роста: сердечно-сосудистая патология, диабет и его осложнения, заболевания органов дыхания, злокачественные новообразования желудочно-кишечного тракта и некоторые другие. В свою очередь своевременная диагностика и адекватное лечение АМ позволяют сокращать риск смертности в 2–5 раз [2].
Диагностика АМ
Первоначальный диагноз АМ обычно основывается на клинической симптоматике (рис. 1). Вследствие медленного развития физикальных изменений заболевание может оставаться нераспознанным в период от 4 до 15 лет после возникновения. Чаще всего АМ диагностируется в достаточно зрелом возрасте. Последние эпидемиологические данные подтверждают растущую выявляемость данного заболевания, одновременно подчеркивая частоту варианта с субклиническим течением. При выявлении ряда клинических симптомов, подозрительных на АМ, следующим этапом является проведение лабораторных исследований.
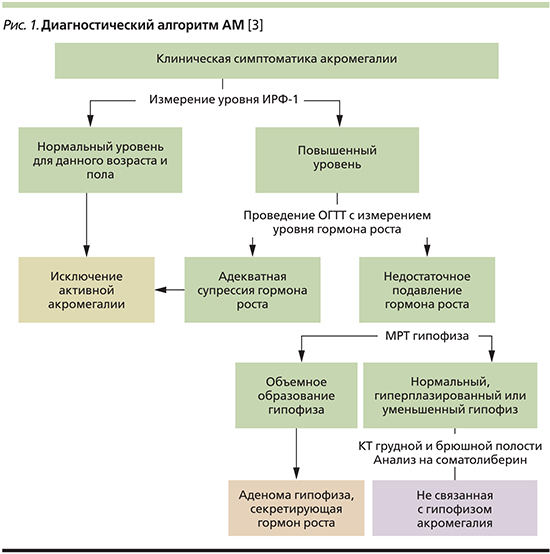
Лабораторную диагностику следует начинать с определения уровня инсулиноподобного фактора роста-1 (ИФР-1). Этот показатель является надежным маркером для диагностики, мониторинга и особенно скрининга АМ. Крайне важно, что уровень ИФР-1 может быть определен в любое время дня. Взятие крови натощак не является обязательным. Рекомендуется использование одной и той же лабораторной методики для повторных определений содержания ИФР-1 у каждого конкретного пациента ввиду расхождения показателей между различными лабораториями.
При высоком уровне ИФР-1 необходимо провести анализ уровня гормона роста с применением орального глюкозотолерантного теста – ОГТТ (75 г глюкозы per os с исследованием уровня соматотропного гормона [СТГ] каждые 30 минут в течение 2 часов). Нормальные показатели СТГ/ОГТТ – менее 1 нг/мл после нагрузки глюкозой в любой из 5 точек кроме базальной.
В целом уровни СТГ и ИФР-1 тесно коррелируют друг с другом. Однако до 30% больных имеют расхождения данных показателей. Наиболее частым вариантом является сочетание повышенного уровня ИФР-1 с нормальными уровнями СТГ, что, вероятнее всего, отражает начало заболевания. Значительно реже встречаются повышенные уровни СТГ (как базальные, так и в ходе ОГТТ) с нормальным показателем ИФР-1. Такое расхождение может быть связано с неправильной стандартизацией проб, влиянием возраста, гонадного статуса, генетическими различиями связывающих белков и наконец – стрессом во время забора проб крови. Нельзя также забывать о других заболеваниях, связанных с нарушениями продукции и метаболической активности гормона роста при таком лабораторном ответе (таких, как синдром Ларона). Но в таком случае первоочередной должна оставаться клиническая картина. Если степень расхождения показателей существенна и имеются клинические признаки, дающие веские основания заподозрить АМ, абсолютно оправданно проведение повторных лабораторных тестов.
Дополнительно с целью выявления смешанной (СТГ/пролактин-секретирующей) аденомы гипофиза определяют уровень пролактина, для исключения гипопитуитаризма – адренокортикотропный гормон, кортизол, тиреотропный гормон, свободный тироксин (Т4св.), лютеотропный гормон, фолликулостимулирующий гормон, тестостерон, эстрадиол, осмоляльность плазмы и мочи, особенно в случае макроаденомы.
В качестве инструментального метода диагностики показано проведение магнитно-резонансной томографии области гипофиза с контрастированием. При наличии противопоказаний (пейсмейкер, металлические импланты и др.) возможно проведение мультиспиральной компьютерной томографии. Однако данный вид исследования малоинформативен в плане выявления микроаденом гипофиза, что может затруднять диагностику. При наличии специфических жалоб или компрессии хиазмы по данным нейровизуализации показано обследование полей зрения [2].
Лечение АМ
Согласно международному консенсусу, основной целью лечения АМ является увеличение продолжительности и повышение качества жизни больных.
Терапия АМ преследует следующие цели:
- Нормализация гормональных показателей. Целевые значения: нормализация уровня ИФР-1, достижение уровня СТГ≤2,5 нг/мл (≤1 мкг/л при высокочувствительном методе определения) при лечении длительно действующими аналогами соматостатина (АСС); после аденомэктомии – минимальный уровень СТГ/ОГТТ <1 нг/мл (<0,4 мкг/л при высокочувствительном методе определения) [4].
- Уменьшение объема опухоли, устранение «масс-эффекта» (удаление или радикальная редукция опухолевой массы).
- Контроль системных осложнений и устранение обратимых симптомов заболевания.
- Сохранение функциональной активности гипофиза.
- Предупреждение рецидивов заболевания.
- Минимизация риска преждевременной смерти (что достигается нормализацией гормональных показателей и контролем осложнений АМ, прежде всего в отношении изменений со стороны сердечно-сосудистой системы).
Алгоритм лечения АМ основан на Международном консенсусном соглашении, где в качестве средства выбора рекомендуется использовать хирургическое пособие, что позволяет достигать быстрой ремиссии заболевания.
В отсутствие хирургической перспективы или нерадикальности проведенного оперативного вмешательства показано использование лекарственных препаратов или в ряде случаев стереотаксической хирургии.
Однако медикаментозная терапия занимает лидирующую позицию (рис. 2) К препаратам консервативной терапии относятся синтетические АСС (ланреотид, октреотид, пасиреотид ЛАР), агонисты дофамина (каберголин), антагонист рецепторов гормона роста (пегвисомант).
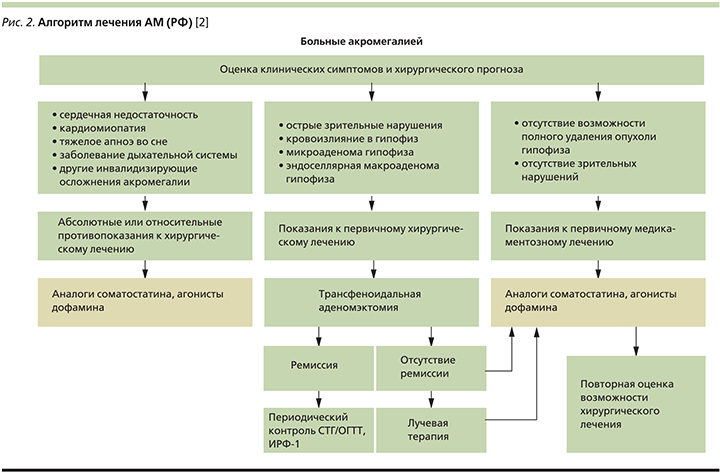
На сегодняшний день первой линией медикаментозной терапии являются АСС – наиболее эффективные средства медикаментозного контроля секреторной и пролиферативной опухолевой активности. При этом ряд клинических ситуаций позволяет рассматривать АСС в качестве первой линии терапии, в т.ч. для проведения предоперационной подготовки. Использование АСС способствует нормализации уровней ИФР-1 и СТГ приблизительно у 55% пациентов и уменьшению объема опухолевой ткани у 20–75% [5–10].
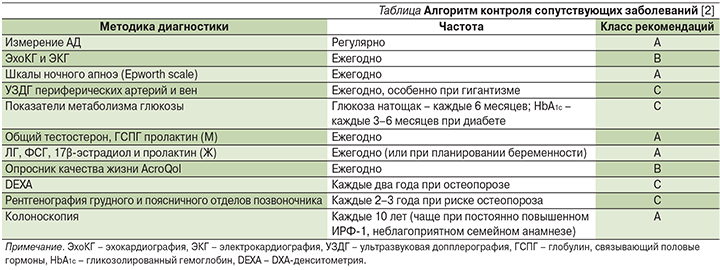
В процесс лечения также входит контроль сопутствующих заболеваний и метаболических нарушений (см. таблицу).
В ряде исследований было показано, что применение АСС ассоциировано с уменьшением частоты сердечных сокращений (ЧСС), индекса массы миокарда левого желудочка (ЛЖ), толщины межжелудочковой перегородки, улучшением переносимости нагрузки и фракции выброса [14]. Так, в исследовании A.K. Annamalai (2013) показано, что применение ланреотида приводит к достоверному снижению скорости распространения пульсовой волны на аорте (аСРПВ) на 0,4 м/с (p=0,046), улучшает показатели функции эндотелия (увеличение показателя поток-опосредованной дилатации на 1,73%; р=0,0013), снижает степень тяжести гипертрофии левого желудочка (изменение массы миокарда ЛЖ на 11,8 г/см2 (р=0,019), что ассоциируется со снижением осложнений со стороны сердечно-сосудистой системы [15]. В исследовании Primarys у пациентов, получавших ланреотид, также было отмечено достоверное снижение уровня триглицеридов и повышение уровня липопротеидов высокой плотности [13]. Уменьшение выраженности факторов риска сердечно-сосудистых заболеваний приводит к снижению риска смерти.
В настоящее время становится все более актуальной проблема резистентности пациентов к терапии АСС, в связи с чем необходима разработка новых схем лечения. Среди предлагаемых решений обсуждаются следующие: эскалация доз, сокращение межинъекционного интервала, взаимозамена октреотид–ланреотид, расширение вариантов различных комбинированных схем АСС, агонистов дофамина и вариантов его дозирования [5].
Для оценки эффективности терапии АСС и своевременной диагностики резистентных форм АМ необходимо проводить жестко регламентированный лабораторный контроль на фоне инициированной терапии. Первый контроль уровня ИФР и СТГ должен проводиться после третьей инъекции любого выбранного препарата. Снижение уровня ИФР не менее чем на 30% от исходного является показателем целесообразности продолжения терапии. В отсутствие ремиссии (уровень СТГ более 2,5 нг/мл и/или повышен уровень ИФР, и/или охраняются клинические проявления) необходимо повышение доз АСС с контролем показателей каждые 3 месяца. Повышение доз может быть проведено до максимально допустимых (в соответствии с инструкцией по применению). При выраженной резистентности возможна внутригрупповая замена октреотида на ланреотид или пасиреотид.
В случаях, когда применение октеротида, ланреотида или пасиреотида в максимальной дозе не приносит результата или проявляется в виде небезопасных побочных эффектов, возможна комбинация одного из препаратов группы АСС с агонистами дофамина или с антагонистом рецепторов гормона роста. Критерием эффективности лечения служат нормализация ИФР, снижение СТГ менее 1,0 нг/мл и отсутствие клиники, что позволяет уменьшать дозы АСС.
Согласно данным Московского регистра больных АМ, возможен перевод пациентов с октреотида на ланреотид (Соматулин® Аутожель® 120 мг) с хорошим терапевтическим эффектом. В ретроспективный анализ были включены 97 пациентов. Причиной перевода на Соматулин® Аутожель® стали недостаточный терапевтический эффект (резистентность к проводимой терапии), непереносимость октреотида, возможность назначения препарата с увеличенными интервалами введения, необходимость проведения инъекций в домашних условиях. Из пациентов, продолжавших принимать Соматулин® Аутожель®, ремиссия отмечена у 61,3% больных. У четырех пациентов после перевода с октреотида в связи с ремиссией состояния был увеличен межинъекционный интервал. При этом у всех пациентов наблюдалась клинико-биохимическая ремиссия, в т.ч. нормализация уровня ИФР-1, средняя концентрация которого составила 130,5 нг/мл [11]. В одном из исследований были продемонстрированы данные по переводу пациентов, получавших 10–20 мг октреотида, на ланреотид. У пациентов с нормальными стабильными показателями ИФР-1 возможно увеличение интервала между инъекциями при переводе на Соматулин® Аутожель® 120 мг без потери эффективности: при показателе ИФР-1>50, но ≤100% от верхней границы нормы – 1 раз в 6 недель, при показателе ИФР-1≤50% от верхней границы нормы – 1 раз в 8 недель [12]. Следовательно, перевод больных с октреотида на ланреотид (Соматулин® Аутожель® 120 мг) при сохранении лечебного эффекта позволил упростить режим инъекций, повысить степень свободы пациента [11] и его приверженность проводимой терапии.
Заключение
Таким образом, своевременная диагностика и адекватная терапия АМ, основанная на отечественных и зарубежных рекомендациях, способствует снижению риска преждевременной смерти за счет нормализации гормональных показателей и контроля осложнений АМ. Имеющиеся в нашем арсенале препараты позволяют использовать максимально эффективные и безопасные схемы медикаментозной терапии, что способствует повышению продолжительности и качества жизни пациентов.



