Введение
Острые нарушения мозгового кровообращения (ОНМК) являются важнейшей медико-социальной проблемой, занимающей лидирующие позиции по заболеваемости и смертности [1]. ОНМК не только характеризуются высокой летальностью, находясь на втором месте среди причин смерти в мире, но и служат наиболее частой причиной стойкой утраты трудоспособности и приводят к социальной дезадаптации пациентов [2]. Почти 22% пациентов, переживших инсульт, не способны передвигаться без помощи, 26% ограничены в повседневном функционировании [3].
Известно, что сахарный диабет (СД) является независимым фактором риска инсульта [4]. В России НМК служат также второй по частоте причиной смертности среди больных СД и составляют 12,17% в структуре причин смерти россиян, больных СД 2 типа – СД2 [5]. Есть сообщения, согласно которым больные СД могут составлять до 50% и даже более от числа лиц с ОНМК, при этом у них может регистрироваться бóльшая частота неблагоприятных клинических исходов по сравнению с лицами без СД [6]. Патофизиология нейронального повреждения в условиях хронической гипергликемии не вполне ясна. С одной стороны, повышенное содержание глюкозы может оказывать прямое токсическое воздействие на ишемизированные нейроны [7]. С другой стороны, значения гликозилированного гемоглобина (HbA1c) как параметра среднесрочной оценки состояния углеводного обмена могут быть связаны с функциональным исходом НМК [8].
Цель исследования: оценить влияние СД2 на выраженность неврологических нарушений и исход ишемических НМК у пациентов с СД2 с учетом выраженности и длительности углеводных нарушений.
Методы
Работа выполнена в дизайне открытого проспективного исследования. В исследование были включены 156 пациентов с ишемическими инсультами (ИИ), наблюдавшихся в ФГБНУ «Научный центр неврологии». Пациенты были разделены на две группы: первую (n=87) составили пациенты с СД2; вторую (n=59) – пациенты без СД.
Исследование проведено на базе ФГБНУ. Все пациенты были госпитализированы в острейший период и получали лечение в соответствии с протоколом медицинской помощи при ИИ. В качестве клинических критериев оценки неврологического дефицита, а также динамического наблюдения всем пациентам была проведена оценка по следующим шкалам: Шкала инсульта Национального института здоровья (NIHSS), Скандинавская шкала инсульта (в 1-й и 14-й дни ОНМК), модифицированная шкала Рэнкина (МшР), индекс повседневной активности Бартела на 14-й день [9–12]. Для верификации диагноза проведено дуплексное сканирование магистральных артерий головы на ультразвуковом приборе Toshiba Viamo (Корея), а также магнитно-резонансная томография (МРТ) головного мозга на магнитном резонансном томографе Siemens 1,5 Тесла (США).
Всем пациентам в первые сутки от момента поступления в стационар определяли следующие лабораторные показатели: общеклинический анализ крови, стандартный биохимический профиль с определением уровня гликемии, печеночных ферментов и липидного спектра, С-реактивного белка (СРБ); пациентам с СД2 – уровень гликированного гемоглобина (НbA1c).
Все биохимические показатели, а также уровень НbA1c определяли на автоматическом биохимическом анализаторе Konelab 30I (Финляндия) с использованием наборов реагентов фирмы Randox (Великобритания). Уровень глюкозы определяли гексокиназным методом, уровень НbA1c – иммунотурбодиметрическим методом, в основе которого лежит взаимодействие антител с антигенами с образованием иммунокомплексов, изменяющих оптическую плотность реакционной среды. Больные СД2 получали сахароснижающую терапию в соответствии с алгоритмами оказания медицинской помощи больным СД [13].
Основными показателями, оцениваемыми в ходе исследования, являлись результаты оценки по следующим шкалам: Шкала инсульта Национального института здоровья (NIHSS), Скандинавская шкала инсульта, МшР, индекс повседневной активности.
Исследование одобрено локальным этическим комитетом ФГБНУ «Научный центр неврологии» (протокол № 11/14 от 19.11.2014). Пациенты оставались анонимными при последующем анализе данных.
Статистическая обработка проведена на Intel – совместимом персональном компьютере с использованием программ Microsoft Excel 2000, Statistica 6.0 for Windows. Согласно дизайну исследования, для проверки гипотезы о нормальности распределения применялся критерий Колмогорова–Смирнова. При нормальном распределении признаков результаты описывались в виде среднее значение±стандартное отклонение. При распределении признака, отличного от нормального, данные представлены как медиана значений [значения верхнего и нижнего квартилей]. Для проверки гипотезы о различии использованы критерии Манна–Уитни, U-тест, критерий Вилкоксона. Для сравнения пропорций в двух независимых группах применяли критерий Фишера и χ2-критерий. Статистически значимыми считались результаты при различиях между сравниваемыми показателями со степенью достоверности не менее р<0,05.
Результаты исследования
Клиническая характеристика пациентов представлена в табл. 1.
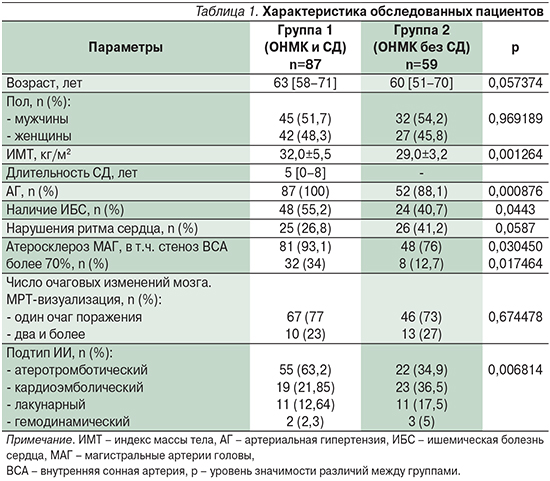
У большинства больных без СД (88%) развитие ИИ произошло на фоне АГ, у пациентов с СД2 АГ выявлялась во всех случаях. У пациентов с СД2 значимо чаще была диагностирована ИБС (в 55,2% случаев против 38,1% у больных без СД; р=0,0443) и атеросклеротическое поражение МАГ у 93,1 и 76% пациентов соответственно (р=0,030450), с более частым наличием стеноза ВСА от 70% (в 34 и 12,7%; р=0,017464).
Определение ведущего патогенетического подтипа инсульта выявило преобладание атеротромботического генеза у больных СД2 (63,2%), в то время как у пациентов без СД атеротромботический и кардиоэмболический варианты ИИ встречались с близкой частотой (34, 9 и 36,5% соответственно). Число очагов поражения вещества мозга и их размеры, выявленные при нейровизуализации, в группах достоверно не различались.
При оценке параметров углеводного и липидного обменов (табл. 2) отмечено, что развитие инсульта у больных СД2 произошло на фоне повышения уровня HbA1c в среднем до 8,4% и сопровождалось гипергликемией 10,1 ммоль/л.
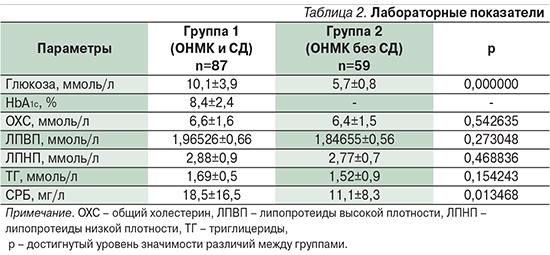
При этом только 22 (25,3%) пациента с СД2 имели значения HbA1c<7%, тогда как у большинства (65 [74,7%]) больных зарегистрирован уровень HbA1c>7%, Показатели липидного обмена в группах значимо не различались, развитие НМК произошло на фоне повышения уровней ОХС и ЛПНП. Изменения в липидограмме характерны для больных ИИ [14].
СРБ – чувствительный маркер воспаления и тканевого повреждения, его уровень был повышен в обеих группах, однако более существенно в группе больных СД2 (18,5±16,5 нг/мл против 11,1±8,3 у пациентов с/без СД; р=0,013468).
Выраженность неврологической симптоматики у пациентов при поступлении была сопоставимой в группах (табл. 3).

При оценке с использованием шкалы NIHSS в группе больных СД2 были отмечены исходно более высокие баллы: (9,0±5, против 8,3±5,8), но без статистической значимости. Средний балл по Скандинавской шкале инсульта исходно практически не различался в группах: у больных СД2 и без СД – 40,5±14,2 и 38,9±16,8 баллов соответственно (р=0,374894). В числе обследованных больных зафиксировано 4 летальных исхода: 1 пациент в группе 1 и 3 пациента в группе 2 (р=0,1395). По истечении 14-дневного курса лечения выявлены лучшие показатели пациентов без СД при оценке по шкале NIHSS и Скандинавской шкале инсульта: 5,4±4,7 против 7,6±5,1 балла (р=0,032691) и 48,5±17,8 против 46±13,6 балла (р=0,048174) соответственно.
В группе 1 число баллов уменьшилось в среднем на 1,4 (15,5%) балла, у пациентов без СД – на 2,9 (32%).
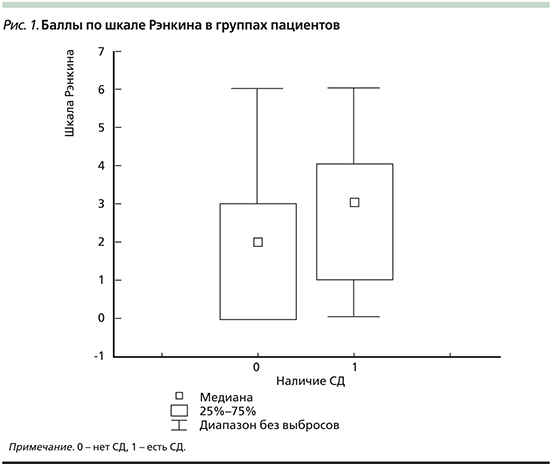
При оценке нарушений жизнедеятельности на фоне инсульта по МшР и шкале Бартела средние баллы составили у больных группы с СД2 и без такового 2,6±1,6 против 2,1±1,9 (р=0,022348) и 70,6±27,1 против 84,2±19,7 (р=0,000933) соответственно (табл. 4, рис. 1 и 2).
При проведении корреляционного анализа по Спирмену для показателей со значительными различиями между группами установлена их зависимость от длительности течения заболевания и качества коррекции углеводных нарушений перед развитием ИИ.
Выявлена обратная корреляционная зависимость длительности СД и выраженности неврологических нарушений по Скандинавской шкале до и после лечения (r=-0,376619; р=0,001682 и r=-0,252288; р=0,039432) соответственно.

Обнаружена значимая корреляция между уровнями HbA1c и глюкозы натощак при поступлении (r=0,5; р=0,000000); HbA1c и баллов по Скандинавской шкале инсульта в первые сутки (r=-0,247073; р=0,043833) и после лечения (r=-0,242257, р=0,048249); HbA1C и числом баллов по шкале NIHSS (r=0,3; p=0,048915); HbA1c и числом баллов по МшР (r=0,3; p=0,002149). В проведенном исследовании нами не выявлено зависимости между уровнем HbA1c и числом очагов, их размерами и числом баллов по шкале Бартела.
Обсуждение
В настоящем исследовании проведена оценка влияния СД2 на неврологические и функциональные нарушения у пациентов с ишемическими НМК с анализом роли показателей HbA1c и длительности углеводных нарушений (длительности СД). При оценке динамики неврологических нарушений лучшие результаты лечения достигнуты пациентами без СД. Согласно результатам нашего исследования, ИИ у больных СД2 развиваются на фоне повышенных значений HbA1c в среднем до 8,4%, а восстановление неврологического дефицита и исход инсульта находятся в зависимости от уровня HbA1c и длительности анамнеза СД2.
На сегодняшний день четко продемонстрирован вклад хронической гипергликемии в развитие острых церебральных катастроф (в т.ч. ИИ), однако зависимость регресса неврологической симптоматики в постинсультном периоде от выраженности и длительности нарушений углеводного обмена не всегда оказывается достаточно ясной [15]. Описываются данные, свидетельствующие о снижении нейропластичности у пациентов с СД2: повышение уровня глюкокортикостероидов, снижение уровня нейротрофического фактора мозга [16]. Вышеупомянутое несоответствие клинических и фундаментальных данных и побудило нас провести анализ восстановления неврологической симптоматики в зависимости от наличия СД2 с учетом объективных шкал, оценивающих в т.ч. степень нарушения жизнедеятельности в постинсультном периоде.
Обращает на себя внимание, что уже на этапе оценки патогенетического подтипа ИИ определяются признаки, отражающие различие патофизиологических механизмов на фоне хронической гипергликемии. Так, выявлено преобладание атеротромботического подтипа ИИ у больных СД2 в сочетании с большей частотой атеросклероза МАГ. Установленное в данной работе более выраженное атеросклеротическое поражение церебральных артерий соотносится с результатами исследования секционных случаев ИИ с летальным исходом у пациентов с СД2. Основной причиной нефатальных инфарктов служит также атеростеноз артерий головного мозга [17]. Двукратное преобладание атеротромботического подтипа ИИ у пациентов в группе 1 (с СД) в очередной раз указывает на тесную взаимосвязь хронической гипергликемии и прогрессирования атеросклероза с развитием церебральных сосудистых катастроф.
Указанное наблюдение подчеркивает необходимость более тщательного скринингового обследования пациентов с СД2 на предмет наличия атеросклеротического поражения брахиоцефальных артерий, поскольку назначение адекватной превентивной терапии (в данном случае – антитромботической) позволит существенно снизить риски ИИ в этой когорте пациентов. Также следует обратить внимание на потенциальное наличие у ряда пациентов т.н. стенозов сонных артерий (гемодинамически значимых), при которых возможна хирургическая коррекция, показания к которой часто имеют место у больных СД [18, 19].
В результате исследования показано, что развитие ИИ у больных произошло на фоне повышенных средних значений HbA1c до 8,4% и сопровождалось повышением уровня глюкозы плазмы крови (10,1 ммоль/л), которые имели между собою прямую зависимость, что говорит о неудовлетворительном гликемическом контроле, предшествовавшем развитию острого эпизода.
Адекватность сахароснижающей терапии СД остается самым актуальным вопросом, т.к. своевременное достижение и поддержание в течение длительного времени целевых значений гликемического контроля позволяют задерживать или отстрочивать время появления поздних осложнений СД и осуществлять первичную профилактику сосудистых осложнений диабета [20].
Повышение уровня глюкозы крови в острейшем периоде инсульта не следует, однако, трактовать как достоверное наличие СД, поскольку во многих случаях имеет место стрессовая гипергликемия, разрешающаяся по мере выхода из острого состояния. Именно поэтому, на наш взгляд, предпочтительнее оценивать состояние углеводного обмена у больных ОНМК с использованием такого параметра, как уровень HbA1c.
При оценке динамики неврологических нарушений в отсутствие статистически значимых отличий в первые сутки заболевания, к концу периода наблюдения выявлены значимые различия между группами с лучшими результатами у пациентов без СД. При оценке уровня независимости обнаружена значимо меньшая самостоятельность в повседневной деятельности больных СД после ИИ, равно как и менее благоприятный исход инсульта. Установлена корреляционная взаимосвязь уровня HbA1c и неврологических нарушений, что свидетельствует о важной роли длительной гипергликемии не только в возникновении, но и в течении ИИ, что следует учитывать при оценке прогноза эффективности лечебно-реабилитационных мероприятий. Выявленная в нашем исследовании взаимосвязь результатов лечения с исходным состоянием углеводного обмена свидетельствует о негативной роли гипергликемии не только в момент развития ОНМК, но и хронической персистирующей гипергликемии, предшествовавшей сосудистой катастрофе. Гипергликемия может способствовать усилению ишемического повреждения головного мозга путем усиления образования свободных радикалов и внутриклеточного ацидоза, нейроваскулярного повреждения и нарушения гематоэнцефалического барьера [21, 22]. В недавнем исследовании, посвященном отдаленным результатам тромбоэктомии при ИИ, показано, что повышенный уровень HbA1c служит предиктором неблагоприятного исхода [23], что соотносится с результатами нашего исследования. Вместе с тем не отмечено зависимости между показателями функциональной независимости в повседневной жизни и уровнем HbA1с. Стоит обратить внимание на то, что использованные шкалы отражают различные аспекты неврологического дефицита. Так, шкалы NIHSS и Скандинавская шкала инсульта посвящены преимущественно неврологической оценке двигательного и/или чувствительного дефицита, в то время как индекс Бартела и МшР – уровню функциональной независимости в повседневной жизни.
На фоне все увеличивающейся в популяции доли лиц, больных СД, очевидно увеличение распространенности СД и среди больных ОНМК. Ведение таких пациентов требует дополнительных мероприятий по выявлению, оценке и коррекции углеводных нарушений.
Заключение
Наличие СД2, его длительность и неудовлетворительное качество гликемического контроля способствуют ухудшению прогноза восстановления неврологического дефицита и исхода инсульта.



