Введение
Ишемический инсульт (ИИ) по-прежнему – одна из ведущих причин заболеваемости, стойкой утраты трудоспособности в России, занимает второе место в структуре общей смертности и первое – среди причин первичной инвалидности [1, 2], обусловленной резидуальным неврологическим дефектом у бóльшей части пациентов; в частности, к концу острого периода инсульта двигательные нарушения выявляются у 81,2% выживших больных [3]. Несмотря на то что в ряде случаев возможно полное восстановление неврологического дефицита, примерно у 2/3 пациентов отмечаются остаточные явления перенесенного ИИ различной степени выраженности и характера, приводящие к стойкой инвалидизации [4]. Так, от 25 до 74% больных среди 50 млн выживших после острого нарушения мозгового кровообращения (ОНМК) во всем мире или требуют частичной помощи, или остаются полностью зависимыми от постороннего ухода [5], у 25–50% пациентов даже после своевременных и адекватно проведенных реабилитационных мероприятий наблюдается умеренная или выраженная инвалидизация [6]. Около 30% больных через полгода после ОНМК и в дальнейшем не в состоянии ходить без посторонней помощи [6].
Важное значение при ведении пациентов после инсульта имеют правильно спланированные реабилитационные мероприятия. Они могут быть в разной степени эффективными для 80% больных после ОНМК, у 10% отмечается полное спонтанное восстановление нарушенных функций, и только для 10% пациентов реабилитационные мероприятия бесперспективны [4]. Концепция нейропластичности играет ключевую роль в реабилитации больных неврологическими заболеваниями. Разнообразные методы и технологии восстановительного лечения основаны на знаниях о механизмах и процессах пластической перестройки [7–11]. Экспериментальные исследования последних лет позволили постулировать один из важных принципов биологического феномена нейропластичности, в дальнейшем активно применяемый при определении программы реабилитационного лечения пациентов с заболеваниями центральной нервной системы (ЦНС): возникновение, существование и эффективное использование нейрональных связей напрямую зависят от их функциональной активности [7, 9, 10, 12].
Несмотря на достижения последних лет и значительный прогресс в области реабилитации больных после инсульта, процессы и механизмы компенсаторных процессов в ЦНС после нарушения мозгового кровообращения продолжают активно изучаться с целью создания новых технологий и терапевтических стратегий, способствующих повышению эффективности реабилитационных мероприятий для этой категории больных. Все более широкое использование нейровизуализационных и нейрофизиологических методов исследования позволяет прицельно изучать процессы реорганизации и пластические изменения в ЦНС, клинически сопровождающиеся функциональным улучшением [1, 3, 12]. Вместе с тем не ясно, насколько полно использован имеющийся потенциал нервной системы для компенсации существующего дефекта, какие механизмы лежат в основе данного процесса и как можно повысить эффективность нейрореабилитационных мероприятий [13–15]. Все это определяет высокую актуальность, социально-экономическую значимость и необходимость дальнейшего всестороннего изучения проблемы функционального восстановления пациентов после ИИ для определения методологии, оптимизации и повышения эффективности терапевтических стратегий для этой категории больных.
Важная роль в реабилитации пациентов после ИИ отводится интегративной терапии с применением лекарственных средств с плейотропными нейропротективными свойствами, доказанной эффективностью и безопасностью [16]. Одним из таких препаратов служит Цитофлавин (ООО «НТФФ ПОЛИСАН», Россия, Санкт-Петербург), неоднократно продемонстрировавший в многоцентровых рандомизированных двойных слепых плацебо-контролируемых исследованиях высокую клиническую эффективность, безопасность и способность улучшать исход заболевания [16–19], что позволяет широко применять его в клинической практике в большинстве регионов нашей страны. Входящие в состав Цитофлавина два метаболита (янтарная кислота и инозин) и два кофермента-витамина (рибофлавин и никотинамид) обладают однонаправленным и взаимопотенцирующим действиями на разные энергосинтезирующие системы через различные рецепторные, ферментные и медиаторные системы [17]. Действие Цитофлавина направлено на активацию прежде всего тех систем, функционирование которых в первую очередь страдает в условиях ишемии и гипоксии [18], и таким образом вектор влияния этого нейропротектора направлен на основные механизмы повреждения мозга, в связи с чем важность его применения с первых дней возникновения ИИ не вызывает сомнений и патогенетически оправдано.
В исследованиях с клинико-нейровизуализационным сопоставлением у пациентов в остром периоде ИИ было отчетливо продемонстрировано достоверное положительное влияние Цитофлавина на область морфологических изменений с тенденцией к более полному сохранению вещества головного мозга у этих больных, что приводило к регрессу неврологического дефицита и увеличению способности к самообслуживанию [17]. Поскольку до сих пор нет единодушного мнения клиницистов об эффективности и целесообразности применения нейропротективных препаратов из имеющегося арсенала лекарственных средств, дальнейшие клинические и инструментальные исследования в этой области представляются актуальными и перспективными.
Целью открытого рандомизированного контрольно-сравнительного клинико-нейрофизиологического исследования стала оценка влияния Цитофлавина (ООО «НТФФ ПОЛИСАН», Россия, Санкт-Петербург) на степень функционального восстановления пациентов при включении его в комплексную терапию в раннем и позднем восстановительных периодах ИИ.
Методы
В исследовании приняли участие 60 пациентов после ИИ в бассейнах правой или левой средней мозговой артерии. Средний возраст больных составил 57,5±6,3 года, длительность заболевания – от 3 до 12 месяцев (в среднем 5,6±2,2 месяца). Диагноз верифицирован с помощью магнитно-резонансной томографии головного мозга, размер очага ИИ составлял от 1 до 3 см.
Критерии включения пациентов в исследование: первичный ИИ в бассейне средней мозговой артерии; единичный значимый очаг инфаркта, размер которого не превышал 3 см; давность инсульта 3–12 месяцев; возраст исследуемых от 18 до 70 лет; наличие двигательных нарушений.
Критерии невключения пациентов в исследование: повышенная чувствительность к Цитофлавину или к одному из составляющих его активных веществ; прием других препаратов, обладающих антиоксидантными, антигипоксическими или иными метаболическими и ноотропными эффектами; синдром неглекта; выраженные речевые, когнитивные и двигательные нарушения (до степени плегии и невозможности сидеть); психические, онкологические или метаболические заболевания; алкоголизм, наркомания; тяжелые, декомпенсированные или нестабильные соматические болезни или иные состояния, угрожающие жизни или ухудшающие прогноз пациента; беременность, период лактации; наличие противопоказаний к проведению транскраниальной магнитной стимуляции (ТМС).
Также в исследовании приняли участие 35 здоровых лиц без какой-либо неврологической патологии, сопоставимых по возрасту с группой пациентов с ИИ (средний возраст – 51,3±5,2 года). Все исследуемые были правшами (тестирование проводилось с помощью Эдинбургского опросника [20]).
Для объективизации степени выраженности клинических симптомов применяли оригинальную анкету, шкалы NIHSS и Рэнкина для оценки выраженности двигательных нарушений; модифицированную Ноттингемскую шкалу для анализа сенсорных нарушений; индекс Бартел для оценки степени функциональной независимости и повседневной активности. Нейрофизиологические методы исследования использовали для оценки функционального состояния эфферентных и афферентных систем. Они включали ТМС с фасилитацией вызванных моторных ответов (ВМО) для определения скорости проведения по кортикоспинальному тракту (время центрального моторного проведения – ВЦМП) и порога ВМО в покое и в тесте с фасилитацией, коротколатентные соматосенсорные вызванные потенциалы (ССВП) для оценки активности нейронов соматосенсорной системы (латентные периоды N9-, N20-, P25- и N22-, P37-, N45-компонентов) и скорости афферентного проведения (центральное время проведения – ЦВП) ЦВП N20–Р37 и ЦВП N22–Р37.
Статистическая обработка полученных данных проведена при помощи компьютерной программы Statistica 10 for Windows. Достоверность различий определена с помощью параметрических и непараметрических методов статистики с использованием критериев Стьюдента и Уилкоксона–Манна–Уитни соответственно. За статистически значимые принимались различия при p<0,05.
Рандомизация пациентов проведена методом случайных конвертов в соответствии со строго определенными критериями, включившими средний возраст, длительность заболевания, патогенетический подтип инсульта, локализацию и размеры ишемического очага и выраженность неврологического дефицита в период отбора. В итоге больные, соответствовавшие критериям включения, были разделены на две группы. Пациенты 1-й, или основной, группы (30 человек, 17 женщин и 13 мужчин, средний возраст – 58,3±7,2 года) в составе базисной терапии получали Цитофлавин по схеме: первые 10 дней внутривенно по 10 мл Цитофлавина на 200 мл 0,9%-ного раствора хлорида натрия 1 раз в день, затем в течение 25 дней перорально по 2 таблетки 2 раза в день. Пациенты 2-й, или контрольной, группы (30 человек, 12 женщин и 18 мужчин, средний возраст – 56,7±6,4 года) получали медикаментозную терапию, согласно стандартам оказания медицинской помощи при ИИ в течение 35 дней. Всем больным было проведено клинико-нейрофизиологическое исследование до и после курса лечения. Здоровые испытуемые однократно обследовались с помощью ТМС и коротколатентных ССВП.
Исследование было одобрено локальным Этическим комитетом Федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования «Институт повышения квалификации» Федерального медико-биологического агентства (протокол № 4 от 17.01.2018). Все участники подписали протокол информированного согласия в соответствии с требованиями Хельсинской декларации.
Результаты исследования
У всех больных после ИИ на обеих сторонах тела была проанализирована представленность наиболее часто встречающихся симптомов двигательного и сенсорного дефицита до и после курса лечения; при этом учитывались лишь наиболее значимые, на наш взгляд, клинические симптомы (табл. 1, 2).

Сравнительный клинический анализ данных пациентов выделенных групп после прохождения курса терапии показал достоверно менее выраженные проявления пареза на обеих сторонах тела у больных основной группы (табл. 1, 2), спастичности и патологических знаков на стороне гемипареза по сравнению с пациентами контрольной группы (табл. 1). Кроме того, у больных основной группы после проведенного 35-дневного курса лечения отмечалось достоверное улучшение статолокомоторных и постуральных функций по сравнению с пациентами контрольной группы.
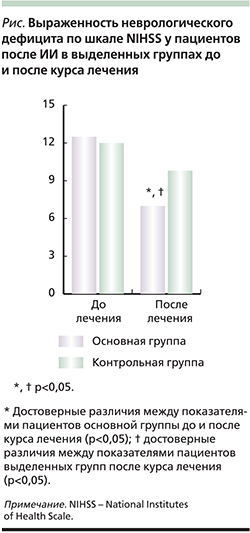 У пациентов основной группы после проведенного курса лечения с использованием Цитофлавина отмечено достоверное уменьшение выраженности неврологического дефицита, согласно шкале NIHSS: до лечения – 12,3±6,3 балла, после лечения – 7,4±3,2 по сравнению с аналогичными данными больных контрольной группы: 11,9±4,7 и 9,5±4,3 балла соответственно (см. рисунок). Следует отметить, что у больных основной группы после проведенной терапии менее выраженные симптомы пареза в верхних конечностях и улучшение статолокомоторных функций коррелировали с показателями шкалы NIHSS: r=0,42, p<0,05 и r=0,34, p<0,05 соответственно.
У пациентов основной группы после проведенного курса лечения с использованием Цитофлавина отмечено достоверное уменьшение выраженности неврологического дефицита, согласно шкале NIHSS: до лечения – 12,3±6,3 балла, после лечения – 7,4±3,2 по сравнению с аналогичными данными больных контрольной группы: 11,9±4,7 и 9,5±4,3 балла соответственно (см. рисунок). Следует отметить, что у больных основной группы после проведенной терапии менее выраженные симптомы пареза в верхних конечностях и улучшение статолокомоторных функций коррелировали с показателями шкалы NIHSS: r=0,42, p<0,05 и r=0,34, p<0,05 соответственно.
У многих пациентов после ИИ наблюдались разнообразные чувствительные нарушения (43,3–70,0%) на стороне гемипареза (табл. 3), в меньшей степени эти расстройства обнаруживались на противоположной стороне тела (6,7–26,7%). Статистически значимые изменения представленности сенсорных нарушений после проведенного курса лечения были отмечены в основной группе больных только на стороне гемипареза, и они относились к проприоцептивной чувствительности (табл. 3).
Таким образом, у пациентов после ИИ, получавших Цитофлавин в составе комплексной терапии, наблюдалась существенная редукция сенсомоторных нарушений, при этом бóльшая положительная динамика отмечена в отношении двигательного дефицита.
Также у пациентов основной группы после прохождения курса терапии с использованием Цитофлавина наблюдалось достоверно меньшее нарушение повседневной активности и функциональной независимости, оцененное по шкале Бартел до лечения в 42,5±7,5 и после курса терапии в 68,3±6,2 балла против 43,7±4,5 и 52,8±5,7 балла соответственно в контрольной группе.
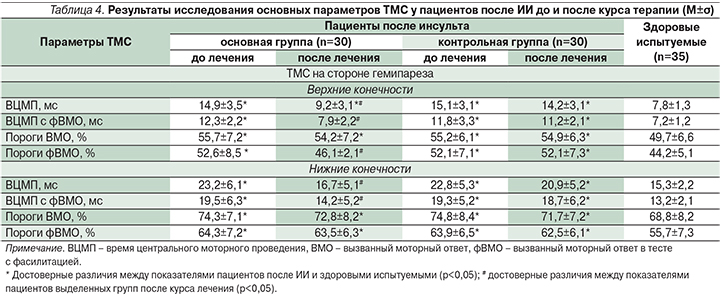
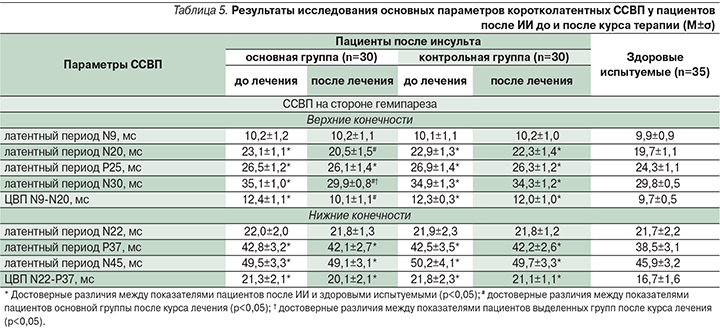
Сравнительный нейрофизиологический анализ данных пациентов после ИИ в выделенных группах также продемонстрировал статистически значимые различия между ними после курса проведенной терапии. В табл. 4, 5 представлены усредненные показатели ТМС и коротколатентных ССВП соответственно справа и слева у здоровых испытуемых и у больных после ИИ основной и контрольной группах.

У пациентов основной группы после проведенной терапии наблюдались достоверно меньшие показатели ВЦМП при исследовании верхних и нижних конечностей с помощью ТМС (табл. 4), ЦВП N9-N20 и латентных периодов N20 и N30 при исследовании верхних конечностей с помощью коротколатентных ССВП (табл. 5), что свидетельствует об улучшении функциональной активности эфферентных и афферентных быстропроводящих трактов на стороне гемипареза после проведенной терапии.
Следует отметить хорошую переносимость Цитофлавина, сочетаемость с препаратами других классов, отсутствие каких-либо нежелательных явлений при его пероральном применении. Все пациенты хорошо переносили Цитофлавин при парентеральном введении, только у 3 (10,0%) больных в самом начале использования препарата возникали побочные реакции в виде чувства жара (3 человека), покраснения лица и кистей (2 человека) и потливости (1 человек). Описанные явления длились не более 15 минут и проходили самостоятельно, не требуя какой-либо дополнительной коррекции. Уменьшение последующей скорости парентерального введения Цитофлавина позволило избежать возникновения каких-либо нежелательных реакций у этих пациентов.
Заключение
Результаты открытого рандомизированного контрольно-сравнительного клинико-нейрофизиологического исследования показали, что применение препарата Цитофлавин (ООО «НТФФ ПОЛИСАН», Россия, Санкт-Петербург) в комплексной терапии пациентов в раннем и позднем восстановительных периодах ИИ приводит к достоверному снижению постинсультного дефицита, улучшению повседневной активности и бытовой независимости больных, сопровождается достоверным улучшением функциональной активности эфферентной и афферентной проводящих систем.
В исследованиях с использованием ТМС и магнитно-резонансной трактографии было неоднократно продемонстрировано, что к факторам, определяющим эффективность реабилитационной терапии, относится целостность белого вещества или поражение нисходящих двигательных путей, а не самой моторной коры [1, 6, 21]. Было показано, что при страдании двигательной коры существенной компенсации имеющегося дефекта не происходит, тогда как при выраженном повреждении нисходящих эфферентных проводников возможно существенное функциональное восстановление [1, 3]. Это свидетельствует о бóльшем нейропластическом потенциале белого вещества проводящих структур ЦНС даже при тяжелом повреждении по сравнению с крупными кортикальными поражениями, и прогностической значимости функциональной активности кортикоспинального тракта для последующего восстановления постинсультного дефицита [1, 6].
Существует тесная связь афферентной и эфферентной составляющих биологического процесса нейропластичности [22], и на всех уровнях нервной системы соматосенсорная система с помощью различных механизмов влияет на обеспечение, видоизменение согласно двигательной задаче и реализацию моторного контроля [23], причем именно афферентный поток, особенно проприоцептивный, обеспечивает гибкость двигательного управления [4]. Клинико-нейрофизиологические данные, полученные от больных после ИИ, использовавших в составе восстановительной терапии Цитофлавин, свидетельствуют об увеличении функциональной пластичности всей системы произвольной двигательной активности после проведенного лечения, что повышает эффективность дальнейшего реабилитационного процесса, вероятность лучшего функционального восстановления и позитивного исхода для этих пациентов. Все это позволяет рекомендовать использование в составе комплексной терапии в период восстановления после ИИ.



