Введение
По данным различных исследований, причиной кровотечений из желудочно-кишечного тракта в 3–27% случаев являются ангиодисплазии [1]. Ангиодисплазии (сосудистые аномалии, сосудистые эктазии, телеангиоэктазии, артериовенозные мальформации) представляют собой аномально расширенные, извитые кровеносные сосуды от 1 до 15 мм, локализованные в подслизистом слое кишки [2, 3].
По морфологическому строению ангиодисплазии подразделяются на венозные (капиллярный тип, кавернозный тип), артериальные и артериовенозные [1]. Сосудистые аномалии бывают наследственными (болезнь Рандю–Ослера–Вебера) и приобретенными. Ангиодисплазии подразделяются на доброкачественные (гемангиомы) и злокачественные (ангиосаркомы) [3].
При гистологическом исследовании в подслизистом слое кишки выявляется множество измененных сосудов с тонкими стенками, анастомозы между расширенными капиллярами и венами [2, 3].
Ангиодисплазии могут протекать бессимптомно, иногда являются причиной острых кровотечений, но чаще всего источником хронической кровопотери [2, 4]. По данным отечественных авторов, наиболее часто (66,7 %) ангиодисплазии локализовались в правой половине ободочной и терминальном отделе подвздошной кишки, у 25% пациентов – в сигмовидной кишке [1].
Ангиодисплазии чаще встречаются у больных старше 60 лет с сердечно-сосудистой патологией, заболеваниями почек, свертывающей системы крови, циррозом печени, но могут быть выявлены и у лиц молодого возраста [2, 3].
У больных ангиодисплазией выявлена связь с болезнью Виллебранда, что объясняется патологией свертывающей системы крови, а также снижением уровня серотонина, приводящим к дилатации сосудов и повышению их проницаемости [3].
Этиология и патогенез ангиодисплазий до конца не ясны. Наиболее популярна в литературе теория Boley S.J., согласно которой спазм гладкой мускулатуры приводит к обструкции вен подслизистого слоя, что ведет к их расширению, а затем и к расширению капилляров, нарушая функцию прекапиллярных сфинктеров с раскрытием артериовенозных шунтов [1, 2].
Ангиогенез является важным биологическим процессом при гипоксии или ишемии слизистой оболочки тонкой кишки, приводящим к образованию новых сосудов (неоваскуляризация) в результате дисбаланса между ангиогенными и антиангиогенными факторами [1, 3].
К основным методам диагностики ангиодисплазий относятся эндоскопические и лучевые. В первую очередь применяются эзофагогастродуоденоскопия (ЭГДС) и колоноскопия. В отсутствие источника кровотечения или при подозрении на кровотечение из тонкой кишки целесообразно проводить интестиноскопию или капсульную эндоскопию (КЭ).
Клиническое руководство ACG и ESGE рекомендуют КЭ в качестве процедуры первой линии для больных с подозрением на кровотечение из тонкой кишки после выполнения ЭГДС и колоноскопии [5, 6].
КЭ рекомендуют проводить как можно раньше – не позднее 14 дней с момента кровотечения. Проведение КЭ в более поздние сроки понижает ее диагностическую ценность.
Двухбаллонная энтероскопия также используется при подозрении на кровотечение и имеет ряд преимуществ: возможность взятия биопсии, аспирации кишечного содержимого для улучшения визуализации и проведения лечебных манипуляций. Но, поскольку она является сложной манипуляцией, проведение ее целесообразно после выполнения КЭ, когда известно о локализации ангиодисплазий [2–4, 7, 8]. Компьютерная томография и магнитно-резонансная ангиография также обеспечивают быструю неинвазивную диагностику при поиске кровотечения [2, 4, 6].
Решающее значение в диагностике, выборе способа и объема хирургического лечения ангиодисплазий имеет селективная мезентерикография. К характерным признакам ангиодисплазии относятся расширение подвздошно-ободочной артерии, контрастирование дренирующей вены на ранней стадии исследования (на 3–4-й секунде), наличие четких и интенсивных сосудистых сплетений в кишечной стенке, говорящих о наличии артериовенозных шунтов, и медленная венозная разгрузка.
Мезентериальная ангиография позволяет диагностировать скрытое кровотечение при объеме ≥0,5 мл/мин [1].
При обзорной рентгенографии брюшной полости можно увидеть атипично расположенные разнокалиберные флеболиты, что является характерным признаком ангиодисплазии [5].
Проведенные исследования не раз демонстрировали превосходство КЭ у больных с подозрением на кровотечение из тонкой кишки по сравнению с энтерографией, мультиспиральной компютерной томографией и ангиографией, магнитно-резонансной томографией [2, 4].
Однако КЭ доступна не во всех медицинских учреждениях и является дорогостоящим исследованием. В связи с этим необходим поиск других методов определения ангиодисплазии. Проводятся исследования, в которых определяется значение ангиопоэтинов в диагностике ангиодисплазий. Избыток Ang2 (ангиопоэтин-2) приводит к появлению расширенных и ослабленных сосудов, что доказывает роль Ang2 в патогенезе ангиодисплазий.
В проведенном исследовании показано, что повышение уровня Ang2 специфично для ангиодисплазии, в то время как повышение содержания Ang1 (ангиопоэтин-1) может быть связано с кровотечением или анемией различной этиологии [3, 7].
Существуют различные способы лечения ангиодисплазий, применение которых зависит от распространенности поражения и величины кровопотери [1, 3, 4, 6].
Эффективность лекарственной терапии также оценивается в настоящее время. Фармакологическая терапия проводится с использованием октреотида, талидомида, леналидомида. Действие талидомида основано на ингибировании ангиогенеза путем подавления сосудистого эндотелиального фактора роста. Октреотид ингибирует ангиогенез путем подавления VEGF (фактора роста сосудистого эндотелия), усиления агрегации тромбоцитов и может быть использован для лечения больных с рецидивирующими кровотечениями из ангиодисплазий [1, 3–5].
Эндоскопические методы лечения довольно распространены и эффективны для пациентов с ангиодисплазиями тонкой кишки.
Аргоноплазменная коагуляция является наиболее широко используемым методом лечения ангиодисплазии тонкой кишки. Достаточно эффективна фотокоагуляция, которая вызывает более глубокий и протяженный фиброз тонкой кишки.
При незначительных периодических кишечных кровотечениях выполняются эндоскопическая абляция, фотокоагуляция или склерозирующее лечение тонкой кишки [1, 3].
Хорошо себя зарекомендовала суперселективная транскатетерная эмболизация, которая является современным методом выбора для лечения кровотечения из ангиодисплазий тонкой кишки [3].
Однако, несмотря на современные методы терапии, кровотечения из ангиодисплазий тонкой кишки часто рецидивируют.
Острые профузные, хронические рецидивирующие кишечные кровотечения, приводящие к тяжелой анемии или угрожают жизни пациента, служат показанием к хирургическому лечению. При этом выполняется резекция пораженного участка тонкой кишки. Однако при помощи КЭ следует определить точную локализацию пораженного участка, чтобы избежать рецидива кровотечения.
Клиническое наблюдение
Ниже представлен редкий клинический случай диагностики и ведения пациента с артериовенозными ангиодисплациями тонкой кишки.
Больной В. 58 лет обратился в МКНЦ в 2013 г. с жалобами на схваткообразные боли в верхних отделах живота, усиливающиеся после приема пищи, вздутие живота, изжогу, отрыжку воздухом; кашицеобразный стул 1–2 раза в сутки без видимых патологических примесей.
Анамнез. Известно, что в течение 1,5 лет появились ноющие боли в животе после приема пищи, тенденция к послаблению стула. Год назад отметил слабость, головокружение, в связи с чем обратился к врачу. В анализе крови было отмечено снижение уровня гемоглобина до 119 г/л (сывороточное железо в предела референсных значений). Больному проведено обследование для исключения онкопатологии, выявления источника кровопотери. При ЭГДС выявлены признаки гастрита, по данным колоноскопии патологии не установлено. По данным ультразвукового исслендования надключичных, паховых областей, печени, брюшной полости, забрюшинного пространства, малого таза (ТРУЗИ), почек: кистозное образование правой доли печени, диффузные изменения предстательной железы. Больному назначены ферментные препараты, спазмолитики с положительным эффектом. В течение месяца до госпитализации вновь стали беспокоить боли в животе, неустойчивый стул. Госпитализирован для обследования и лечения.
Данные физикального исследования. Общее состояние удовлетворительное. Астенического телосложения. Индекс массы тела – 17,8 кг/м². Кожные покровы физиологической окраски, видимые слизистые бледно-розовые. Над всей поверхностью легких везикулярное дыхание, хрипов нет. Тоны сердца приглушены, ритм правильный. Шумов нет. Частота сердечных сокращений – 70 в минуту, артериальное давление – 110 и 60 мм рт.ст. Язык влажный, обложен малым количеством белого налета. Живот мягкий, умеренно вздут, болезненный в эпигастральной области, левом подреберье. Перитонеальных симптомов нет. Печень у края реберной дуги. Селезенка не пальпируется. Симптом «поколачивания» по поясничной области отрицательный.
Состояние больного расценено как обострение хронического панкреатита. Назначено обследование.
По данным лабораторных методов исследования (общий, коагулограмма, общий анализ мочи), все показатели в пределах референсных значений. В биохимическом анализе крови: гиперхолестеринемия – 5,8 ммоль/л (липопротеиды низкой плотности – 4,7 ммоль/л). Анализ кала на скрытую кровь: реакция отрицательная. По данным ЭГДС выявлен поверхностный гастрит, тест на хеликобактерную инфекцию отрицательный. Проведена биопсия из постбульбарных отделов двенадцатиперстной кишки (для исключения целиакии) – морфологическая картина дуоденита. Антитела к глиадину, тканевой трансглутаминазе, париетальным клеткам и внутреннему фактору не выявлены.
По данным УЗИ органов брюшной полости выявлены аденомиоматоз желчного пузыря (очаговая форма), полипы желчного пузыря, гиперкинезия желчного пузыря. По данным УЗИ брюшного отдела аорты и ее ветвей (чревного ствола, верхней мезентериальной и селезеночной артерий): атеросклероз брюшного отдела аорты, дефицит кровотока в висцеральных ветвях брюшного отдела аорты не выявлен.
На четвертые сутки госпитализации больной отметил появление слабости, головокружение (подобная картина наблюдалась год назад). По данным ЭКГ ритм синусовый, частота сердечных сокращений – 80 в минуту. В общем анализе крови отмечено снижение уровня гемоглобина до 120 г/л (исходно 146 г/л). В биохимическом анализе крови признаков дефицита железа не отмечено.
Больному требовалось исключить кровотечение и онкопроцесс, в связи с чем проведено обследование.
По данным мультиспиральной компьютерной томографии органов брюшной полости, малого таза: картина мелких простых кист печени, атеросклероза брюшного отдела аорты, доброкачественной гиперплазии предстательной железы. По данным УЗИ щитовидной железы патологии не выявлено.
Для выявления источника кровопотери больному проведено обследование. При колоноскопии органической патологии со стороны толстой кишки не выявлено. По данным рентгенологического исследования пищевода, желудка, двенадцатиперстной кишки и тонкой кишки в петлях тощей кишки (в средних отделах) определяется участок протяженностью 28 см с краевыми округлыми дефектами наполнения размером до 0,3 см.
Учитывая полученную рентгенологическую картину, принято решение о проведении капсульной эндоскопии. По данным КЭ: на границе тощей и подвздошной кишки и в подвздошной кишке – инъекция сосудов, определяются варикозно расширенные вены, артериовенозные мальформации без признаков кровотечения на момент проведения исследования (рис. 1–2).
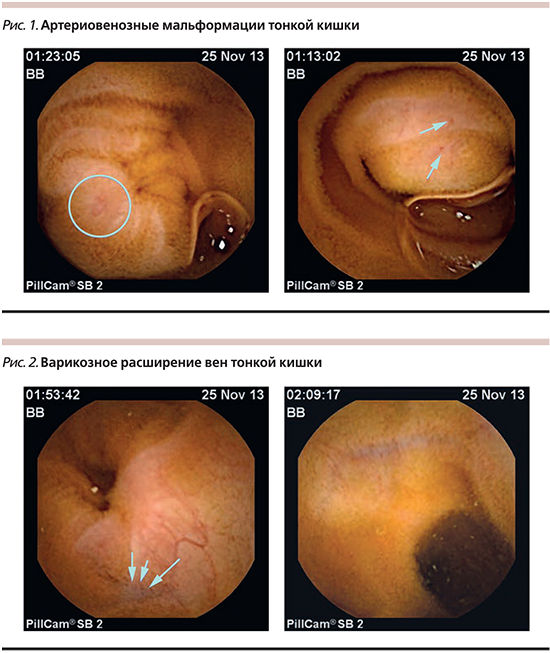
На основании полученных результатов следует, что наиболее вероятной причиной снижения уровня гемоглобина явилось кровотечение из артериовенозных мальформаций тонкой кишки. Больному проведена терапия ферментными препаратами, ингибиторами протонной помпы, кишечными антисептиками, регуляторами моторики с положительным эффектом в виде купирования болевого и диспепсического синдромов, нормализации стула.
Больной динамически наблюдается в течение 5 лет. За это время эпизодов снижения уровня гемоглобина не отмечено. Чувствует себя удовлетворительно.
Таким образом, только с помощью проведения капсульной эндоскопии удалось выявить источник кровопотери у пациента.
Заключение
Капсульная эндоскопия помогает диагностировать острые и хронические кровотечения, источником которых являются ангиодисплазии тонкой кишки, что позволяет начать своевременное лечение, а также выявить бессимптомно протекающие ангиодисплазии, что дает возможность предупредить опасные для жизни осложнения.


