Введение
Изменения в кишечной флоре стали ведущим механизмом увеличения распространенности заболеваний желудочно-кишечного тракта (ЖКТ) и других органов и систем [1, 2]. Благодаря улучшениям в гигиене и изменениям в характере питания западная человеческая диета содержит в несколько тысяч раз меньше бактерий, чем в доиндустриальную эпоху [3, 4]. Частично это связано с использованием обработанных и стерильных продуктов, которые содержат искусственные подсластители и консерванты, а не свежие фрукты и овощи [5], или продуктов, содержащих полезные бактерии с противовоспалительной активностью [6, 7], и с приемом антибиотиков. Масса мета-анализов свидетельствует, что пробиотики имеют потенциал для улучшения качества жизни людей с заболеваниями ЖКТ и других органов и систем.
Впервые понятие «пробиотики» появилось в медицинской терминологии в 1954 г. благодаря Ferdinand Vergina, который описал в монографии «Anti- und Probiotika» отрицательные воздействия антибиотиков и других антибактериальных препаратов на микрофлору кишечника, а также бактерии, оказывающие положительный эффект на интестинальную микрофлору, и назвал их «probiotika». Термин «пробиотик» от латинского pro bio – «для жизни» был предложен D.M. Lilly и R.H. Stilwell в 1965 г. как альтернатива термину «антибиотики», означающему «против жизни». L. Richard и R. Parker в 1977 г. использовали термин «пробиотик» для обозначения живых микроорганизмов и продуктов их ферментации, обладающих антагонистической активностью по отношению к патогенной микрофлоре [8].
Современное определение пробиотиков было дано Всемирной организацией здравоохранения (ВОЗ) в 2002 г: «Пробиотики – это живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина». Продовольственная и сельскохозяйственная организации при ООН (Food and Agriculture organization of the United Nations – FAO) и ВОЗ (2002) приняли совместный вердикт, согласно которому микроорганизмы, входящие в состав пробиотика, должны [9]:
- быть непатогенными и нетоксичными;
- выживать в кишечнике;
- сохранять стабильность состава и жизнедеятельность в течение всего срока хранения;
- состоять из живых клеток, которые обладают высокой адгезивной и антагонистической активностью по отношению к патогенным и условно-патогенным микроорганизмам;
- не должны угнетать нормальную микрофлору кишечника;
- иметь генетический паспорт и доказательство генетической стабильности (быть чувствительными или иметь природную резистентность к антибиотикам).
В октябре 2013 г. в Лондоне собралась группа специалистов FAO/ВОЗ для повторного обсуждения использования термина «пробиотик». В итоге работы комиссии были внесены следующие уточнения [10]:
- «Живые культуры», которые обычно ассоциируются с ферментированными продуктами, не относятся к пробиотикам, если они не были идентифицированы, и в отсутствие подтверждения их лечебно-профилактического воздействия. Традиционные ферментированные продукты являются составной частью здорового питания, а присутствующие в них бактерии могут оказывать положительное влияние на здоровье человека. Однако, чтобы эти продукты назывались пробиотиками, необходимо подтверждение их лечебно-профилактического воздействия. Следует учитывать, что бактерии йогуртной закваски – Lactobacillus bulgaricus и Streptococcus thermophilus – относятся к пробиотикам, поскольку доказано, что они способствуют уменьшению выраженности симптомов непереносимости лактозы.
- Неидентифицированная пересаженная фекальная микробиота не считается пробиотиком.
- Новые симбионты и консорциумы бактерий, штаммы которых выделены из биологических образцов, взятых от человека, при соответствующем подтверждении безопасности и эффективности относятся к пробиотикам.
Согласно отечественному ГОСТ Р 52349-2005 «Продукты пищевые. Продукты пищевые функциональные. Термины и определения», пробиотические микроорганизмы – это живые непатогенные, нетоксигенные микроорганизмы, поступающие в кишечник человека с пищей, благотворно воздействующие на организм человека и нормализующие состав и биологическую активность микрофлоры пищеварительного тракта (микроорганизмы родов Bifidobacterium, Lactobacillus, Propionibacterium, а также используемые в ассоциациях с ними бактерии рода Lactococcus, вида Streptococcus thermophilus) [11].
Пробиотики: современное состояние рынка
Глобальный рынок пробиотиков увеличивается из-за возросшего спроса потребителей, которые используют эти продукты для улучшения здоровья и предотвращения некоторых патологических состояний, таких как аллергические и желудочно-кишечные заболевания, пробиотики модулируют иммунную систему и обеспечивают гомеостаз кишечной микробиоты. На данный момент рынок пробиотиков растет от 5 до 30% в год в зависимости от страны и типа продукта. За 11 месяцев 2016 г. в России розничные продажи лекарственных препаратов и БАДов, содержащих про- и пребиотики, а также их комбинации, составили порядка 16 млрд руб., что эквивалентно 43 млн упаковок. По данным Euromonitor International, глобальный рынок пробиотиков оценивается приблизительно в 40 млрд евро, сегмент йогуртов продолжает оставаться доминирующим на данном рынке, хотя сегмент пробиотических добавок растет более быстрыми темпами. На мировом рынке товарооборот пробиотиков с 2016 по 2021 г. вырастет на 6,6% и составит 96 млрд долл. При этом в разных странах мира показатель роста будет сильно различаться: в ОАЭ он составит 156%, в Греции – 146%, в Южной Африке – 122%, в Израиле – 116%, в Словакии – 100%. Это максимальные показатели роста по странам мира. В стоимостном выражении лидером роста глобального рынка пробиотиков остаются США, к 2021 г. их рынок здесь увеличится на 1,1 млрд долл., рынок Италии вырастет на 139 млн долл., Австралии – на 51 млн, ЮАР – на 35 млн, Тайваня – на 33 млн, Японии – на 32 млн. Наиболее быстрыми темпами в Европе увеличивается опять-таки сегмент пробиотических добавок. Крупнейшим их европейским рынком является Италия (около 500 млн евро), за ней следуют Россия (177 млн), Франция (104 млн), Польша (72 млн) и Германия (64 млн). [12].
Эффективность поликомпонентных пробиотических консорциумов зависит от многих факторов, в т.ч. от физиологических особенностей человека, наличия хронических и острых заболеваний и др. Исследователи всего мира ведут поиск новых штаммов пробиотических бактерий с целью создания на их основе более активных пробиотических препаратов, причем для регулярного потребления, т.е. в составе продуктов питания.
Увеличивающийся объем экспериментальных данных активно указывает на то, что триллионы микробов кишечного микробиома, которые колонизируют кишечник, сильно влияют как на здоровье, так и на заболевания человека. Наша микрофлора облегчает пищеварение, генерирует необходимые питательные вещества с помощью микробных метаболических активностей, опосредуют связь мозга с кишечником, модулирует иммунные реакции хозяина и извлекает энергию из пищи [13].
Сегодня во всем мире проводятся тысячи исследований различного уровня о влиянии пробиотиков на различные заболевания. Участниками исследования становятся как животные, так и пациенты с разной патологией.
Вкратце, в работах, в основе которых лежало сочетание рандомизированных исследований с людьми и данных о животных, было установлено следующее:
- Только образцы кала не обеспечивают точный или достаточный портрет взаимодействия между пробиотиками, ранее существовавшим микробиомом человеческого хозяина и общим здоровьем.
- Некоторые микробиомы людей сопротивляются колонизации пробиотиками, но микробиомы других людей изменяются в ответ на пробиотики, причем иногда по-разному и на разных уровнях желудочно-кишечного тракта.
- Характеристики как отдельного человека, так и его микробиома позволяют в значительной степени предсказывать эффекты пробиотиков в организме этого человека.
- Экспериментальные модели на мышах не очень информативны или надежны в отношении понимания эффектов пробиотиков у людей.
Данные выводы открыли ящик Пандоры, в результате чего появилась масса вопросов: что же нужно знать о пробиотиках? Врачи и микробиологи, которые хотят исследовать терапевтические эффекты пробиотиков, должны будут принять во внимание текущую неопределенность в отношении их использования, очень персонифицированные эффекты, которые они оказывают на разных людей, и необходимость тщательного выбора доказательств, прежде чем принимать решение, какой пробиотик использовать, у кого, для чего и почему [14].
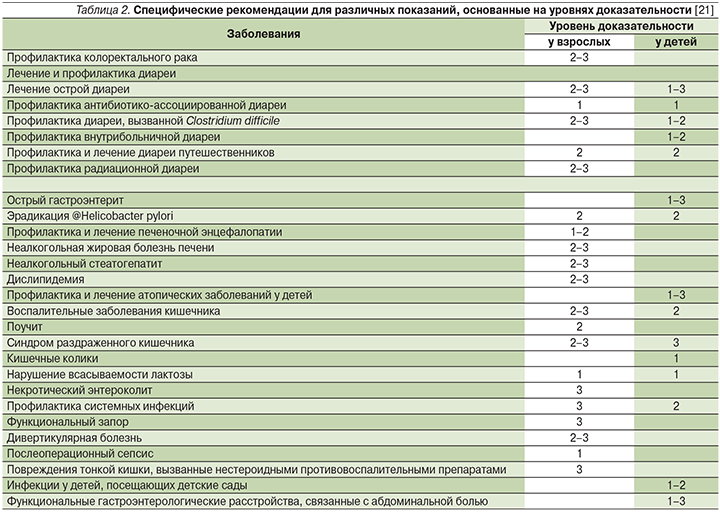
Тем не менее эффективность использования пробиотиков в профилактике и лечении желудочно-кишечных и прочих заболеваний получила в последние годы значительную доказательную поддержку [15–19]. Ниже приводятся уровни доказательности влияния пробиотиков на различные заболевания у детей и взрослых (табл. 1, 2).

Нынешние взгляды на клиническое применение различных про- или пребиотиков в гастроэнтерологии обобщены в руководстве Всемирной гастроэнтерологической организации WGO и представлены в табл. 2 [21].
В настоящее время на глобальном рынке пробиотиков доступны сотни различных бактериальных штаммов, следовательно, выбор наиболее подходящего пробиотического продукта становится очень сложным и фрагментированным. По этим причинам безопасность и эффективность пробиотиков считаются основным критерием использования любого микроорганизма при разработке пробиотических продуктов [22].
Lactobacilli и Bifidobacteria – основные микроорганизмы, используемые в качестве пробиотиков, и действительно многочисленные виды, относящиеся к этим родам, были зарегистрированы как безопасные и эффективные для улучшения здоровья пациентов [23]. К числу наиболее распространенных штаммов лактобацилл и бифидобактерий, используемых для производства пробиотиков, относятся L. acidophilus NCFM, L. acidophilus DDS-1, L. acidophilus SBT-2062, L. acidophilus LA-1/ LA-5, L. casei Shirota, L. casei Immunitas, L. fermentum RC-14, L. johnsonii La 1/Lj1, L. paracasei CRL 431, L. plantarum, L. reuteri SD 2112/MM2, L. rhamnosus GG, L. rhamnosus GR-1, L. rhamnosus 271, L. rhamnosus LB21, L. salivarius UCC118, L. lactis L1A, B. animalis, B. lactis B6-12, B. longum BB 536, B. longum SBT-2928, B. breve.
Современная классификация пробиотиков основана на различиях препаратов по составу и комбинациям живых микробных клеток со стимуляторами их роста и метаболитами.
Эффективность лечения пробиотиками и их переносимость во многом зависят от выбора препарата.
Современное пробиотическое средство должно соответствовать ряду требований, перечисленных ниже:
- натуральное происхождение;
- безопасность при длительном применении;
- устойчивость к действию соляной кислоты и желчи;
- сохранность микроорганизмов в адекватной дозе к концу срока хранения пробиотика;
- высокий колонизационный потенциал бактерий;
- эффективность, доказанная контролируемыми клиническими испытаниями;
- входящие в состав пробиотика микроорганизмы должны быть выделены от здоровых доноров и быть гено- и фенотипически классифицируемыми.
Интересно, что модуляция состава микробиоты кишечника была предложена в качестве одного из основных механизмов пробиотической активности [24]. Несколько исследований показало, что сочетание специфических бактериальных штаммов, принадлежащих к видам Lactobacillus и Bifidobacterium, может действовать в оптимальной синергии для восстановления микробного пейзажа кишечника [25–27]. Так, например, в 2015 г. L. Drago et al. [28] определили иммуномодулирующую синергию L. salivarius LS01 и B. breve BR03, приведшую к увеличению иммуномодулирующей активности по сравнению с активностью каждого отдельного штамма. Также B. longum BB536 и L. rhamnosus HN001 – два хорошо изученных пробиотических штамма, часто используемых в комбинации, способны к выживанию в неблагоприятных желудочно-кишечных условиях и адгезии к слизистой оболочке кишечника [29]. Эти пробиотические штаммы обладают сильной иммуномодулирующей активностью, способны снижать распространенность экземы у пациентов и ингибировать адгезию грамотрицательных микроорганизмов в кишечной среде [30–34]. Род Lactobacillus чрезвычайно разнообразен и включает более 230 видов. В него входят такие коммерчески важные штаммы, как casei, paracasei, plantarum, salivarius, reuteri, rhamnosus. Эти штаммы больше нельзя относить к Lactobacillus, реклассификация неизбежна, и по мнению ученых, сам род можно разделить на 12 новых родов. Ученые начинают работать над новой классификацией; названия видов вряд ли изменятся, но неизбежна путаница между коммерческой и «правильной научной» номенклатурой.
Не менее важны и особенности производства пробиотиков, т.к. только высокотехнологичные формы могут отвечать всем требованиям, которые предъявляются к современным пробиотическим продуктам. В настоящее время существуют четкие критерии оценки качества и безопасности штаммов, используемых в качестве стартовых культур для произвдства пробиотических препаратов, БАДов, продуктов функционального питания [35]. Это целый комплекс характеристик, который определяет безопасность (безвредность) штаммов, наличие у них функциональных свойств, обусловливающих пробиотический эффект, и совокупность технологических характеристик, влияющих на качество готового продукта. Однако не нужно забывать, что в процессе изготовления лекарственных препаратов, БАДов, продуктов функционального питания или в результате взаимодействия микроорганизмов в многокомпонентных консорциумах может происходить изменение биологических свойств пробиотических штаммов, что отражается на результатах пробиотикотерапии. В связи с этим, по нашему мнению, возникает необходимость оценки качества готовой формы пробиотика. Большинство препаратов и БАДов изготовлены на основе лиофилизированнных форм пробиотических штаммов. Поэтому важными технологическими характеристиками препарата или продукта считаются время восстановления из лиофилизированного состояния и время достижения заявленной производителем концентрации пробиотических бактерий. Ранее фармакопейные статьи предполагали оценку количественного содержания микроорганизмов в препарате, которое определяли с помощью микроскопического метода в камере Горяева. Однако использование такого подхода не учитывало, что из лиофилизированного состояния может восстановиться не каждая бактерия пробиотического консорциума. Поэтому сейчас Общая фармакопейная статья при определении специфической активности пробиотиков описывает микробиологические методы оценки количества жизнеспособных бактерий в 1 дозе препарата [36]. Однако не нормируется, насколько быстро и за какое время пробиотические культуры достигнут значимой концентрации и соответствует ли это физиологии ЖКТ. Наши наблюдения показали, что быстрее всего из лиофилизированного состояния восстанавливаются монокультуры пробиотических бактерий, тогда как многокомпонентным консорциумам требуется в 2 раза больше времени. При этом достижение заявленной производителем концентрации микроорганизмов из консорциумов происходит в 3 раза медленнее, чем у монокомпонентных пробиотиков.
Процесс взаимодействия пробиотических штаммов и макроорганизма начинается с адгезии. Собственные многолетние исследования пробиотических препаратов показали, что штаммы после лиофилизации имеют низкую или среднюю способность к адгезии. Индекс адгезии у пробиотических культур колеблется в пределах от 2,2 до 4,0, при этом нет зависимости данного показателя от количества пробиотических штаммов, образующих пробиотические консорциумы. С микробиологической точки зрения низкая или средняя способность пробиотических Bifidobacterium или Lactobacillus адгезироваться на слизистой оболочке кишечника будет способствовать созданию временного экзогенного микробиоценоза, но при нормализации функций собственной микрофлоры пробиотические штаммы за счет конкурентных взаимоотношений с индигенными будут естественным образом сменяться.
Важной характеристикой служит отсутствие у пробиотических штаммов фенотипического проявления факторов патогенности. Так, например, по Bergey’s Manual of Systematic Bacteriology, 80% бифидобактерий обладают генами, кодирующими уреазу, а некоторые штаммы лактобацилл содержат гены, кодирующие протеолитические ферменты [37]. Необходимость определения отсутствия фенотипического проявления активности данных ферментов диктуется еще и тем, что пробиотические препараты на основе живых культур бактерий назначаются лицам с иммунодефицитом. У них зарегистрированы случаи развития бактериемии вследствие транслокации пробиотических штаммов через слизистую оболочку кишечника [38, 39]. В связи с этим при оценке качества пробиотического препарата необходимо обращать внимание на отсутствие у штаммов фенотипического проявления факторов инвазии.
Кислотообразование – свойство бактерий, указывающее на биохимическую активность штаммов, а также являющееся фактором антагонизма. Кислотообразование служит видовым и штаммовым признаком. Наши исследования демонстрируют, что монокультуры пробиотических штаммов характеризуются более низкой кислотообразующей активностью. Много органических кислот продуцируют многокомпонентные консорциумы, что связано с суммацией производимых отдельными участниками консорциума кислот. Поскольку кислотообразование является фактором антагонизма, пробиотические консорциумы обладают более широким, чем монокультуры, спектром антагонизма. Это необходимо учитывать при избыточном росте и размножении определенных условно-патогенных бактерий, которые формируют разные типы микроэкологических нарушений. Однако одна и та же пробиотическая культура в составе разных бактериальных ансамблей, т.е. в разном окружении, обладает специфическим спектром антагонизма.
Прием пробиотического препарата всегда отождествляют с «пересадкой органа». При его назначении конкретному пациенту необходимо учитывать не только функциональные характеристики пробиотических штаммов, но и биосовместимость индигенной микрофлоры пациента и пробиотической культуры. Это обусловлено необходимостью нивелирования эффекта «пробиотик против хозяина» или «хозяин против пробиотика», что снижает эффективность пробиотикотерапии [40].
Таким образом, оценка функциональных, технологических характеристик пробиотических штаммов, а также индивидуализация выбора пробиотика на основе определения биосовместимости микрофлоры пациента и пробиотических монокультур или консорциумов позволят физиологично скорректировать микробиоценоз и нормализовать работу многих органов и систем.
В настоящее время пробиотики выпускаются в виде продуктов питания, биологически активных добавок, лекарственных средств. Количество бактерий в разных пробиотиках значительно варьируется в зависимости от рода, вида и штамма микроорганизмов, т.к. их влияние на организм человека не одинаково. Дозировки пробиотиков рассчитываются в колониеобразующих единицах (КОЕ) – количестве жизнеспособных микроорганизмов, способных образовывать колонии на агаровой среде. Для реализации лечебных эффектов количество микробных тел должно быть не ниже 107 в одном грамме или миллилитре. Из всех способов упаковки готовых капсул или таблеток с пробиотиками самый надежный – блистерный. Материал блистера защищает препарат от проникновения влаги и таким образом препятствует активации высушенных бактерий при хранении. Несколько слов о длительности приема пробиотиков: в большинстве клинических исследований она составляла один месяц. Важное значение для достижения эффекта также имеет регулярность приема. Доказано, что даже наиболее эффективные пробиотики сохраняются в кишечнике человека в течение не более 1–3 недель после завершения курса их применения. Для достижения стойкого положительного эффекта желательно принимать пробиотики на постоянной основе или в течение сроков, имевших место в результативных клинических исследованиях. В идеале применение пробиотиков должно стать хорошей повседневной привычкой [41].
Всеми положительными качествами и эффектами, описанными выше, обладает новый пробиотик, Лактобаланс®. В его состав в количестве 3×109 КОЕ входит консорциум бактерий: L. acidophilus KS-13, L. rhamnosus LCS742, L. gasseri LAC343, B. bifidum G9-1, B. longum MM2, B. longum BB536, B. infantis M-63, B. breve M16V, B. lactis Bi-07, а также другие ингредиенты: желатин, картофельный крахмал, кукурузный крахмал и диоксид кремния. Эта уникальная смесь из 9 пробиотиков содержит специально культивируемые штаммы человеческих бактерий, которые сохраняют жизнеспособность при комнатной температуре, обеспечивая достаточное количество клеток для колонизации в кишечнике.
Клинические исследования пробио-тика Лактобаланс®, проводившиеся японской компанией – производителем штаммов Wakunaga, показали, что при его применении у 96% пациентов происходит уменьшение дискомфорта, вздутия и тяжести в животе [42], у 95% – нормализация работы кишечника при запорах [43], у 94% – уменьшение симптомов метеоризма [44], у 89% – уменьшение выраженности симптомов кандидоза [44].
Мы провели микробиологическое исследование пробиотических штаммов Лактобаланс® согласно МУ 2.3.2.2789-10 «Методические указания по санитарно-эпидемиологической оценке безопасности и функционального потенциала пробиотических микроорганизмов, используемых для производства пищевых продуктов» [35].
Первоначально готовили взвесь из капсулы и проводили микроскопическое исследование мазков, окрашенных по методу Грама. Микроскопию осуществляли с помощью бинокулярного микроскопа под масляной иммерсией с объективом ×100. Установлено наличие грамположительных палочек нескольких морфотипов. В мазке отмечали присутствие тонких, длинных, слегка изогнутых палочек, расположенных короткими цепочками; коротких тонких прямых палочек, расположенных короткими цепочками; тонких нежных палочек, расположенных в виде китайских иероглифов» (род Lactobacillus). Представители рода Bifidobacterium отличались полиморфностью. В мазках наблюдали крупные бутылкообразные клетки с утолщениями на одном из концов, расположенные одиночно или короткими цепочками (один морфотип); также прямые коротки толстые палочки с закругленными концами, расположенные одиночно (второй морфотип); прямые или слегка изогнутые палочки палочки с зернистой цитоплазмой (третий морфотип); коккобактерии, расположенные цепочками (четвертый морфотип). Посторонней микрофлоры (энтеробактерии, стафилококки, включая золотистый, плесени и грибы) в препарате не обнаружено.
Из разведения 10–7 отмечали на Бифидум-среде рост 30 отдельных колоний в виде «спускающихся сталактитов», «летящих комет», а также придонный рост микроорганизмов. Таким образом, содержание микроорганизмов в 1 капсуле составило (30×107×10)=3×109 КОЕ. При этом установлено, что первые признаки роста консорциума пробиотических микроорганизмов при посеве на жидкие питательные среды появлялись через 6 часов, заявленной концентрации бактерии достигали через 24 часа.
Кислотообразование всего консорциума бактерий составила 214,5°Т (градусов Тернера), что расценивается как высокая кислотообразующая способность (более 101°Т).
Установлено отсутствие у представителей консорциума гемолитической, уреазной и протеолитической активности (тесты на мочевину и индол отрицательные).
Пробиотические бактерии препарата Лактобаланс® проявляли антагонизм к следующим условно-патогенным бактериям:
- Staphylococcus aureus (зона задержки роста [ЗЗР]=10 мм);
- Klebsiella pneumoniae (ЗЗР=15 мм);
- Escherichia coli Hly+ (ЗЗР=10 мм);
- Escherichia coli lac- (ЗЗР=15 мм);
- Candida albicans (ЗЗР=20 мм).
Определение чувствительности/устойчивости пробиотических штаммов к антибиотикам проводилось диско-диффузионным методом, бактерии были резистентными к имипенему, цефазолину, цефтазидиму, что позволяет назначать данный пробиотик во время приема соответствующих антибактериальных средств. Консорциум бактерий был чувствительным к амоксициллину, гентамицину, рокситромицину, офлоксацину, цефтриаксону, ципрофлоксацину и имел промежуточную устойчивость к амикацину и норфлоксацину.
Бифидо- и лактобактерии, входящие в состав мультипробиотика Лактобаланс®, способствуют:
- восстановлению и нормализации микрофлоры кишечника, в т.ч. при погрешностях в питании, при смене климата, потребляемой воды и диеты;
- нормализации работы кишечника;
- улучшению функционального состояния кишечника;
- снижению риска кишечных расстройств;
- поддержанию нормальной функции кишечника при смене климата;
- уменьшению образования вредных веществ в кишечнике, таких как аммиак, индол и сероводород;
- поддержанию нормальной микрофлоры влагалища;
- повышению защитной функции иммунной системы и общей резистентности организма.
Таким образом, мультипробиотик Лактобаланс® отвечает всем современным требованиям, предъявляемым к технологии производства и хранения, а также обладает разнонаправленными профилактическими и лечебными эффектами для взрослых и детей с 3 лет.



