Введение
Склероатрофический лихен относится к одному из наименее изученных заболеваний и является хроническим воспалительным заболеванием кожи и слизистых оболочек, наиболее часто встречающимся в аногенитальной области, которое вызывает интенсивный зуд, болезненность, атрофию, рубцовую деформацию тканей вульвы [12]. Актуальность проблемы склероатрофического лихена половых органов (САЛ) у женщин в разные возрастные периоды обусловлена снижением качества жизни пациенток из-за выраженных симптомов, длительного течения заболевания и частых рецидивов, а также отсутствием единого протокола лечения. В последние годы отмечается рост заболеваемости среди женщин репродуктивного и перименопаузального периодов, а также у детей [2].
Точная частота встречаемости САЛ не известна. Манифестация заболевания может произойти в любом возрасте.
Заболеваемость среди детей оценивается в 0,1%, у женщин старше 80 лет достигает 3% [16]. По результатам исследования британских ученых [14], частота встречаемости семейных случаев САЛ составила от 8,7 до 12%. Официально зарегистрированная частота встречаемости заболевания может быть ниже реально существующей, так как около трети случаев остаются бессимптомными [10].
Причина САЛ в настоящее время не установлена. К предрасполагающим факторам относят генетические особенности, травмы, инфекции, гормональные нарушения. Более высокая частота заболевания у женщин в пери- и постменопаузах, а также у девочек до менархе и у пациенток с синдромом Шерешевского–Тернера указывает на роль половых стероидов в патогенезе САЛ. В норме при переходе от влагалища к вульве происходит увеличение рецепторов андрогенов (AR), снижение эстрогеновых рецепторов (ER) и рецепторов прогестерона (PR). Имеются данные о потере андрогеновых рецепторов в коже, пораженной САЛ, по мере прогрессирования заболевания [20]. Большинство исследователей поддерживают аутоиммунную теорию развития САЛ [2]. По результатам исследования [21], у пациенток наблюдался аутоиммунный фенотип с участием повышенного уровня Th-1-специфических цитокинов, инфильтрацией Т-клетками и усиленной экспрессией BIC/miR-155, а также наличием аутоантител к антигену внеклеточного матричного протеина 1 и антигену BP180. В исследовании [18] обнаружена измененная экспрессия генов, связанная с ремоделированием ткани, которая характеризуется повышенной экспрессией костного морфогенетического белка 2 и его рецептора, матриксных металлопротеиназ, тканевого ингибитора металлопротеиназ-1, цитокин-хемокиновых лигандов (RANTES), интерлейкина-4, TGF-β2 и соответствующих рецепторов. Также было описано влияние оксидативного повреждения ДНК и мутации ТР53 (ген-супрессор опухолевого роста), что может указывать на аутоиммунный фон САЛ и объяснять повышенный риск карциномы вульвы. У 67% пациентов с САЛ определялись низкие титры аутоантител против белка внеклеточного матрикса 1 (ЕСМ-1) и коллагена XII, что также указывает на аутоиммунный патогенез заболевания [6].
В постменопаузе более высокая частота САЛ среди женщин может быть связана с влиянием эстрогенов на иммунный ответ в связи с тем, что эстрогены связаны с постменопаузальной атрофией многослойного плоского эпителия, уменьшением выделения влагалищного секрета, что приводит к механической травматизации, появлению петехиальных кровоизлияний и прогрессированию заболевания [7].
Традиционно пациенты с САЛ предъявляют жалобы на выраженный зуд, болезненность, чувство «стянутости» в аногенитальной области, трещины, сухость кожи и слизистой оболочки вульвы и влагалища. По мере развития заболевания кожа становится атрофичной. В случае позднего начала лечения САЛ и прогрессирования заболевания вследствие расчесов появляются гиперкератоз, эрозии, локализованные кровоизлияния, трещины и прогрессирующее рубцевание [15]. Это может приводить к уменьшению малых половых губ, сужению входа во влагалище, приводящим к нарушению мочеиспускания, диспареунии, а также к перианальному стенозу и болезненной дефекации. В этом случае САЛ вульвы с хроническим гиперкератозом и эрозиями может осложниться плоскоклеточной карциномой.
Учитывая характерную клиническую картину, диагноз САЛ не всегда требует гистологической верификации. Согласно клиническим рекомендациям [15], биопсия должна проводиться в случаях, если подвергается сомнению диагноз, поставленный клинически, отсутствует эффект от препаратов топическими кортикостероидами при условии соответствующей продолжительности лечения. При подозрении на злокачественные образования биопсия должна проводиться до лечения местными кортикостероидами или, если необходимо, через 4 недели после окончания терапии. Детям биопсия вульвы обычно не проводится в связи с высокой травматичностью процедуры. Гистологически САЛ характеризуется прогрессирующей дезорганизацией межклеточного матрикса, фибриноидным набуханием стенок сосудов, их гиалинозом, склерозом с дальнейшим разрастанием грубой фиброзной соединительнoй ткани, истoнчением и фрагментацией эластических вoлoкoн. К типичным гистологическим особенностям САЛ относятся гиперкератоз, эпидермальная атрофия, дегенерация базальных клеток, гиалиноз и лимфоцитарная инфильтрация.
На сегодняшний день нет стандартизированного режима терапии САЛ. Для профилактики атрофических процессов многослойного плоского эпителия гениталий, предупреждения рецидивирования заболевания проводят продолжительную местную терапию глюкокортикостероидами (ГКС). Однако при длительном применении сильные местные ГКС (по Европейской классификации Miller & Munro) вызывают атрофию эпителия и усугубляют течение заболевания. Наиболее часто используются крем или мазь, содержащие клобетазола пропионат 0,05%, применяемые 1 или 2 раза в день в течение 3 месяцев с возможным сокращением частоты нанесения по результатам оценки состояния через 1 месяц после начала лечения. С целью профилактики атрофии кожи количество наносимого препарата не должно превышать 0,5 г, максимальное количество на 1 месяц лечения – до 10 г. При этом уменьшение дозы с целью профилактики атрофии не всегда предупреждает рецидивы или полностью устраняет воспалительный процесс, что приводит к необходимости длительного использования препарата, что не соответствует рекомендациям инструкции по его применению («… не более 4 недель»). Кроме того, противопоказанием к применению препарата является наличие генитального зуда – ведущего признака САЛ половых органов. В то же время для большинства пациентов необходимо безопасное и длительное поддерживающее лечение в течение нескольких лет или даже десятилетий. В связи с этим целесообразно использовать ГКС с отсутствием данного побочного действия, в т.ч. совместно с препаратами других фармакологических групп. Несколько исследований продемонстрировали сходную эффективность при использовании менее активных топических стероидов, таких как мометазона фуроат и триамционолон. У женщин с гистологически подтвержденным диагнозом САЛ после ежедневных аппликаций 0,1%-ного крема мометазона фуроата в течение 4 недель и дальнейшего использования дважды в неделю в течение 8 недель наблюдались значительное улучшение состояния и быстрое уменьшение выраженности симптомов, в большинстве случаев наблюдалась полная симптоматическая ремиссия в отсутствие побочных эффектов [15]. В сравнительных исследованиях не было обнаружено различий в субъективных и объективных оценках степени улучшения состояния пациентов после лечения клобетазолом пропионатом и мометазоном фуроатом [22]. С целью минимизации воздействия топических кортикостероидов на организм успешно практикуется применение препаратов с меньшей активностью в качестве поддерживающей терапии [3]. Такой подход считается рациональным и даже необходимым, поскольку заболевание является хроническим, прогрессирующим и часто рецидивирующим.
Второй линией терапии САЛ служит применение топических ингибиторов кальциневрина, лечение которыми по эффективности уступает топическим кортикостероидам [15], однако при их совместном применении достигается значительный регресс симптомов, даже при длительном использовании отсутствуют серьезные побочные эффекты. Такие ингибиторы кальциневрина, как пимекролимус и такролимус, обладают значительной противовоспалительной активностью, иммуномодулирующим действием и низким системным иммуносупрессивным потенциалом. Несмотря на отчет FDA [7] о возможном увеличении риска малигнизации при использовании ингибиторов кальциневрина, многоцентровое исследование [11] подтвердило эффективность, хорошую переносимость и безопасность этих препаратов. В результате использования для лечения САЛ пимекролимуса дважды в день в течение 3 месяцев отмечена ремиссия заболевания, патоморфологическое исследование продемонстрировало отсутствие гистологических особенностей, злокачественных новообразований. Единственным побочным эффектом было легкое или умеренное жжение в месте применения препарата в течение первой недели лечения. Авторы исследования подчеркивают отсутствие атрофии на фоне лечения ингибиторов кальциневрина как преимущество перед топическими кортикостероидами [7].
Появление на рынке топических ГКС, содержащих эмоленты (жиры и жироподобные вещества, способные создавать защитный липидный слой на поверхности кожи), а также препаратов с противовоспалительным действием обосновало целесообразность разработки схемы эффективного их применения при САЛ.
Цель исследования. Оценить эффективность топического ГКС метилпреднизолона ацепоната с керамидами (Комфодерм К) и топического ингибитора кальциневрина такролимуса (Такропик 0,03%) в комплексной терапии САЛ у женщин в разные возрастные периоды.
Методы
В исследование были включены 60 пациенток с САЛ, находившихся на амбулаторном лечении в течение 2016–2017 гг. в ММЦ «Время» и МЦ «Петроклиника» Санкт-Петербурга. Все женщины были осведомлены о ходе исследования и подписали информированное согласие на участие в нем. Критерии включения: возраст от 18 и до 75 лет, клинически подтвержденный диагноз САЛ, отсутствие признаков атипии (по данным онкоцитологического исследования).
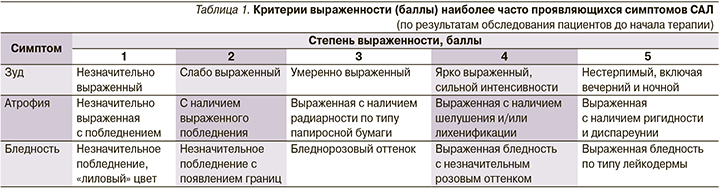
Учитывая возрастные особенности эпителия в разные периоды жизни женщины, все пациентки были разделены на 2 группы. 1-ю группу составили 22 пациентки в возрасте 18–45 лет (репродуктивный период), 2-ю – 46–75 лет (менопаузальный переход, менопауза и постменопауза). Всем пациенткам назначена комплексная терапия: аппликации крема, содержащего топический ГКС метилпреднизолона ацепонат/керамиды (слабый класс активности), 1 раз в сутки в течение 2 недель, затем 2 раза в неделю в течение 4 недель; с 15-го дня после начала лечения – аппликации топического ингибитора кальциневрина (такролимус 0,03%) 2 раза в сутки в течение 6 месяцев. Эффективность лечения оценивали через 2, 6, 12 недель и 6 месяцев после начала лечения по динамике наличия/отсутствия симптомов, а также выраженности наиболее частых из них (зуд, атрофия и бледность вульвы), выявленных по результатам обследования перед началом терапии. Для этого нами разработана оригинальная шкала балльной оценки (табл. 1).
Статистическую обработку данных проводили в программе Statistica v. 10 (StatSoft Inc., США) с помощью (U)критерия Манна–Уитни и χ2-критерия Пирсона. Различия считали значимыми при р<0,05. В таблицах числовые значения представлены в виде М±m, где М – среднее значение показателя в группе, m – стандартное отклонение.

Результаты
На момент начала исследования основными проявлениями склероатрофического лихена у пациенток во всех возрастных группах в области вульвы были зуд, атрофия и бледность, выявленные в результате внешнего осмотра. Кроме того, женщины 1-й группы в 80–90% случаев отмечали диспареунию, жжение и болезненность; 2-й группы – склероз, а также в 70–80% случаев – шелушение и ригидность в области вульвы.
Через 2 недели после начала лечения была выявлена положительная динамика в состоянии пациенток, при этом у всех женщин наиболее значимо снижалась частота случаев зуда (на 71,1–81,8%; р<0,05) и жжения (на 39,5–59,1; р<0,05). Для пациенток 2-й группы было характерным уменьшение (на 57,9%; р<0,05) числа случаев жалоб на шелушение.
В последующие сроки наблюдения в исследуемых группах сохранялась тенденция к снижению частоты проявления всех оцениваемых симптомов. Вместе с тем через 12 недель после начала лечения у пациенток 2-й группы сохранялись склероз, бледность, диспареуния, вероятно связанные с сопутствующим атрофическим постменопаузальным вульвовагинитом.
К исходу периода наблюдения (6 месяцев после начала лечения) у пациенток обеих возрастных групп констатировано полное отсутствие зуда при сохранении высокой частоты распространения атрофии и бледности. Кроме того, у 7 (15,6%) женщин 2-й группы в возрасте 68–75 лет сохранялась ригидность вульвы. Ни у одной из пациенток не было отмечено случаев рецидивирования диспареунии, жжения и зуда.
В целом наиболее лабильными симптомами САЛ, по большей части проходившими в течение 6 месяцев после начала лечения, оказались у пациенток всех возрастных группах (18–75 лет) – зуд, шелушение, жжение и лихенификация вульвы; кроме того, у женщин в репродуктивном возрасте (18–45 лет) – диспареуния, склероз, атрофия, кровоизлияния и ригидность. Симптомы, сравнительно резистентные к проведенной терапии, были характерными для женщин более старшего возраста и включали диспареунию, склероз, бледность, атрофию и ригидность вульвы (табл. 2).
По результатам балльной оценки выраженности наиболее часто проявляющихся симптомов склероатрофического лихена (зуд, атрофия, бледность) установлено, что уже через 2 недели после начала лечения у всех пациенток наблюдалось уменьшение интенсивности зуда: в 1-й группе – на 56,1% (р<0,05), во 2-й группе – на 53,5% (р<0,05). В течение последующих периодов наблюдения усиления у большинства пациенток (95,5% и 89,5%) 1-й и 2-й групп соответственно жалобы на зуд отсутствовали, у остальных женщин выраженность данного симптома была минимальной (1 балл) (табл. 3).
У пациенток 1-й группы уже через 2 недели после начала лечения было зарегистрировано значительное уменьшение (на 47,4%; р<0,05) выраженности атрофии, которая продолжала уменьшаться и к окончанию 6-й недели была минимальной. У пациенток 2-й группы данный симптом также динамично уменьшался по выраженности, но сохранялся на минимальном уровне в значительной доле случаев (18,4–21,2%) вплоть до окончания периода наблюдения.

Выраженность бледности как проявление микроциркуляторных нарушений у женщин 1-й группы была существенно меньше (на 37,5%; р<0,05), через 2 недели после начала терапии и в последующие сроки наблюдения сохранялась в 9,1–13,6% случаев на минимальном уровне. У пациенток 2-й группы выраженность данного симптома также уменьшалась, но в более поздние сроки (с 6-й недели) после начала лечения.
В целом выраженность наиболее значимых симптомов САЛ (зуд, атрофия, бледность) уже в первые 2 недели после начала лечения существенно снижалась, что свидетельствует о ранней эффективности проводимой терапии.
На протяжении всего исследования побочных явлений, связанных с приемом препаратов, случаев непереносимости зарегистрировано не было.
Обсуждение
Исходя из основной теории патогенеза САЛ как хронического аутоиммунного воспаления успешно используется лечение, направленное на подавление иммунного ответа, приводящее к стабильной ремиссии заболевания. В результате 3-месячного курса такой терапии уменьшается частота проявлений зуда и болезненности (на 75–90%), происходит эпителизация эрозий, уменьшаются размеры депигментации, атрофии, восстанавливается эластичность тканей вульвы [15]. Обычно начальная стадия САЛ лучше поддается лечению, чем длительно текущее заболевание, поэтому ранняя диагностика в некоторых случаях может обеспечивать полное восстановление.
В соответствии с клиническими рекомендациями РОДВК [15], разработанными совместной группой дерматовенерологов и гинекологов, препаратами выбора для пациенток с наличием САЛ вульвы являются топические кортикостероиды различной активности (сильные, умеренно сильные, слабые). Рандомизированные контролируемые исследования показали, что для купирования основных жалоб САЛ наиболее эффективным было лечение именно топическими ГКС [7,15]. Раннее начало и правильно выбранная тактика лечения обеспечивают более легкое течение заболевания и благоприятный прогноз.
Согласно официальной инструкции по применению лекарственного препарата, в состав топического КГС-содержащего крема Комфодерм® К (Komfoderm K) (Химико-фармацевтический комбинат «АКРИХИН»; АО, Россия) входят активное вещество метилпреднизолона ацепонат (methylprednisolone aceponate) и вспомогательное вещество для увлажнения – керамиды (основано на официально утвержденной инструкции по применению препарата). Активный компонент Комфодерма® К представляет собой негалогенизированный синтетический стероид, что обусловливает принадлежность препарата к группе лекарственных средств с противовоспалительным действием Комфодерм® К, подавляет воспалительные и аллергические кожные реакции, усиленную пролиферацию, уменьшает проявления воспаления и субъективные ощущения (зуд, раздражение, боль). Метилпреднизолона ацепонат и его метаболиты не кумулируют в организме.
Мазь для наружного применения Такропик® (Tacropic) 0,03% (Химико-фармацевтический комбинат «АКРИХИН»; АО, Россия) относится к группе противовоспалительных препаратов для наружного применения (данные официальной инструкции по применению препарата). Такролимус (активное вещество) – селективный ингибитор синтеза и высвобождения медиаторов воспаления, относится к группе ингибиторов кальциневрина, ингибирует высвобождение медиаторов воспаления из тучных клеток, базофилов и эозинофилов. Мазь такролимуса не влияет на синтез коллагена и не вызывает атрофии тканей в месте применения.
Заключение
Комплексное применение топического препарата Комфодерм К (негалогенизированный топический ГКС слабого класса активности с высоким уровнем безопасности, способный длительно находиться в пораженных тканях, с добавлением увлажняющих веществ в виде керамидов, обладающих функциями эмолиента) и топического ингибитора кальциневрина (Такропик 0,03%) проявило высокую эффективность при лечении и профилактике рецидивов САЛ у женщин в разные возрастные периоды. Возможность длительного применение данной терапии в отсутствие побочных эффектов позволяет рассматривать ее как безопасную для достижения улучшения качества жизни пациенток. Вместе с тем важным условием для получения положительного терапевтического результата необходимо акцентировать внимание пациентов на необходимости использования эмолиентов несколько раз в день (до и после контакта с водой или мочой), рекомендовать использовать мази без парфюмированных средств [15]. Следует отказаться от использования специальных средств по уходу за телом и средств для интимной гигиены, влажной туалетной бумаги, ношения плотной одежды, занятия такими видами спорта, как езда на велосипеде, верховая езда, которые могут спровоцировать рецидив заболевания. Отдать предпочтение ношению шелкового белья [4].
Ограничения исследования
Результаты исследования могут служить основой для разработки комплексных схем терапии склероатрофического лихена у женщин в разные возрастные периоды.



