Распространенность гастроэзофагеальной рефлюксной болезни (ГЭРБ), согласно результатам современных эпидемиологических исследований, растет во всем мире [1]. ГЭРБ приводит 10–15% пациентов к развитию пищевода Барретта (ПБ), при котором нормальный плоский эпителий дистального отдела пищевода замещается на метаплазированный, что в дальнейшем через стадии неопределенной дисплазии, дисплазии низкой и высокой степени злокачественности может приводить к развитию аденокарциномы пищевода, заболеваемость которой растет с конца прошлого века [2].
Единых международных подходов и рекомендаций по ведению пациентов с ПБ и различными стадиями неопластического прогресса на его фоне к настоящему времени не разработано. Как в отечественных (Российская гастроэнтерологическая ассоциация – РГА), так и в зарубежных рекомендациях (Американская гастроэнтерологическая ассоциация, Американская коллегия гастроэнтерологов, Британское общество гастроэнтерологов) подчеркивают, что подтверждение наличия ПБ без дисплазии эпителия или же с вариантом дисплазии следует проводить в медицинском учреждении, специализирующемся на проблеме ПБ [3–7]. Более того, наличие дисплазии должно быть подтверждено как минимум двумя патоморфологами, предпочтительно из разных учреждений, причем хотя бы один из них должен иметь специализацию по гастроэнтерологической патологии.
Согласно рекомендациям РГА [7], при обнаружении признаков дисплазии низкой степени (ДНС) необходимо повторное (в течение первых 6 месяцев) комплексное эндоскопическое исследование с прицельной или 4-квадрантной биопсией с промежутком по длине сегмента ПБ в 1 см и подтверждением независимым экспертом-патологом с последующим динамическим наблюдением и ежегодными эндоскопическими и морфологическими исследованиями (с интервалом 1–2 раза в год).
В случае подтверждения наличия у пациента с ПБ ДНС без жизнеугрожающей сопутствующей патологии Американская коллегия гастроэнтерологов (ACG) рекомендует (пункт 24, сильная рекомендация, умеренный уровень доказательности) эндоскопическую терапию как предпочтительный метод лечения, указывая при этом, что эндоскопическое наблюдение каждые 12 месяцев – приемлемая альтерна-тива [5].
В Руководстве по лечению ПБ, опубликованном Британским обществом гастроэнтерологов (BSG) в 2014 г., для пациентов с ДНС, гистологически доказанной в случайных биопсиях, рекомендовано эндоскопическое наблюдение с интервалами в 6 месяцев. При этом было указано, что ведение пациентов с ДНС не имеет четкого регламента ввиду ограниченных данных и, хотя наличие ДНС коррелирует с более высоким риском развития рака пищевода, терапия в виде радиочастотной абляции не может быть рекомендована всем до получения результатов рандомизированных клинических исследований (рекомендация класса C) [4]. Обобщенно рекомендации до 2017 г. представлены в таблице.

В течение последних двух лет опубликованы новые данные о динамике развития ДНС при ПБ, а также о безопасности и эффективности эндоскопического лечения этой подгруппы пациентов. В частности, Duits и соавт. [8] провели ретроспективный анализ данных 293 пациентов с ДНС, диагностированной в стационарах. При повторной оценке вторым морфологом первоначальный диагноз ДНС был подтвержден в 27% случаев, в то время как остальные случаи были «понижены» до ПБ без дисплазии или с неопределенной дисплазией. У пациентов с консенсусно подтвержденным диагнозом ДНС скорость прогрессирования до дисплазии высокой степени или рака составила 9,1% в год (медиана наблюдения – 39 месяцев). Напротив, у пациентов, чей диагноз был изменен на ПБ без дисплазии или дисплазия рассматривалась как неопределенная, коэффициент трансформации составил 0,6 и 0,9% в год соответственно (уровень доказательности низкий). Это исследование не только в очередной раз подтвердило наличие сложностей в патоморфологической диагностике ДНС, но и продемонстрировало, что в случае подтверждения данного диагноза вторым патоморфологом риск прогрессирования существенно более высок. Недавний мета-анализ показал, что когортные исследования с низким соотношением «ДНС/ПБ без дисплазии» (<0,15) указывающим на более строгую и надежную диагностику дисплазии, свидетельствуют о значительно более высокой годовой заболеваемости раком пищевода (0,76%; 95% доверительный интервал от 0,45 до 1,07%) по сравнению с теми исследованиями, в которых указанное соотношение превышало 0,15 и, вероятно, имела место гипердиагностика ДНС (0,32%; 95% ДИ от 0,07 до 0,58%; уровень доказательности низкий) [9].
Обсуждая место эндоскопического лечения при ПБ, следует проанализировать недавнее многоцентровое рандомизированное контролируемое исследование, сравнившее 68 пациентов с ПБ и ДНС, получивших лечение радиочастотной абляцией, с таким же числом пациентов, находившихся под ежегодным эндоскопическим наблюдением [10]. Основным критерием включения был диагноз ДНС, подтвержденный патологоанатомом с большим опытом работы с ПБ. Через 3 года наблюдения у 1% пациентов, получивших курс лечения, имело место прогрессирование к дисплазии высокой степени или раку пищевода по сравнению с 26,5% в контрольной группе (р<0,001; уровень доказательности высокий). Полное исчезновение дисплазии и кишечной метаплазии после радиочастотной абляции было достигнуто в 98 и 90% случаев соответственно. Наиболее распространенным осложнением радиочастотной абляции были стриктуры, которые наблюдались у 12% пациентов, но у всех из них они были успешно разрешены посредством эндоскопической дилатации.
В совокупности новые опубликованные данные говорят о том, что наличие дисплазии ДНС, установленной независимыми патоморфологами, коррелирует со значительным риском развития дисплазии высокой степени и рака пищевода и что радиочастотная абляция существенно снижает этот риск. Эндоскопическая абляция, предпочтительно радиочастотная, – приемлемый метод лечения ПБ с ДНС.
В связи с немалыми диагностическими сложностями ДНС должна быть подтверждена специалистом-патоморфологом в материале, полученном при проведении не менее чем двух эндоскопий. Варианты лечения должны обсуждаться мультидисциплинарной командой.
Основываясь на результатах, полученных в ходе последних исследований, весной 2017 г. Британским обществом гастроэнтерологов предложены новые рекомендации по ведению пациентов с ПБ и ДНС (см. рисунок) [6].
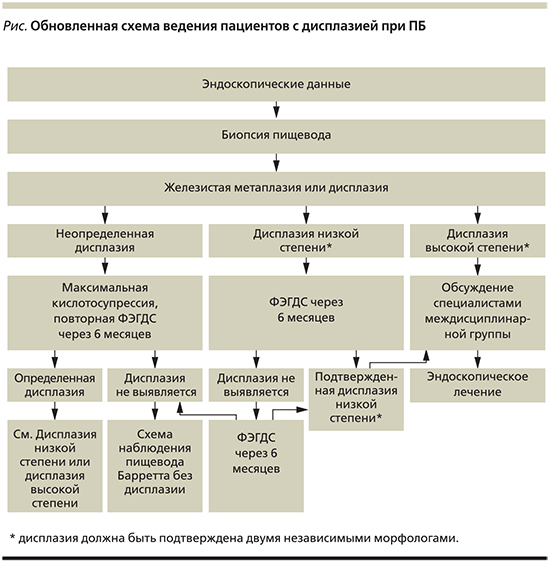
В этих рекомендациях эксперты указывают, что патоморфологическое выявление неопределенной дисплазии требует проведения кислотосупрессивной терапии в максимальной дозе и контроля ФЭГДС через 6 месяцев. Пациентам с диагностированной ДНС через 6 месяцев должна быть проведена повторная эндоскопия. Если ДНС подтверждена двумя независимыми патоморфологами (в идеале из разных учреждений), по крайней мере в двух наборах биопсий (полученных при любой последующей ФЭГДС), пациенту после консультации специалистов мультидисциплинарной команды должно быть предложено проведение эндоскопической абляции, предпочтительно радиочастотной. Если абляция не проводится, рекомендуется 6-месячное наблюдение (рекомендации: класс A для эндоскопической терапии, класс С – для наблюдения).



