Введение
В настоящее время нестероидные противовоспалительные препараты (НПВП) являются одной из самых назначаемых групп лекарственных средств (ЛС). Более того, по степени выраженности противоболевого эффекта, а также по использованию в популяционной профилактической стратегии снижения рисков развития сердечно-сосудистых осложнений НПВП – самый потребляемый в мире, в т.ч. в Российской Федерации, класс ЛС. Однако их высокая клиническая эффективность сопряжена с рядом побочных эффектов, что влечет необходимость сосредоточить внимание на аспектах безопасности терапии НПВП с целью повышения их рационального использования в условиях реальной клинической практики.
Высокая частота обращений пациентов с жалобами на боли в спине неспецифического характера на этапе первичной медико-санитарной помощи делает проблему безопасного обезболивания при использовании НПВП чрезвычайно актуальной [1]. Следует учитывать, что в данной ситуации мы имеем неоднородную популяцию пациентов, в которой при назначении НПВП нежелательные явления могут развиваться весьма различно. Ренальная безопасность требует тщательного изучения в аспекте каждого НПВП и в плане их сравнения с учетом коморбидной патологии, выраженности и длительности болевого синдрома.
Нефротоксичность остается предметом постоянного изучения и пристального внимания в отношении НПВП [2]. Ранее проведенные исследования в популяции молодых и относительно здоровых людей показали небольшой риск ренальных нарушений даже при длительном воздействии НПВП на функцию почек [3, 4], тогда как среди пациентов пожилого возраста риск снижения почечной функции значим в первую очередь из-за кумулятивного воздействия НПВП, связанного с фармакокинетическими аспектами негативного влияния при одновременном приеме двух и более ЛС [5]. Особенно следует обратить внимание на пациентов, принимающих диуретики, ингибиторы ангиотензинпревращающего фермента (ИАПФ) или блокаторы рецепторов ангиотензина II (БРА), у которых, по данным исследования F. Lapi и соавт. (2013), имел место крайне высокий риск развития острого почечного повреждения (ОПП) [6]. Среди основных нежелательных ренальных эффектов НПВП следует в первую очередь отметить ОПП, проявляющиеся развитием острого тубулярного некроза, интерстициального нефрита, нарушением электролитного баланса (гиперкалиемия и/или гипонатриемия), а также формированием артериальной гипертензии (АГ) и отечного синдрома. В публикациях результатов исследований [7, 8] показано, что применение НПВП может быть в высокой степени ассоциировано как с развитием ОПП, так и с последующим существенным ухудшением ренальных функций. В целом частота ренальных побочных эффектов НПВП составляет около 1–5% с одинаковым риском развития ОПП при использовании неселективных ингибиторов циклооксигеназы (ЦОГ), как и селективных ингибиторов ЦОГ-2 [9].
Решение вопроса о назначении НПВП пациенту с неспецифической болью в спине определяется в первую очередь профилем безопасности самого ЛС, а также «портретом» больного, характеризующимся возрастом, полом, наличием соматической патологии и выраженностью болевого синдрома.
Целью нашего исследования стало изучение показателей функции почек у пациентов с острой неспецифической болью в нижней части спины на фоне терапии нестероидными противовоспалительными препаратами («ПАНДА»).
Материал и методы
Общая характеристика обследованных больных
В исследование были включены 407 пациентов (189 мужчин и 218 женщин – 46,4 и 53,6% соответственно) с острой неспецифической болью в нижней части спины, из них работающих было 247 (60,9%). Развитие болевого синдрома было спровоцировано различными клинико-социальными факторами и обусловлено наличием дегенеративно-дистрофических изменений на уровне пояснично-крестцового отдела позвоночника, в т.ч. наличием фасеточного синдрома (76,2% случаев). Средний возраст больных составил 56,59±6,87 года.
Критерии включения в исследование «ПАНДА»: 1) возраст 45–70 лет (включительно); 2) первое в данном календарном году обращение пациента амбулаторно с жалобами на боль в нижней части спины; 3) уровень боли при движении по визуально-аналоговой шкале (ВАШ) ≥5; 4) «офисное» систолическое артериальное давление (САД) ≤140 мм рт.ст.; 5) отсутствие гипертонических кризов в течение предыдущих 4 недель, объективно подтвержденное данными автоматизированной информационной системы «Поликлиника».
Критерии исключения: 1) верифицированная (документально подтвержденная) хроническая болезнь почек в анамнезе; 2) перенесенные ранее инсульт и (или) транзиторная ишемическая атака; 3) эрозивно-язвенные изменения слизистой оболочки желудка или двенадцатиперстной кишки; 4) активное желудочно-кишечное кровотечение; 5) цереброваскулярное или иное кровотечение; 6) воспалительные заболевания кишечника (болезнь Крона, неспецифический язвенный колит) в фазе обострения; 7) гемофилия и другие нарушения свертываемости крови; 8) выраженная сердечная недостаточность (II–IV функцио-нальные классы по классификации NYHA; 9) выраженная печеночная недостаточность (>9 баллов по шкале Чайльда–Пью) или активное заболевание печени; 10) период после аортокоронарного шунтирования; 11) клинически выраженная ишемическая болезнь сердца; 12) наличие признаков специфического характера повреждения позвоночника, а также корешково-компрессионного синдрома.
Дизайн исследования
Многоцентровое проспективное исследование проведено на базе восьми городских поликлиник Самары в период с 12.04.2016 по 25.09.2016. Всего были скринированы 1015 человек, из них критериям включения соответствовали 407 больных, которым назначены НПВП. Все пациенты методом конвертов были рандомизированы в четыре группы. Больные I группы (n=103) получали мелоксикам (15 мг/сут), II (n=103) – эторикоксиб (60 мг/сут), III (n=103) – нимесулид (200 мг/сут) и IV группы (n=100) – целекоксиб (200 мг/сут). Длительность наблюдения составила 21 день, в этот период было осуществлено пять визитов (V), из которых V1–V4 – в период активной терапии НПВП, V5 – в период контроля. В соответствии с протоколом время визитов было определено следующим образом: V1 – исходно при обращении в лечебное учреждение (старт терапии НПВП), V2, V3, V4, V5 – через 3, 7, 14 и 21 день соответственно. Следует отметить, что пациентам не назначали анальгетики, миорелаксанты и антиконвульсанты. Данный шаг в исследовании был предпринят с целью исключения участия других ЛС помимо НПВП как в обез-боливании, так и, развитии побочных эффектов. Во время V1 до назначения НПВП проведено тщательное последовательное ознакомление пациентов с дизайном исследования, информирование их обо всех возможных побочных эффектах НПВП, затем пациенты подписали добровольное информированное согласие на использование и обработку персональных данных и на участие в исследовании. Также все пациенты были предупреждены о том, что в любой момент они могут выйти из исследования по любой причине. На первом (до назначения ЛС) и всех последующих визитах оценен уровень боли по ВАШ (в см) и определены показатели «офисного» АД. Измерение АД осуществлено аускультативным полуавтоматическим сфигмоманометром, прошедшим техническую поверку двукратно, с интервалом 1–2 минуты (рассчитано среднее значение АД). Кроме того, проведена оценка биохимических показателей крови на автоматическом биохимическом анализаторе «Sapphire-400» (производитель – «Hirose Electronic System», Япония), включая определение уровней глюкозы, креатинина, общего холестерина (ХС), липопротеидов низкой плотности (ЛПНП), триглицеридов (ТГ). Скорость клубочковой фильтрации (СКФ) рассчитана по формуле CKD-EPI [10]. Цистатин-С определен в сыворотке крови по иммунотурбидиметрическому тесту (калибратор стандартизован в соответствии с европейским референсным материалом «ERM-DA471/IFCC») с помощью диагностического набора «DiaSys» (Германия). Структурные изменения позвоночника оценены по данным рентгенографии или нейровизуализации при МРТ/КТ-томографии и сопоставлены с имеющейся клинической картиной. Особое внимание уделено описанию суставов между телами позвонков, т.к. дегенеративно-дистрофические изменения, распознаваемые на макроуровне, развиваются именно в суставном аппарате, формируя т.н. остеоартроз (остеоартрит) фасеточных суставов [11].
Статистический анализ полученных данных выполнен с помощью пакета «IBM SPSS Statistics 21» (лицензия № 20130626-3). Для сравнения независимых групп применен однофакторный дисперсионный анализ (one-way ANOVA), при отклонении от нулевой гипотезы о равенстве средних в группах проведены апостериорные тесты (сравнения групп попарно) по критерию Тьюки. Для сопоставления показателей в динамике использован дисперсионный анализ повторных измерений. Исследование взаимосвязей выполнено с помощью корреляционного анализа Пирсона. Описание нормально распределенных количественных признаков приведено с указанием среднего значения признака и среднего квадратичного отклонения (M±SD). Для анализа использована описательная статистика с применением параметрического критерия (t-критерий Стьюдента). Для описания признаков с распределением, отличным от нормального, указаны медиана, верхний (25-й) и нижний (75-й) квартили – Me [Q25; Q75]. Различия между изучаемыми параметрами признавали статистически значимыми при p<0,05.
Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования одобрен этическим комитетом Самарского государственного медицинского университета.
Результаты
Анализ полученных результатов проведен последовательно в три этапа.
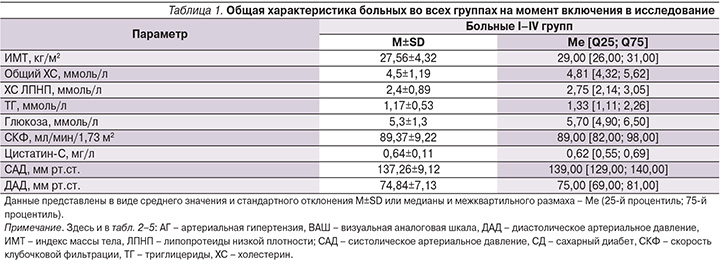
На первом этапе оценены показатели во всех группах (n=407) больных, общая характеристика которых на момент включения представлена в табл. 1. Следует отметить, что на начало наблюдения средние значения всех лабораторных показателей не превышали нормальные/референсные. Уровень боли, оцененный по ВАШ, составил 6,78±1,22 см, что свидетельствовало о выраженности болевого синдрома среди обследуемых пациентов. В соответствии с Европейскими рекомендациями по лечению АГ (2013) показатель офисного АД был отнесен нами к высокому нормальному [12]. Важно отметить, что число лиц, имевших в анамнезе зарегистрированную в медицинской документации АГ, составило 173 (42,5%) и на начало исследования на диспансерном учете с диагнозом сахарного диабета (СД) 2 типа состояли 62 (15,2%) пациента. Это свидетельствует о наличии у значительного числа больных патологии, несущей потенциальную угрозу развития ренальной дисфункции. Средняя длительность приема НПВП составила 13,36±1,02 дня. Обследование всех пациентов было закончено без нарушения протокола. Не было репартировано ни одного извещения в Росздравнадзор о развитии побочных нежелательных явлений при приеме НПВП.
Результаты, представленные в табл. 2, отражают динамику показателей уровней САД, ДАД, СКФ и цистатина-С в период лечения НПВП, а также в отдаленном периоде (на 21-й день наблюдения) для всех больных, включенных в исследование.
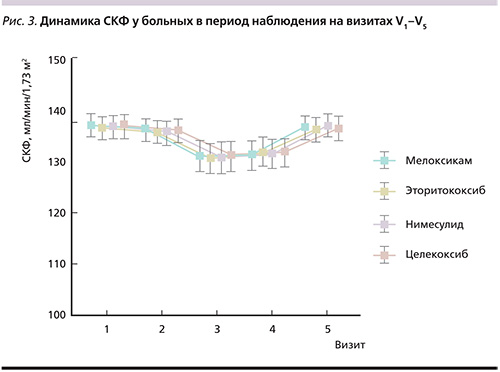
По показателю СКФ получены следующие данные: снижение на V2 со статистически значимым снижением между V1–V3. В дальнейшем отмечено повышение СКФ к V4 и V5. Статистически значимых различий по уровню СКФ на момент начала исследования и через 21 день не наблюдалось. Повышение показателя цистатина-С было статистически значимым через 3 дня терапии, более выраженным – к V3 с дальнейшим снижением на V4, по окончании исследования статистически значимых различий между данными на V1 и V5 не было. При этом следует отметить, что в целом по группе средние показатели СКФ и цистатина-С не превышали нормальных значений. То есть, несмотря на выявленные изменения, нами не было установлено каких-либо клинически значимых негативных тенденций, отражающих ухудшение ренальной функции при проведении статистической обработки полученных данных во всех группах больных с острой болью в спине, принимавших НПВП.
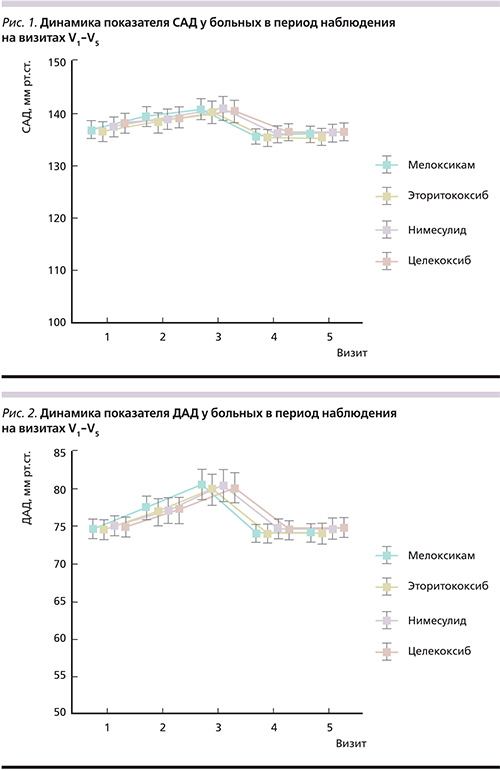
В отношении АД отмечена следующая динамика: статистически значимое повышение САД и ДАД на 3-и и 7-е сутки с последующим снижением и нормализацией показателей на V4 и V5. Статистически достоверной разницы по уровням САД и ДАД на начало исследования по сравнению с 14-м и 21-м днями наблюдения не получено.
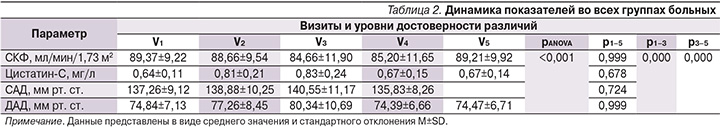
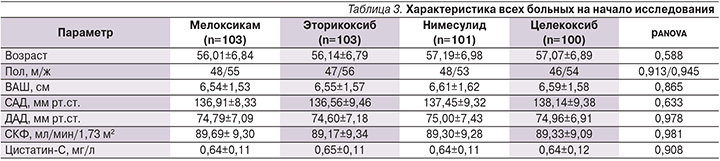
На втором этапе нами проведен анализ исследуемых параметров во всех группах больных. Исходная задача по формированию групп в рамках протокола выполнена в полном объеме. Обследуемые пациенты всех групп были сопоставимыми по основным половозрастным характеристикам, а также по показателю уровня боли, оцененного по ВАШ. Подробно изученные параметры во всех группах пациентов на начало исследования представлены в табл. 3. Для сравнения исследуемых групп на начало исследования применен однофакторный дисперсионный анализ, направленный на поиск зависимостей в полученных данных путем исследования значимости различий средних значений. Проверяемая гипотеза состояла в том, что различий между группами на начало исследования нет. По результатам дисперсионного анализа группы были сравнимыми с высокой степенью статистической значимости по показателям САД (p=0,633), ДАД (p=0,978), уровням СКФ (p=0,981), цистатина-С (p=0,908), а также по уровню боли по ВАШ (p=0,865). Нами проведен анализ парных тестов, представленный в табл. 4, который продемонстрировал, что статистически значимой разницы при сравнении показателей на всех пяти визитах в группах больных, рандомизированных в зависимости от принимаемого НПВП, не получено. Изменения показателей СКФ, цистатина-С, САД, ДАД с одинаковой силой достоверности отмечены при приеме пациентами мелоксикама, эторикоксиба, нимесулида и целекоксиба.
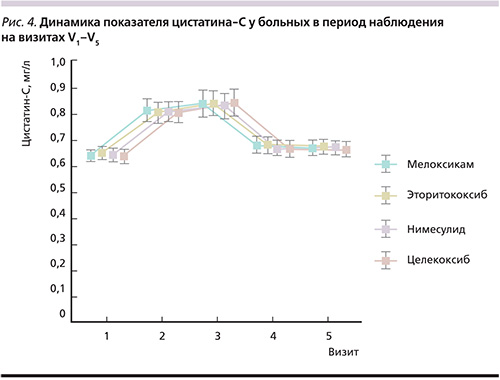
По СКФ во всех группах отмечено статистически значимое (р<0,001) снижение данного параметра между V1–V3 с дальнейшим повышением и статистически значимыми различиями (р<0,001) между V3–V5. На момент окончания исследования по показателю СКФ нами не было отмечено статистически достоверной разницы по сравнению с периодом включения больных в группы с приемом эторикоксиба (p=0,546) и нимесулида (p=0,520). В группе пациентов, принимавших мелоксикам и целекоксиб, снижение СКФ между V1 и V5 имело низкую статистическую значимость: p=0,344 и 0,475 соответственно. Уровень цистатина-С во всех группах больных статистически значимо повысился на 3-й и 7-й день наблюдения, оставаясь в каждой группе в пределах референсных значений.
К концу наблюдения в каждой группе показатель цистатина-С не превышал нормальных значений, при анализе не получено статистически значимой разницы между V1 и V5 во всех группах больных. По динамике уровней САД и ДАД нами было отмечено повышение на 3-й и 7-й день наблюдения со снижением на 14-й и 21-й дни, т.е. на конец наблюдения статистически значимой разницы между V1 и V5 не было. Подробно данные по всем показателям представлены в табл. 4, а также проиллюстрированы на рис. 1–4.
Исходя из общей характеристики всей группы больных, на третьем этапе нами был проведен анализ всех изучаемых показателей в зависимости от сопутствующей патологии, подробно представленный в табл. 5. Выделено три группы: 1-я группа (n=62) – пациенты, в анамнезе у которых имелись АГ и СД, 2-я (n=173) – пациенты с АГ и 3-я группа (n=172) – пациенты без АГ и СД. Наиболее молодыми оказались пациенты 3-й группы, их средний возраст составил 50,43±3,27 года, средний возраст больных 2-й группы равнялся 59,62±4,39 и 1-й – 64,97±5,12 года. В табл. 5 представлена динамика показателей САД, ДАД, СКФ, цистатина-С. Следует отметить, что на начало исследования пациенты 1-й и 2-й групп были сравнимыми между собой по уровню САД и ДАД и имели высокую статистическую значимость отличий от больных 3-й группы, что клинически объяснимо отсутствием в анамнезе у данных лиц АГ и СД.
У больных 1-й и 2-й групп отмечено увеличение САД на V2 и V3 со снижением на V4 и V5. У пациентов 3-й группы не отмечено статистически значимых изменений параметра САД между визитами: ΔСАД1–3 – 0,45±2,77 мм рт.ст. (p=0,073); ΔСАД3–5 – 0,71±2,81 (p=0,065); ΔСАД1–5 – 0,26±0,96 мм рт.ст. (p=0,099). По показателю ДАД у пациентов 3-й группы нами не отмечено статистически значимых изменений данного параметра между визитами: ΔДАД1–3 – 0,11±1,56 мм рт.ст. (p=0,678); ΔДАД3–5 – 0,40±2,68 мм рт.ст. (p=0,059); ΔДАД1–5 – 0,29±2,20 мм рт.ст. (p=0,083). В группе больных СД и АГ в динамике во время лечения НПВП отмечены статистически значимое повышение ДАД на 7-й день лечения, где ΔДАД1–3 равнялась 9,48±6,34 мм рт.ст. (p<0,001), и последующая нормализация данного показателя к концу периода наблюдения: ΔДАД1–5 – 0,95±3,68 мм рт.ст. (p=0,074). У пациентов с АГ к V3 зафиксированы повышение АД (ΔДАД1–3 – 9,84±5,67 мм рт.ст.; p<0,001) и нормализация на 14-й и 21-й день наблюдения (ΔДАД1–5 – 0,22±2,31; p=0,216). По показателям СКФ на начало исследования у пациентов 1-й и 2-й групп отмечены более низкие значения по сравнению с пациентами 3-й группы, данная тенденция имеется также и в динамике при сравнении в группах на визитах. По показателю цистатина-С на начало исследования у пациентов 1-й и 2-й групп отмечены более высокие значения по сравнению с таковыми 3-й группы, данная тенденция сохранилась также и в динамике при сравнении в группах на визитах. Следует отметить, что у пациентов 3-й группы на протяжении всего периода наблюдения не было статистически значимых изменений уровня цистатина-С.
Обсуждение
Проведенное нами исследование посвящено оценке функционального состояния почек на фоне применения НПВП пациентами с острой болью в нижней части спины. Предпосылкой к выполнению работы послужило отсутствие единого мнения о безопасности НПВП в краткосрочном режиме терапии для данной категории пациентов и взаимосвязи развития нежелательных побочных реакций с изменением ренальной функции. В связи с объемом употребляемых НПВП необходима разработка мер для уменьшения риска побочных явлений как в целом в популяции больных, так и с учетом отдельных нозологий и коморбидных состояний. Острая боль в спине – крайне актуальная проблема для врачей различных специальностей на этапе первичной медико-санитарной помощи. Не вызывает сомнений суждение о необходимости верификации диагноза у пациента с острой болью в спине с исключением жизнеугрожающих состояний, онкологических заболеваний и острой соматической патологии. В клинической практике необходим алгоритм диагностики именно с учетом возможных заболеваний и состояний, требующих оказания специализированной помощи. Но боль в спине в большинстве случаев обращений пациентов в лечебно-профилактические учреждения носит прогностически благоприятный характер и обусловлена дегенеративно-дистрофическими заболеваниями позвоночника, основным компонентом терапии которых являются НПВП.
Следует также иметь в виду, что ряд факторов, таких как пожилой возраст, женский пол (особенно при снижении мышечной массы), предрасполагают к препарат-индуцированной нефротоксичности. Это необходимо учитывать при титрации НПВП, выборе дозы и методах контроля за возможными ренальными осложнениями. При этом важно отметить, что ориентироваться на такой распространенный показатель, как СКФ, не всегда представляется возможным. Например, низкая масса тела может сопровождаться снижением уровня сывороточного креатинина и при определении СКФ возникает ситуация «ложновысокой» СКФ, что приводит к игнорированию развития возможных ренальных осложнений. В подобном случае пациент автоматически выбывает из группы риска и не будет находиться в фокусе внимания врача. Поэтому цистатин-С служит более надежным маркером возможной ранней почечной дисфункции.
Повышение уровня АД характерно для всех НПВП, о чем есть данные в инструкциях к этим ЛС. Мы учли тот факт, что эффект НПВП, доказанный в ряде исследований, проведенных более 30 лет назад, связан с опосредованным ингибированием простагландинов, что может приводить к гиперкалиемии, гипонатриемии, развитию метаболического ацидоза с повышением абсорбции воды в дистальных канальцах, повышению АД, а также развитию отечного синдрома [13–15]. И если в целом по всей выборке больных нами не было отмечено клинически значимого повышения АД, то у пациентов с АГ и СД в анамнезе повышение САД и ДАД было статистически более значимым, чем у пациентов без АГ. Следует отметить, что все больные АГ до момента включения в исследование получали антигипертензивные препараты: диуретики, ИАПФ или БРА. То есть на фоне приема НПВП (как селективных, так и коксибов) имело место «ускользание» эффекта гипотензивной терапии.
В опубликованной в 2004 г. работе G.K. Sandhu и соавт. показано, что селективные ингибиторы ЦОГ-2 имеют схожие побочные эффекты с неселективными НПВП [16]. Авторы провели анализ исследований, представленных в базе «Medlaine» (в период с 1996 по февраль 2004 г.), и пришли к достаточно противоречивым суждениям, т.к. в трех клинических исследованиях ингибиторы ЦОГ-2 имели схожие с неселективными НПВП побочные эффекты в отношении функции почек, в то время как в двух исследованиях эти ЛС оказались менее нефротоксичными, чем неселективные препараты. Исходя из анализа результатов указанных исследований, был сделан следующий вывод: ингибиторы ЦОГ-2 не имеют явных преимуществ по сравнению с неселективными НПВП в отношении функции почек. С учетом механизма действия селективных ингибиторов ЦОГ-2, связанного с опосредованным высвобождением ренина, нарушением микроциркуляции почечного кровотока и повышением АД, их следует с осторожностью назначать пожилым больным АГ, принимающим антигипертензивные препараты [17], т.к. у этой категории пациентов они могут способствовать формированию отеков и дополнительному повышению АД [18, 19]. У нормотензивных пациентов селективные ингибиторы ЦОГ-2 и неселективные НПВП не оказывают существенного влияния на АД и функцию почек [20]. В компрометированных группах больных, особенно у лиц пожилого возраста с признаками нарушения функции почек, прием обеих категорий НПВП может приводить к снижению СКФ [21].
Избежать назначения НПВП пациентам с острой неспецифической болью в спине вряд ли представляется возможным. Но у больных АГ, принимающих диуретики, ИАПФ и БРА, это связано с повышенным риском острой нефротоксичности, особенно в начале терапии, что требует тщательного лабораторного контроля функции почек. Также необходимы коррекция гипотензивной терапии и персонификация лечения АГ [22, 23].
Заключение
Проведенное исследование показало, что больные острой неспецифической болью в спине, не имеющие исходно признаков нарушения функционального состояния почек по таким критериям, как СКФ и уровень цистатина-С, хорошо переносили применение НПВП (мелоксикам, нимесулид, эторикоксиб, целекоксиб). У них имело место лишь кратковременное ухудшение на 3-й и 7-й день терапии, а на 21-й день наблюдения была констатирована нормализация показателей СКФ и цистатина-С. Вместе с тем профиль АД также изменялся на промежуточных этапах (3-й и 7-й день лечения), нормализуясь к 21-му дню терапии.
Существенные, статистически значимые различия по всем изученным показателям были нами отмечены между группой больных, имевших в анамнезе АГ и СД, и пациентами без этих заболеваний.
Настоящее исследование стало пилотным в изучении проблемы безо-пасного применения НПВП пациентами с острой неспецифической болью в спине, и в ходе его проведения установлены закономерности изменения параметров САД, ДАД, СКФ и цистатина-С, в т.ч. зависящие от наличия у больных СД и/или АГ, что диктует необходимость дальнейшего глубокого изучения эффектов НПВП для этого категории пациентов.
Декларация о финансовых и других взаимоотношениях
Все авторы принимали участие в разработке концепции статьи и в написании рукописи. Исследование не имело спонсорской поддержки.
Исследование не преследовало цель оценить клиническое превосходство какого-либо конкретного ЛС. В случае возникновения спорных вопросов авторы готовы предоставить протокол исследования и первичную документацию в полном объеме. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать.



