Введение
В последние годы для переходноклеточного рака мочевого пузыря (РМП) характерны высокие темпы прироста заболеваемости. Большинство исследователей отмечали значимые различия выживаемости больных и частоты рецидивирования в группах пациентов с одинаковой глубиной инвазии и степенью дифференцировки. Это затрудняет прогнозирование клинического течения болезни и выбор соответствующей тактики лечения [1, 2]. Проведена масса исследований, направленных на выявление дополнительных факторов риска прогрессирования и рецидивирования РМП, однако мнения специалистов были неоднозначными и универсального прогностического критерия обнаружить не удалось. В настоящее время обсуждается вопрос об этиологической роли инфекционных агентов, в частности вирусов, в генезе развития опухолей мочевого пузыря, их влиянии на частоту рецидивирования и развития инвазивных и метастатических его форм.
Цитомегаловирус человека (ЦМВЧ – HCMV – Human cytomegalovirus, вирус 5-го типа) впервые обнаружил немецкий патолог H. Ribbert (1882) в тканях почек умерших детей с врожденным сифилисом, а в 1904 г. он же выделил цитомегалические клетки из ткани слюнных желез ребенка (H. Ribbert, 1904). В 1921 г. исследователями E. Goodpasture и F. Talbot предложено называть эти клетки цитомегалами, а заболевание, при котором они обнаруживаются – цитомегалией.
В 1926 г. R. Cole и A. Kuttner впервые высказали предположение о принадлежности цитомегалических клеток к семейству вирусов. Вирусные частицы ЦМВ-инфекции человека при электронном микроскопии впервые увидел W. Minder в 1953 г., а возбудителя выделил M. Smith в 1956 г. При размножении в инфицированной клетке ЦМВ оказывает выраженное цитопатическое действие на нее, в результате обычные клетки превращаются в гигантские цитомегалические, достигая 25–40 мкм в диаметре за счет увеличения ядра и цитоплазмы. ЦМВ обладает тропизмом к клеткам слюнных желез, почек. Вирус обнаруживается в моче, слюне, желудочном соке, в различных пораженных органах, ликворе, грудном молоке, сперме, выделениях цервикального канала, лейкоцитах периферической крови [3]. На фоне ЦМВ может развиваться инфицирование другими видами вирусов или бактериями, т.е. суперинфекция. Доказано, что ЦМВ инфицирует В-клетки, латентно инфицированные вирусом Эпштейна–Барр (ВЭБ), более эффективно, чем ВЭБ-негативные [4]. M. Michaeles и соавт. считают, что ЦМВ может инфицировать опухолевые клетки (не являясь онкогенным вирусом) и модулировать свойства опухоли в сторону появления инвазивных свойств и способности ее к метастазированию, тем самым оказывая онкомодулирующий эффект. Для оказания такого эффекта необходима длительная персистенция вируса в организме. При этом ЦМВ не способен инициировать подобные изменения в неопухолевых клетках. ДНК самого вируса не определяется в опухолевых клетках, т.к. вирус действует по принципу «hit-and-run» [5].
Материал и методы
Проведено обследование и лечение 100 больных (72 мужчины и 28 женщин) в возрасте от 38 до 90 лет (средний возраст – 65±10 лет), поступивших в стационар с направительным диагнозом РМП. Дополнительно к общепринятым методам обследования при РМП взяты анализы крови на иммуноглобулины (Ig) IgG,M к герпесу (ВПГ – вирус простого герпеса) 1-го и 2-го типов, ЦМВ, ВЭБ. Ткань опухоли и моча взяты на ПЦР (полимеразная цепная реакция)-диагностику наличия вирусов ВПГ 1-го и 2-го типов, вирус папилломы человека (ВПЧ) высокого онкогенного риска, ЦМВ, ВЭБ. Была произведена оценка воспалительной инфильтрации в опухолевой ткани и подлежащей строме у 50 из 100 больных. Полуколичественно от 0 до 3 баллов (отсутствие, слабая, умеренная и выраженная степень) оценивались следующие признаки:
1. Лимфоцитарно-плазмоцитарный инфильтрат:
а) в опухоли;
б) рассеянный в подлежащей строме;
в) периваскулярная инфильтрация;
г) очаговая гиперплазия лимфоидной ткани в виде лимфоидных фолликулов.
2. Активность воспаления:
а) степень лейкоцитарного инфильтрата;
б) степень эозинофильной инфильтрации.
3. Цитопатические изменения:
а) внутриклеточные включения (койлоцитоз);
б) внутриядерные включения.
Результаты исследования
Наличие вирусных ДНК в ткани опухоли было выявлено у 34 больных, 50% опухолей являлись низкодифференцированными. Наличие ДНК ВЭБ в опухоли выявлено у 27 больных, у 6 – ЦМВ, в 5 случаях – ВПЧ высокого онкогенного риска (16, 39, 45, 52, 59), в 1 случае – ВПГ 1-го, 2-го типов. Из 34 больных у четверых пациентов выявлена ДНК нескольких вирусов (ВПЧ 59 тип+ВЭБ в одном случае, ВЭБ+ЦМВ у двоих пациентов, ЦМВ+ВЭБ+ВПЧ 31-го, 52-го типов у одного больного).
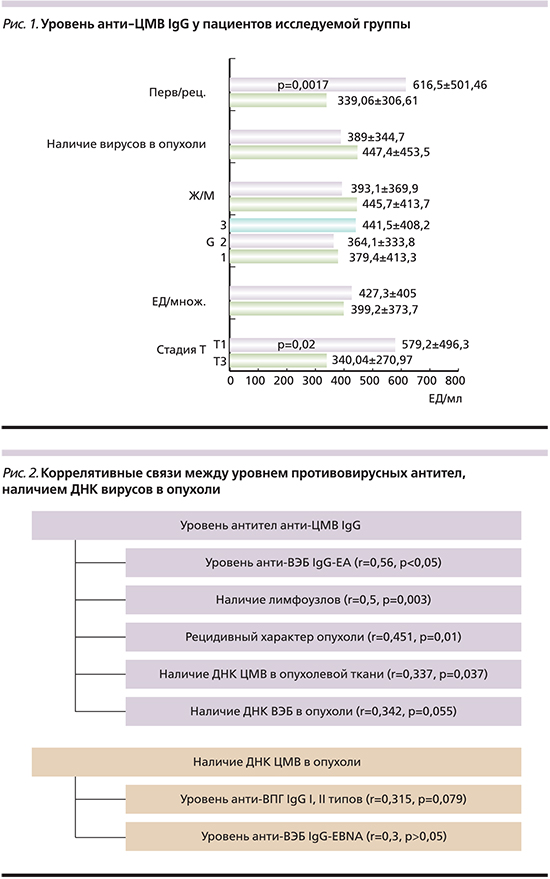
Что касается общего уровня противовирусных антител к ЦМВ, то он достаточно высокий и в среднем сос-тавил 408,4±285,7 ЕД/мл (отрицат. – до 6 ЕД/мл). Эти значения повышаются в зависимости от стадии процесса: при T1 – 340,04±270,97 ЕД/мл, при Т2 – 385±435,1, при Т3 – 579,2±496,3, при Т4 – 534,1±485,3 ЕД/мл. Несколько повышаются показатели в зависимости и от полифокальности процесса. У пациентов с единичной опухолью уровень антител составил 399,2±373,7 ЕД/мл, тогда как при множественном поражении значения увеличились до 427,3±405 ЕД/мл. Аналогичная тенденция наблюдается и при анализе показателей антител в зависимости от степени анаплазии. При высоко- и умереннодифференцированных опухолях уровень антител составил 379,4±413,3 и 364,1±333,8 ЕД/мл соответственно, тогда как при высокой степени анаплазии – 441,5±408,2 ЕД/мл. У женщин, страдающих РМП, значения антител выше, чем у мужчин (445,7±413,7 ЕД/мл против 393,1±369,9 ЕД/мл соответственно). При обнаружении одного или нескольких вирусов в опухоли мочевого пузыря показатели также несколько выше (447,4±453,5 против 389±344,7 ЕД/мл). Повышения уровня белков острой фазы выявлено не было, в одном случае проба была сомнительной. Таким образом, на наш взгляд, значительное повышение уровня антител у больных РМП следует рассматривать как показатель персистирующей ЦМВ-инфекции. Сводные данные представлены на рис. 1.
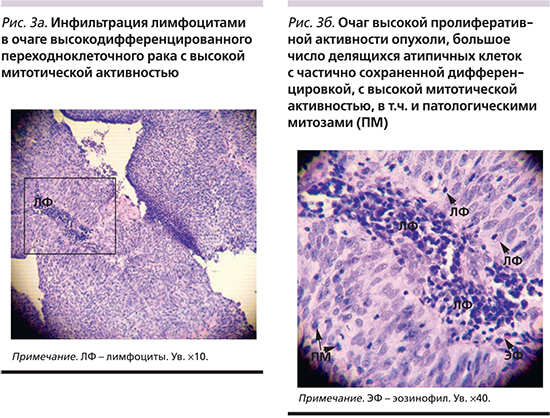
У пациентов с рецидивным характером опухоли имело место повышение уровня anti-ЦМВ IgG (616,5±501,46 против 339,06±306,61; p=0,.0017) и анти-ВЭБ IgG-EBNA (254,99±222,23 против 143,54±169,89; p=0,0118); с опухолью высокой степени злокачественности – повышение уровня анти-ВЭБ IgEA (23,28±33,61 против 7,88±12,28; p=0,08), при местнораспространенном процессе – анти-ЦМВ IgG (579,2±496,2 против 340,04±270,97; p=0,02). Выявлены высокие коррелятивные связи между уровнем анти-ЦМВ IgG и наличием ДНК ЦМВ в опухоли (r=0,337; p=0,037), уровнем ранних антигенов к ВЭБ (r=0,56; p<0,05), наличием позитивных лимфоузлов (r=0,5; p=0,003), с рецидивным характером опухоли (r=0,451; p=0,01) и наличием ДНК ВЭБ в опухоли (r=0,34; p=0,055). Наличие ДНК ЦМВ в опухоли коррелировало с уровнем анти-ВПГ IgG (r=0,315; p=0,079), анти-ВЭБ IgG-EBNA (r=0,3; p>0,05). Данные представлены в рис. 2.
Если проанализировать уровень анти-ЦМВ IgG в зависимости от стадии процесса при одинаковой степени дифференцировки опухоли мочевого пузыря, то у пациентов, у которых не выявлено вируса в опухоли, при умеренной дифференцировке опухоли средние значения анти-ЦМВ IgG у пациентов со стадией Т1 составляли 363,4±357,8 и 971,4±108,4 ЕД/мл у пациентов со стадией процесса Т3-4 (p=0,05). Такая же ситуация наблюдается в группе пациентов, у которых выявлен вирус в опухоли. При низкой степени анаплазии опухоли средние значения антител у пациентов в стадии Т1-398,1±436,2 ЕД/мл, а в стадии Т3-4 – 1011,75±125 ЕД/мл. Следует отметить, что не все данные статистически достоверны из-за небольшого числа пациентов, однако тенденция к росту антител в зависимости от стадии процесса прослеживается.
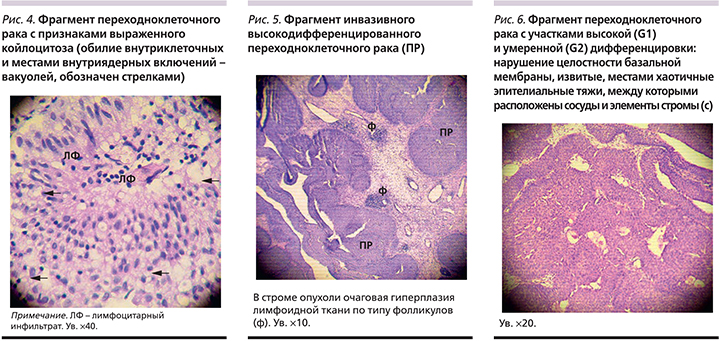
В нашем исследовании у 6 больных (5 мужчин и 1 женщина) выявлено наличие ЦМВ в опухоли. Следует отметить, что ЦМВ в опухолях обнаруживается крайне редко, т.к. действует по механизму «hit-and-run». Только у двух больных стадия процесса соответствовала Т1NoM0G2. Показательным является случай заболевания мышечно-неинвазивным РМП умеренной степени анаплазии (T1NoM0G2) у мужчины 50 лет. Имела место единичная опухоль, первичная, выявлены сопутствующие ВПЧ и ВЭБ в опухоли, титр антител анти-ЦМВ IgG составлял 1148 ЕД/мл. При исследовании морфологического материала были выявлены выраженный койлоцитоз (3 балла), внутриядерные включения (3 балла), деструктивно-некротические изменения в опухоли (3 балла), очаговая гиперплазия лимфоидной ткани, в т.ч. фолликулов (3 балла), периваскулярная инфильтрация (3 балла), лимфоцитарный инфильтрат в опухоли (3 балла), в подлежащей строме (3 балла), наличие лейкоцитов (3 балла) (рис. 3–6).
Мы видим, что как морфологически, так и лабораторно имеются признаки присутствия вирусной инфекции (лимфоидная инфильтрация в опухоли характерна для ВЭБ, периваскулярная – для ЦМВ, койлоцитоз – для ВПЧ). По всей видимости, у этого пациента имела место персистирующая герпес-вирусная инфекция (ВЭБ и ЦМВ) с развитием иммуносупрессии, как общей, так и местной, а в качестве онкогенов можно рассматривать ВЭБ и ВПЧ.
В остальных случаях имел место инвазивный процесс с низкой дифференцировкой опухоли, в трех случаях имело место лимфогенное метастазирование, возраст пациентов варьировался от 64 до 66 лет. Первичная опухоль выявлена у трех пациентов, множественный характер опухоли – в двух случаях. Наличие ЦМВ в моче выявлено у двух больных с множественным поражением мочевого пузыря. Титр антител варьировался от 166 ЕД/мл (поверхностный рецидив) до 1807 ЕД/мл. Следует отметить высокие титры анти-ВЭБ IgG – EBNA, VCA (более 750 и 600 ЕД/мл) у этих больных, в двух случаях обнаружен ВЭБ в опухоли и ВПЧ – в одном. Таким образом, у каждого из этих больных были выявлены определенные факторы рецидивирования и прогрессирования основного заболевания. По всей видимости, ассоциация вирусов ЦМВ и ВЭБ приводит к повышению стадии процесса и степени анаплазии.
Более выраженная степень лимфоидной инфильтрации как в подлежащей строме, так и непосредственно в опухоли имела место у пациентов с наличием ДНК вирусов в опухоли (2 балла – 20,7 против 45,2%; р=0,025, 3 балла – 44,8 против14,3%; p= 0,005; 3 балла в опухоли – 34,5 противs 4,8%; р=0,002). Такое усиление иммунологической активности (рис. 3а, 3б) в сочетании с высокими показателями вирусных антител может свидетельствовать о хронической вирусной инфекции, локализации ее в стенке мочевого пузыря с возможной индукцией опухолевого процесса и изменения степени анаплазии в сторону более низкодифференцированных форм.
Койлоцитоз (рис. 4) умеренной степени как показатель цитопатических изменений клеток был более выражен у вирус-негативных пациентов (2 балла – 10,3 против 28,6%; р=0,046), тогда как выраженный койлоцитоз, наоборот, был более характерен для пациентов с выявленной вирусной ДНК в опухоли (27,6 против 9,5%; p=0,06). По всей видимости, у данной категории больных имеет мест суперинфекция, т.е. сочетание ВПЧ и других вирусов, что и приводит к более выраженным цитопатическим изменениям. В частности, известно, что на фоне ЦМВ-инфекции может развиваться инфицирование другими видами вирусов или бактериями. Доказано, что ЦМВ инфицирует В-клетки, латентно инфицированные ВЭБ, более эффективно, чем ВЭБ-негативные [13]. Нельзя не отметить высокий уровень герпес-вирусных антител у этой категории больных.
Внутриядерные включения (рис. 4) слабой степени выраженности и деструктивно-некротические изменения в опухолях умеренной степени были статистически достоверно выше в группе пациентов с отсутствием вируса в опухоли (10,7 против 28,6%; p=0,053; 4 против 22%; p=0,02).
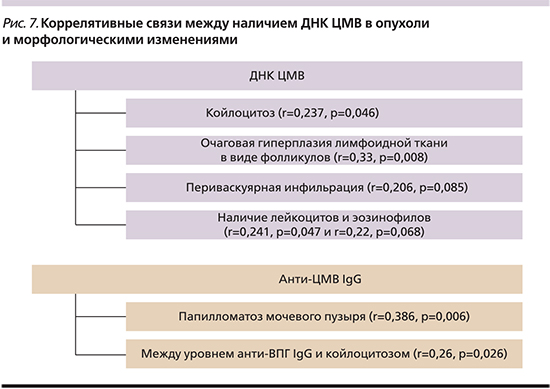
Выявлены преимущественно умеренные коррелятивные связи между наличием ДНК ЦМВ в опухоли и очаговой гиперплазией лимфоидной ткани в виде фолликулов (r=0,33; p=0,008), периваскулярной инфильтрацией (r=0,206; p=0,085), койлоцитозом (r=0,237; p=0,046), наличием лейкоцитов и эозинофилов (r=0,241; p=0,047 и r=0,22; p=0,068). Имела место обратная зависимость между уровнем анти-ЦМВ IgG и наличием папилломатоза мочевого пузыря (r=-0,386; p=0,006), и прямая – между уровнем анти-ВПГ IgG и койлоцитозом (r=0,26; p=0,026). Данные представлены на рис. 7.
Обсуждение
Онкомодулирующий эффект осуществляется при длительной персистенции вируса, в результате ЦМФ-инфекция может приводить к формированию более злокачественного фенотипа клетки и опухолевой прогрессии [5]. В настоящее время в наших условиях доказать онкомодулирующий эффект ЦМВ при РМП in vitro достаточно сложно. На наш взгляд, у пациентов молодого возраста, имеющих персистирующую ЦМФ- или ВЭБ-инфекцию, онкопроцесс как таковой возникает на фоне той иммуносупрессии и измененного иммунного ответа, к которой и приводит хроническая герпес-вирусная инфекция. В качестве возможного онкогена у этой категории больных можно рассматривать ВЭБ и ВПЧ. Латентная ЦМВ-инфекция с высокими титрами антител, по всей видимости, обеспечивает онкомодулирующий эффект у пациентов с имеющейся опухолью мочевого пузыря и приводит к развитию инвазивных форм РМП и способности к метастазированию в регионарные лимфатические узлы.
Онкомодулирующий эффект достигается за счет нескольких механизмов: это воздействие ЦМВ на клеточный цикл опухолевых клеток, на их апоптоз, влияние вируса на инвазию опухолевых клеток, их миграцию и адгезию к эндотелию, ангиогенез и возникновение хромосомных аберраций. M. Michaeles и соавт. утверждают, что опухолевые клетки изменяют клеточное микроокружение, характеризующееся нарушениями во внутриклеточных сигнальных путях, транскрипционных факторах и опухолевых белках- супрессорах, что позволяет ЦМВ оказывать свой онкомодулирующий эффект, который не может проявляться в нормальных клетках [6–9]. ЦМВ-индуцированный онкомодулирующий эффект может возникнуть в результате деятельности вирусных регуляторных белков и некодирующих РНК, которые влияют на свойства опухолевых клеток, включая клеточную пролиферацию, выживание, инвазию, продукцию ангиогенных факторов и иммуногенность. В результате ЦМВ-инфекция может привести к сдвигу к более злокачественному фенотипу опухолевых клеток и опухолевой прогрессии [9, 10]. В частности, ЦМВ-белок US28 приводит к прогрессии клеточного цикла и экспрессии циклина D1 в клетках с опухолевым фенотипом, хотя он индуцирует апоптоз в неопухолевых клетках [11]. А повышение цитоплазматической экспрессии циклина D1 в карциномах мочевого пузыря Та–Т1 свидетельствует об увеличении риска опухолевой прогрессии [12].
Было показано, что ЦМВ защищает опухолевые клетки от апоптоза посредством индукции клеточных белков, в т.ч. AKT (протеин-киназа) и bcl-2, ΔNp73α [8, 9]. Имеется мнение, что в агрессивных формах РМП с мышечной инвазией наблюдается экспрессия bcl-2, и повышение ее связано с плохой выживаемостью. Таким образом, гиперэкспрессия bcl-2 может быть независимым фактором прогноза [13]. Кроме того, в ЦМВ-инфицированных клетках нейробластомы и некоторых линиях карцином толстой кишки повышенная экспрессия белка bcl-2 коррелировала со снижением чувствительности к химиопрепаратам [9, 14], так же как ЦМВ-инфицированные клетки резистентны к химиотерапии [5, 15–17].
Антиапоптозный эффект ЦМВ в клетках нейробластомы проявляется в снижении экспрессии p73 с сопутствующим увеличением экспрессии N-mус через N-myc-зависимый путь [18].
В то же время R. Li и соавт. указывают на роль гиперэкспрессии N-myc регулируемого гена (NDRG2) в регуляции пролиферации и инвазивных свойств клеток РМП in vitro и in vivo [19]. Если говорить о метастатическом потенциале ЦМВ, то US28-путь может активизировать FAK (focal adhesion kinase) и стимулировать клеточную инвазию, наблюдаемую в инфицированных ЦМВ опухолевых клетках [20]. ЦМВ-ассоциированный проангиогенный эффект связан с его воздействием на интегрины β1, β3 и рецепторы эпидермального фактора роста [21]. Анализ ЦМВ-инфицированных клеток показал как наличие повышенного количества проангиогенных молекул, так и увеличенное количество внеклеточных супернатантов [22]. За счет этого механизма опухолевые клетки, как и неизменная строма (фибробласты, эндотелиальные клетки), могут влиять на опухолевое прогрессирование.
Герпесвирусы (ВПГ, ЦМВ, ВЭБ и др.) не только персистируют, но и репродуцируются в клетках иммунной системы, обусловливая гибель или снижение функциональной активности этих клеток, что способствует развитию вторичных иммунодефицитных состояний и вызывает поддержание длительной персистенции. Таким образом, возникает «порочный круг» [3].
Инфицированные ЦМВ опухолевые клетки могут избегать иммунного ответа за счет продукции иммуносупрессивных цитокинов (IK-10) [23–25]. Показано, что у больных герпесом снижена продукция эндогенного интерферона, активность натуральных киллеров и антителозависимая клеточная цитотоксичность, уменьшено абсолютное число и снижена активность Т-лимфоцитов (CD3+, CD4+) и нейтрофилов, повышено число иммунных комплексов. В условиях ослабленного иммунологического контроля не только становится невозможной полная элиминация внутриклеточно расположенного вируса, но и создаются благоприятные условия для распространения вируса от клетки по межклеточным мостикам или экстрацеллюлярным путем. При развитии врожденной или приобретенной иммунодепрессии, включающей резкое угнетение функций естественных киллеров, вирусы выходят из клеток и распространяются током крови в различные органы [3].
Показано, что, например, у пациентов с глиобластомой, ДНК ЦМВ в больших количествах была выявлена и в периферической крови (80%), но не у здоровых людей [26]. Это свидетельствует о системной реактивации ЦМВ у пациентов с глиобластомой (которая может иметь значение для транспортировки вируса из периферии в опухолевую ткань) или сбрасывание вирусных ДНК после реактивации латентной инфекции ЦМВ в опухолевых клетках в периферическое русло. Виремия может иметь значение для переноса ЦМВ в опухолевые клетки за счет клеток иммунной системы (моноциты и макрофаги). Вторичная реактивация может осуществляться за счет опухолевого процесса или быть обусловленной проводимым лечением, иммуносупрессией [26]. Также нужно отметить, что реактивация ЦМВ чаще происходит в воспаленных тканях, чем в невоспаленных. Поэтому воспалительное окружение, присутствующее во всех сóлидных опухолях, может вызывать локальную реактивацию ЦМВ. И наоборот, ЦМВ обладает высокой провоспалительной активностью [9]. Таким образом, реактивация вируса в опухолевой ткани может усиливать воспаление в опухоли и ускорять малигнизацию ткани [5].
Необходимо более детальное изучение вклада вирусов в индукцию и модуляцию опухолевого процесса. Возможно, применение противовирусных вакцин, как при назофарингеальной карциноме, позволит снизить заболеваемость и смертность от РМП. Обнадеживающие результаты получены при применении «checkpoint-inhibitors» в лечении РМП.
Выводы
- Выявлено статистически достоверное повышение уровня вирусных антител у больных рецидивным, местнораспространенным РМП высокого потенциала злокачественности.
- Выявлены статистически значимые коррелятивные связи между наличием вирусных ДНК ЦМВ и ВЭБ в опухоли, уровнем их антител, стадией процесса и рецидивным характером опухоли.
- Выявлены морфологические особенности РМП, протекающего на фоне ЦМВ-инфекции, наличие лимфоцитарно-плазматического инфильтрата периваскулярно, очаговой гиперплазии лимфоидной ткани.
- Выявлены особенности лимфоцитарного звена, цитопатические и пролиферативные изменения уротелия в зависимости от уровня противовирусных антител, стадии процесса и степени анаплазии, наличия вирусных ДНК в опухоли.
- Получены косвенные данные, свидетельствующие об онкомодулирующем эффекте ЦМВ у пациентов РМП.


