Введение
К одним из важных аспектов ведения пациентов с диагнозом «рак легкого» (РЛ), получающих химио-/полихимиотерапию (ХТ/ПХТ), относится коррекция неблагоприятных гастроинтестинальных проявлений – возникающих симптомов желудочной и/или кишечной диспепсии.
Полагают, что ключевым механизмом развития гастроинтестинальной токсичности на фоне назначения цитостатических препаратов могут быть изменения в количественном и качественном составах эндогенного микробиоценоза кишечника. Негативный характер воздействия цитостатических препаратов на микробиоту кишечника реализуется путем как прямого воздействия цитостатиков на микроорганизмы, так и косвенно – через макроорганизм и микроэкологические взаимоотношения различных биотопов. Отмечено, что биологические характеристики бактерий, выделенных из разных биотопов на фоне введения химиотерапевтических препаратов, отличаются от таковых бактерий, встречающихся у людей и лабораторных животных, не подвергавшихся воздействию цитостатиков [8]. На фоне ХТ/ПХТ описано также снижение разнообразия микробного сообщества и количества анаэробных микроорганизмов на уровне целостного организма, в частности в кишечнике [2, 11].
M.J. Van Vliet было показано, что изменения кишечной микрофлоры могут играть основную роль в развитии обусловленного ХТ воспалительного процесса в слизистой оболочке гастроинтестинального тракта [11]. Следует отметить, что некоторые микроорганизмы также могут способствовать образованию активных токсических метаболитов химиотерапевтических лекарственных средств, которые приводят к прогрессированию воспаления в слизистой оболочке кишечника [10, 11]. При этом с клинической точки зрения прогнозирование эффектов цитостатических препаратов в отношении кишечных микроорганизмов может быть затруднено наличием множества факторов, воздействующих на организм пациента, различным влиянием на микроорганизмы одних и тех же химиотерапевтических препаратов в зависимости от конкретных условий применения.
Микроэкологический статус человека и поддержание его гомеостаза – необходимое условие стабильного функционирования всех его органов и систем. Соответственно, одним из мероприятий по обеспечению качества и продолжительности жизни пациентов, в т.ч. онкологических больных, должно быть восстановление микробиоценоза, если он оказался нарушенным. Современные методы коррекции нарушений кишечной микрофлоры предполагают использование комплексного подхода к оздоровлению кишечной эндоэкологии в целом, т.е. нормализацию количественных и качественных взаимоотношений в микробиоценозе, с одной стороны, нормализацию среды обитания микроорганизмов в кишечнике, с другой.
Пробиотики – это живые микроорганизмы из родов, входящих в состав нормобиоты кишечника человека, например Bifidobacterium spp., Lactobacillus spp., Enterococcus faecium, Streptococcus thermophilus и др. Среди пробиотиков можно выделить подгруппу биоэнтеросептиков – живых микроорганизмов, не встречающихся в составе микробиоты человека, но способных элиминировать оппортунистическую микробиоту кишечника (Bacillus subtilis, Saccharomyces boulardii, Saccharomyces cerevisiae и др.). Необходимо учитывать, что у некоторых пациентов живые пробиотические штаммы могут становиться возбудителями интеркуррентной инфекции. Например, описаны случаи, когда пробиотические штаммы лактобацилл и бифидобактерий вызывали бактериемию у больных с выраженными иммунодефицитными состояниями, а штаммы дрожжевых грибов – фунгимию [3, 7]. В связи с этим к группе риска, в которой пробиотические препараты должны применяться с осторожностью, относят пациентов с признаками иммунокомпрометированности (длительная нейтропения с количеством нейтрофилов в крови <500 в мм3 на протяжении более 10 дней; СПИД; длительное использование системных глюкокортикостероидов; недавнее или текущее использование иммуносупрессантов; реакция «трансплантат против хозяина» у реципиентов аллотрансплантатов кроветворных стволовых клеток; первичные иммунодефициты) [7].
За последнее 10-летие у пациентов данной группы риска все чаще используются стимуляторы роста и регуляторы активности полезной микрофлоры кишечника, не содержащие живых штаммов микроорганизмов. К числу таких препаратов относятся метабио-тические комплексы, основу которых составляют несколько синергично действующих компонентов. Данные препараты, как правило, сочетают свойства про- и пребиотика, в их состав могут входить сорбенты, донаторы микроэлементов, регуляторы процессов пищеварения и активные метаболиты бактерий, необходимые для подавления условно-патогенной микрофлоры толстого кишечника, тем самым регулирующие качественные и количественные взаимоотношения кишечных микроорганизмов и оказывающие иммуномодулирующее действие. Метабиотическую терапию, направленную на уменьшение проявлений гастроинтестинальной токсичности цитостатических препаратов, необходимо рассматривать как одну из составляющих комплексного лечения пациентов с диагнозом РЛ, получающих ХТ.
Цель настоящего исследования – оценка клинической эффективности метабиотического препарата на основе лиофилизированного штамма Bacillus subtilis и природного цеолита в составе схем комплексного лечения больных РЛ, получающих ХТ.
Материалы и методы
В исследование был включен 41 пациент, получавший первый или второй цикл первой линии ХТ по поводу РЛ. Возраст пациентов варьировался от 49 до 73 лет, средний возраст составил 61,7±6,4 года, средняя продолжительность заболевания – 12,3±8,5 месяцев. Курс ХТ включал препараты платины, антагонисты фолиевой кислоты, таксаны растительного происхождения и преднизолон в обычных дозах.
Включенные в исследование больные были разделены на две группы. Пациенты группы 1 (n=21) получали на фоне курса ХТ метабиотический комплекс, содержащий стерилизованную культуральную жидкость Bacillus subtilis по 2 капсулы 2 раза в день во время приема пищи в течение 28 дней; пациенты группы 2 (n=20) получали только химиотерапевтические препараты. Группы исследования не имели значимых различий по возрасту, полу и сопутствующим заболеваниям.
Всем пациентам до начала ХТ и на 29-й день после курса химиотерапевтического лечения были проведены следующие исследования: стандартизированный опрос для выявления гастроинтестинальных жалоб, оценка качества жизни посредством опросника GSRS (Gastrointestinal Simptom Rating Scale, автор Wiklund I., 1998, русскоязычная версия – Межнациональный Центр исследования качества жизни, Санкт-Петербург, 1998), микробиологическое исследование фекалий [6], исследование метаболитов микроорганизмов в крови с помощью метода газожидкостной хроматографии – масс-спектрометрии по методу Г.А. Осипова [5]. Оценка эффективности терапии метабиотическим комплексом проводилась по результатам динамики изучаемых показателей.
Статистическая обработка полученных данных осуществлена с помощью программы «SPSS Statistics 17.0» (компания «SPSS Inc.», США), критерия Манна–Уитни–Вилкоксона, критерия χ2, t-критерия Стьюдента, метода Фишера [1, 12].
Результаты исследования и обсуждение
В результате анализа данных стандартизированного опроса выявлено, что у пациентов с диагнозом РЛ до начала проведения иммуносупрессивной терапии в структуре выявленных гастроинтестинальных жалоб уже отмечались явления кишечной диспепсии. Наибольшее значение имело нарушение регулярности акта дефекации, которое выражалось склонностью к запорам, причем преобладали варианты 2-го и 3-го типов по Бристольской шкале формы стула. Среди жалоб со стороны верхних отделов желудочно-кишечного тракта преобладали тошнота, отрыжка воздухом и ощущение горечи во рту. По всем шкалам опросника GSRS у обследуемых пациентов как до, так и после курса иммуносупрессивной терапии наблюдалась умеренная интенсивность гастроинтестинальных жалоб. Максимальное значение имели баллы по шкалам диспепсического синдрома (в среднем от 7,2±3,0 до и 7,2±3,3 после курса ХТ) и синдрома запора (от 5,2±1,9 до и 6,2±3,0 после курса ХТ).
У пациентов группы 1 после дополнительной метабиотической терапии наблюдалось статистически значимое снижение выраженности жалоб по шкалам абдоминальной боли (χ2=7,06, p=0,008) и синдрома запоров (χ2=8,84, p=0,003) по сравнению с контрольной группой, в которой данные жалобы не претерпели значительных изменений.
Также была отмечена тенденция к уменьшению выраженности повышенного газообразования и вздутия живота, снижению необходимости натуживания при дефекации. У пациентов группы 2 на 29-й день исследования помимо участившихся жалоб на тяжесть в эпигастральной области, горечь во рту, отрыжку кислым и повышенное газообразование наблюдалось увеличение склонности к запорам.
По результатам парного сравнения значений по шкалам опросника GSRS до и после курса иммуносупрессивной терапии выявлено статистически значимое усиление обстипационного синдрома у пациентов группы 2 после курса ХТ (z=-2,925, p=0,003), в то время как по остальным шкалам и по шкале суммарного измерения статистически значимых изменений у пациентов группы 2 выявлено не было. Динамика степени выраженности гастроинтестинальных жалоб по шкалам опросника GSRS у пациентов в группах 1 и 2 представлена в таблице.
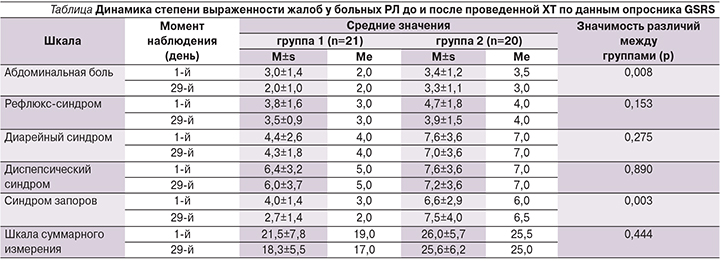
При исследовании состояния кишечного микробиоценоза бактерио-логическим методом у пациентов с диагнозом РЛ был выявлен скудный рост облигатных микроорганизмов в фекалиях и выявлены дисбиотические изменения. Распределение включенных в исследование пациентов в зависимости от количества представителей микрофлоры толстого кишечника показано на рис. 1. Было выявлено уменьшение количества бифидобактерий, практически полное отсутствие бактероидов, уменьшение количества кишечной палочки с нормальной ферментативной активностью и увеличение количества кишечной палочки со сниженной ферментативной активностью, присутствие условно-патогенных и гемолитических микроорганизмов, Staphylococcus aureus, увеличение количества грибов рода Candida. У пациентов группы 1, получавших дополнительно к основной терапии метабиотическую поддержку, показатели облигатной микробиоты (лактобактерий и бактероидов) преимущественно оставались на прежнем уровне, но доля пациентов со сниженным количеством бифидобактерий уменьшилась с 57,1 до 42,9%, у пациентов с повышенным количеством кишечной палочки со сниженной ферментативной активностью уменьшилась с 81,0 до 66,7%.
На фоне ХТ у пациентов группы 2 было выявлено прогрессирующее снижение количества бифидобактерий – с 50,0 до 65,0%. Доля пациентов со сниженным количеством кишечной палочки с нормальной ферментативной активностью практически не изменилась, как и доля пациентов с повышенным количеством кишечной палочки со сниженной ферментативной активностью.
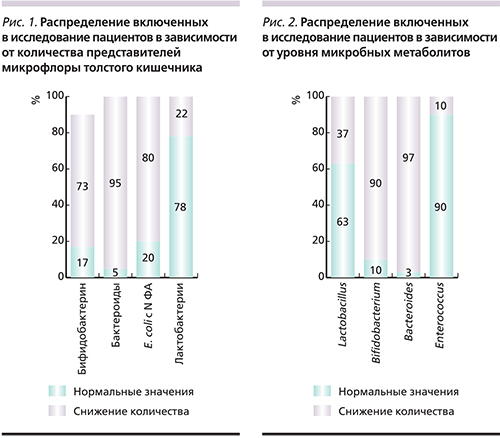
При определении концентрации микробных маркеров по методу Г.А. Осипова у включенных в исследование пациентов даже до начала ХТ обнаружено клинически значимое снижение уровня метаболитов бифидобактерий (у 90% пациентов), лактобактерий (у 37% пациентов) и бактероидов (у 97% пациентов). Общая микробная нагрузка была снижена у 48,3% пациентов. Распределение включенных в исследование пациентов в зависимости от уровня микробных метаболитов показано на рис. 2.
Обращал на себя внимание низкий уровень метаболитов Streptococcus spp., что наблюдалось у 69% пациентов, Clostridium hystolyticum – у 82,8%, Lactococcus – у 31,0%, Clostridium propionicum – у 93,2%, Actinomyces – у 73%, Pseudonocardia – у 87%, Clostridium ramosum – у 43%, Alcaligenes – у 20,7%, Staphylococcus intermedius – у 44,8%, Eubacterium – у 41,4%, Enterococcus – у 82,8%. При этом отмечалось появление в крови метаболитов патогенных микроорганизмов, уровень которых не должен превышать нулевое значение, в т.ч. Peptostreptococcus anaerobius – у 89,7% пациентов, Pseudomonas aeruginosa – у 24,1%, Fusobacterium/Haemophylus – у 65,5%, Clostridium perfringens – у 65,2%, Moraxella/Acinetobacter – у 24,1%, Bacteroides fragilis – у 44,8%.
По результатам определения уровней микробных метаболитов в крови на 29-й день исследования (после проведения ХТ) выявлена тенденция к снижению общей микробной нагрузки в группе 2, в то время как в группе 1 имелась тенденция к ее повышению. В отношении метаболитов облигатных микроорганизмов отмечено, что у пациентов обеих групп уровень метаболитов бифидобактерий практический не изменился, но наблюдалась тенденция к снижению уровня метаболитов лактобактерий в группе 2. При парном сравнении значений в группах на 1-й и 29-й дни наблюдения отмечалось статистически значимое увеличение количества энтерококков у пациентов группы 1 (z=-3,211, p=0,001), что не наблюдалось в группе 2. Снижение уровня метаболитов грибов рода Candida на 29-й день наблюдения имело место в обеих группах. Более значительное снижение уровня метаболитов грибов рода Candida с 162,7×105 до 159,4 кл/г×105 наблюдалось в крови пациентов, принимавших метабиотический комплекс.
Заключение
По результатам проведенного исследования у пациентов с диагнозом РЛ на фоне токсического действия ХТ подтверждено прогрессирование гастроэнтерологических жалоб и изменение качественного и количественного состава микрофлоры кишечника, проявлявшееся не только снижением числа облигатных представителей микробиоценоза, но и в целом скудностью микробного представительства в кишечнике на фоне усиления активности условно-патогенной микрофлоры.
Использование метабиотического препарата на основе лиофилизированного штамма Bacillus subtilis позволило уменьшить явления кишечной диспепсии у пациентов с диагнозом РЛ (в первую очередь обстипационного синдрома и синдрома абдоминальной боли) и предотвратить дальнейшее повреждение кишечного микробиоценоза на фоне ХТ.
Учитывая вышеизложенное, мы полагаем, что в отношении больных РЛ целесообразно принимать во внимание выявленные микроэкологические особенности микробиоты кишечника и начинать превентивную коррекцию нарушений микроэкологии желудочно-кишечного тракта еще до начала цитостатической терапии, особенно у лиц, уже имевших патологические изменения пищеварительной системы в анамнезе до момента постановки диагноза онкологического заболевания.
Выводы
Пациентам с диагнозом РЛ на фоне проводимой ХТ показано назначение метабиотического препарата на основе лиофилизированного штамма Bacillus subtilis по 2 капсулы 2 раза в день во время приема пищи длительностью не менее 28 дней.



