Введение
Для пациентов с РМЖ II–III стадий неоадъювантная системная терапия (НСТ) позволяет добиваться снижения стадии заболевания вплоть до минимального размера (ypT1ab ypN0) и pCR (RCB 0), что в свою очередь может приводить к сокращению объема хирургического этапа лечения как на молочной железе, так и в аксиллярной области [1–9]. Благодаря усовершенствованию индивидуализации неоадъваюнтного системного лечения повысилась частота достижения полного патоморфологического ответа (pCR), важного прогностического маркера, нередко отражающего высокие показатели выживаемости. Именно проведение НСТ может выявить пациентов с остаточной (резидуальной) опухолью и с помощью систем патоморфологической оценки, таких как Miller-Payne и RCB index, избрать альтернативный режим постнеоадъювантной терапии, не совпадающий с недостаточно эффективным неоадъювантным лечением [10]. Важные выводы экспертов (St. Gallen, 2021) заключаются в том, что достижение pCR (RCB0) сопровождается одинаковыми показателями выживаемости при исходно разных биологических подтипах [2].
Целью настоящего исследования стало определение корреляции между схемами проводимой НСТ и степенью опухолевого ответа по результатам послеоперационного патоморфологического заключения по шкале RCB.
В данной работе предпринята попытка определить предиктивные и прогностические факторы, влияющие на выбор лечения, изучение эффективности различных схем, режимов неоадъювантного и постнеоадъювантного лечения.
Методы
Проводился анализ данных 455 пациентов 18–65 лет с местнораспространенным РМЖ сT1-3N1-3M0 I–IIIC-стадий, которым проводилось комплексное или комбинированное лечение. В данное исследование включались пациенты, получавшие лечение в НМИЦ онкологии им. Н.Н. Петрова с 2015 по 2021 г.
Пациентам всех групп проводилось лечение согласно действующим рекомендациям Минздрава РФ. [11]. Патоморфологическая оценка проводилась в отделе патоморфологии опухолей НМИЦ онкологи им. Н.Н. Петрова.
В исследовании использовалось определение молекулярно-биологических и суррогатных подтипов РМЖ, основанное на патоморфологической (ИГХ – иммуногистохимической) оценке уровня экспрессии рецепторов стероидных гормонов (ER/PR), HER2, Ki-67, гистологической степени злокачественности (G), методами, рекомендованными экспертами ST. Gallen, ESMO и c использованием системы RCB (Residual Cancer Burden. Бесплатный on-line-калькулятор доступен на сайте http://www3.mdanderson.org/app/medcalc/index. cfm?pagename=jsconvert3). Подробные характеристики пациентов, включенных в исследование и виды неаодъювантного лечения, представлены в табл. 1.
Для определения факторов, влияющих на выживаемость пациентов, использовалась модель пропорциональных рисков Кокса (методы принудительного включения и прямой пошаговый [отношение правдоподобия]). Критическое значение уровня статистической достоверности нулевой гипотезы принимали равным 0,05. Различия признавали статистически значимыми при р<0,05
Частота объективного ответа – процент достижения полного или частичного ответа опухолевого узла, согласно шкале индекса RCB, осуществлялся арифметическим подсчетом.
Результаты
Известно, что единственным методом неоадъюватного лечения местнораспространенного ER-/HER2-РМЖ является химиотерапия. Выбор конкретной схемы и режимов терапии остается спорным. Согласно рекомендациям ESMO (2019) и St. Gallen (2021) [2], стандартом терапии для ER-/HER2-РМЖ следует считать схему АСх4–Pх12 (АС-Т). Хотя в некоторых центрах в неоадъювантную схему включают и карбоплатин, особенно при наличии мутации BRCA 1 или реже – при наличии РМЖ в семейном анамнезе.
В НМИЦ онкологии им. Н.Н. Петрова, где специально изучается эффект неоадъювантной химиотерапии пациентов с мутацией BRCA ½ и других генов, чаще включаются препараты на основе солей платины [12]. В данном исследовании схемы, включающие соли платины, использованы у 85 (68%) из 125 пациентов (табл. 2). Главной целью неоадъювантной терапии является достижение патоморфологического полного ответа на лечение (pCR или ypT0/is N0 или RCB0). Таким образом, RCB0 достигнуто 77 (61,6%) из 125 пациентов с ER-/HER2-РМЖ.
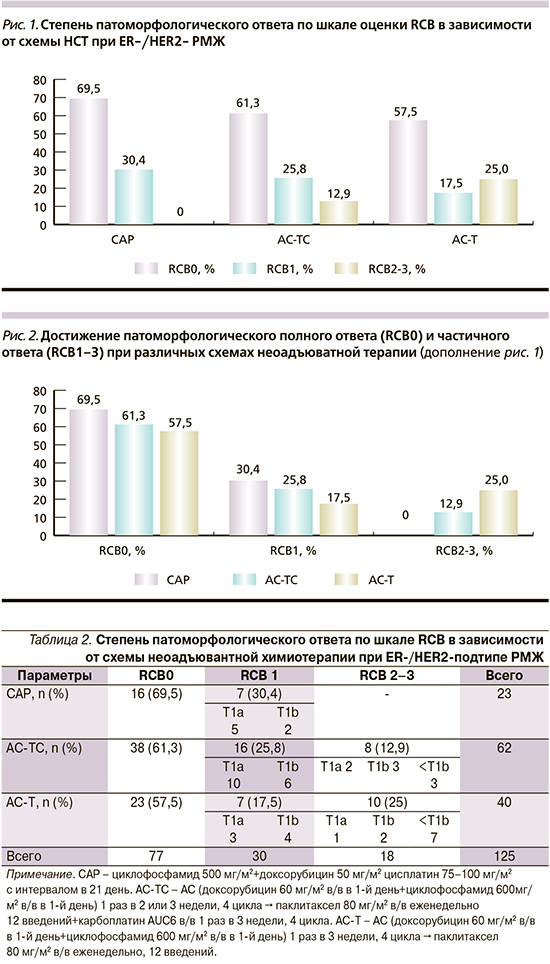
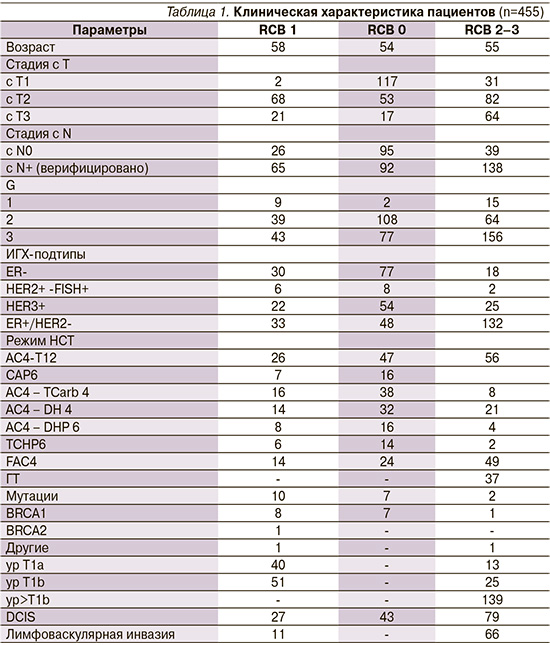
В объединенной группе (CAP+AC-TC), включившей соли платины (карбоплатин), RCB0 достигнуто 54 (63,5%) из 85 пациентов, в группе стандартной терапии (АС-Т) – 23 (57,5%) из 40 пациентов (p=0,0064). При прямом сравнении схемы САР против стандартной АС-Т различия более значимые: 69,5 против 57,5% (р=0,052, рис. 1).
Минимальные резидуальные заболевания (ypT1ab ypN0 или RCB1) выявлены у 30 (24%) из 125. Здесь также видно преимущество неоадъювантной терапии, включающей карбоплатин: САР – 30,4%, АС-ТС – 25,8%, АС-Т – 17,5% (р=0,064, рис. 2).
Частота достижения pCR (RCB0) значительно чаще наблюдалась при добавлении препаратов платины к системной терапии при схемах CAP и AC-TC соответственно. Частота достижения RCB0 (pCR) после НСТ по схеме САР составила 69,5%, после НСТ по схеме АС-ТCarb – 61,3%, после НСТ по схеме АС-Т – 57,5%. Частота достижения RCB1 после НСТ по схеме САР составила 30,4%, после НСТ по схеме АС-ТCarb – 25,8%, после НСТ по схеме АС-Т – 17,5%.
Частота достижения RCB2–3 после НСТ по схеме АС-ТCarb составила 12,9%, после НСТ по схеме АС-Т – 25%, после НСТ по схеме САР достижений RCB2–3 в данной группе зарегистрировано не было.
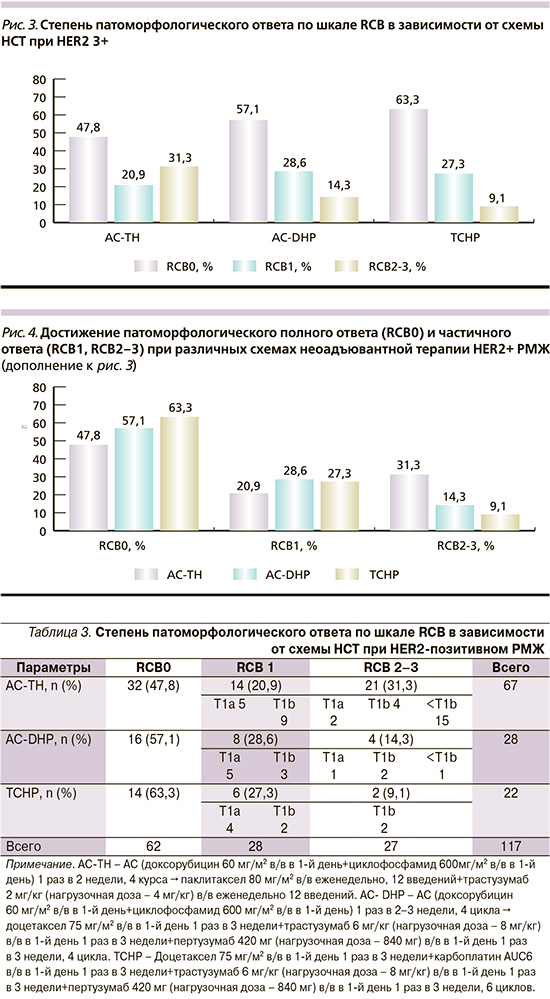
Достижения pCR (RCB0) значительно чаще наблюдались при добавлении препарата пертузумаб при схемах TCHP и АС-DHP. Частота достижения RCB0 (pCR) после НСТ по схеме AC-TH составила 47,8%, после НСТ по схеме АС-DHP – 57,1%, после НСТ по схеме ТСНР – 63,3%. Частота достижений RCB1 после НСТ по схеме AC-TH составила 20,9%, после НСТ по схеме АС-DHP – 28,6%, после НСТ по схеме ТСНР – 27,3%. Частота достижений RCB2–3 после НСТ по схеме AC-TH составила 31,3%, после НСТ по схеме АС-DHP – 14,3%, после НСТ по схеме ТСНР – 9,1%.
Во всех группах прослеживается тенденция преимущества от добавления препарата пертузумаб (в группе AC-DНР, ТСНР), однако в группе пациентов, получивших в неоадъювантном режиме схему TCHP, полный ответ (pCR или RCB0) был достигнут 63,3% пациентов, поэтому остается открытым вопрос о целесообразности включения в схемы препаратов платины при HER2+-позитивном РМЖ.
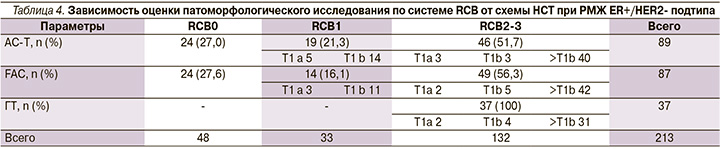
В табл. 3 представляется частота и степень патоморфлогического ответа на различные схемы неоадъювантной (анти-HER2+ НСТ) от 117 пациентов с HER2-позитивном РМЖ. Полный патоморфологический ответ (pCR или RCB0 или yp T0/is ypN0) достигнут 62 (52,3%) из 117 пациентов. Чаще всего (63,3%) pCR достигался пациентами, получавшими стандартную в последние 3 года терапию по схемам ТСНР, включавшим кроме химиотерапии трастузумаб и пертузумаб.
Минимальной резидуальной категории в самой молочной железе достигли 52 (44,9%) пациента из 117 с HER2+-РМЖ, но с резидуальными регионарными лимфоузлами – 27 (23%) пациентов. Достижение патоморфологического полного ответа (pCR или RCB0) наблюдалось чаще после неоадъювантных режимов, включивших кроме химиотерапии два анти-HER2-таргетных препарата (трастузумаб+пертузумаб). Такой ответ получен от 30 (60%) из 50 пациентов по сравнению с 47,8% в группе пациентов, получавших один трастузумаб+химиотерапию (р<0,05). Достижение минимального резидуального РМЖ (RCB0 или ypT1ab ypN0) наблюдалось у 14 (28%) пациентов, получавших трастузумаб+пертузумаб+НСТ, против 20,9% у пациентов, получавших один трастузумаб+НСТ (р<0,05; табл. 3, рис. 3, 4).
Прежде чем оценить результаты неоадъюватной терапии местнораспространенных (IIb–IIIa) стадий ER+/HER2-подтипа РМЖ, особенно у пациентов, достигших минимального размера (ypT1ab ypN0), важно знать отдаленные результаты лечения первично-минимальных ER+-опухолей (pT1abN0) (табл. 4).
Проведение неоадъювантной химиотерапии 176 пациентам позволило достичь патоморфологического полного ответа (pCR или RCB0) от 48 (27,2%) пациентов. При проведении гормонотерапии (37 постменопаузальных пациентов) не было достигнуто полного ответа (RCB 0) ни в одном из случаев, но зато у всех 37 пациентов наблюдался значительный ответ (ypT1abN0-1).
ER+ РМЖ является наиболее интересной группой для изучения и обладает достаточно спорными результатами достижения полного патоморфологического ответа – pCR. Было проведено сравнение двух схем неоадъювантной химиотерапии, одобренных и рекомендованных Минздравом РФ к применению при ER+ РМЖ. Это системная цитотоксическая химиотерапия по схеме FAC и системная терапия, относящаяся к третьему поколению, – схема AC-T. Процент достижения RCB0, pCR примерно одинаковый – 27 и 27,6% соответственно. В группе пациентов, получавших гормонотерапию в качестве неоадъюватного лечения, достижения pCR (RCB0) не наблюдалось. Большинство пациентов, получивших гормонотерапию, оказались в группе RCB2–3, а размер опухолевого узла >ypT1b позволил выполнить органосохраняющую операцию большинству этих пациентов. Однако нужны полноценные исследования для сравнения эндокрино- и химиотерапии в неаодъювантном режиме при ER+ РМЖ.
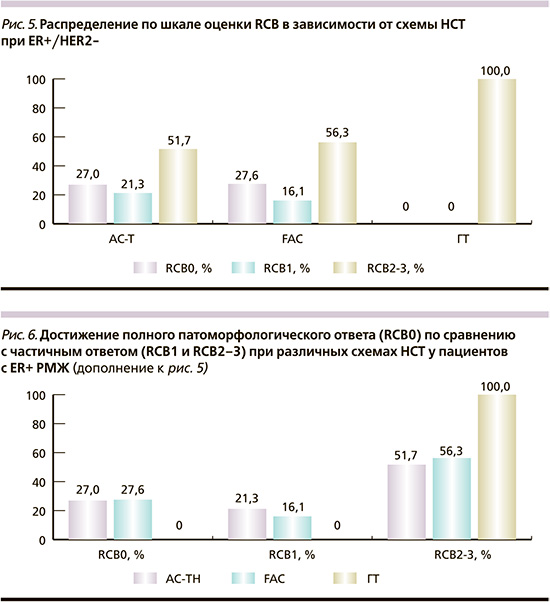
Частота достижения RCB0 (pCR) после НСТ по схеме AC-T составила 27%, после НСТ по схеме FAC – 27,6%, после гормонотерапии (ГТ) достижений RCB0 в данной группе зарегистрировано не было.
Частота достижения RCB1 после НСТ по схеме AC-T составила 27%, после НСТ по схеме FAC – 27,6%, после ГТ достижений RCB0 в данной группе зарегистрировано не было.
Частота достижения RCB2–3 после НСТ по схеме AC-T составила 51,7%, после НСТ по схеме FAC – 56,3%, после ГТ – 100%.
Также дополнительно проведена оценка общепринятых предиктивных факторов, способных влиять на прогноз заболевания.
Факторы ухудшения общей выживаемости:
Оценка влияния факта наличия часто встречаемых мутаций (сцепленных с РМЖ):
1) Наличие BRCA 1-мутации влияет на прогноз (ОР=0,349, 95% ДИ: 0,231–0,528; р<0,001; табл. 5).
2) Наличие DCIS статистически не влияет на прогноз (р>0,005; табл. 6).
3) Недостижение RCB0, 1 увеличивает риск смерти (ОР=4,177; p<0,005), табл. 7.
Обсуждение
Индивидуализация лечения, как и повышение эффективности проводимой терапии, требует постоянного поиска новых прогностических и предиктивных факторов, которые могут в конечном итоге влиять на показатели выживаемости пациентов с РМЖ.
В проведенном нами анализе данных были определены схемы и комбинации препаратов, влияющих на улучшение исхода заболевания путем достижения полной патоморфологической регрессии на фоне НСТ. Конечно, необходимо провести более детальный анализ данных, оценить критерии переносимости лекарственных препаратов (токсичность), экономическую составляющую и конечно же оценить отдаленные показатели выживаемости.
Что касается оценки предиктивных факторов, к сожалению, молекулярно-генетические исследования несовершенны, это значит, что мы не всегда точно можем определить наличие мутации. При оценке DCIS (дуктальной карциномы in situ) как отдельного фактора очень интересным будет его оценка в долгосрочной перспективе и найдет ли он свое отражение в отдаленных показателях локального контроля над заболеванием [13].
При оценке степени патоморфологического ответа мы использовали шкалу RCB ввиду возможности оценки именно средней клеточности остаточной опухоли, однако, принимая во внимание работы по оценке опухолевого микроокружения, необходимо создание более совершенной системы оценки опухолевого ложа [14–15].
Заключение
Применение в неоадъювантной химиотерапии, включившей соли платины (САР, АС-ТС), пациентами с трижды негативным РМЖ позволило достичь патоморфологически полного ответа (pCR или RCB-0) от 69,5% пациентов против 57,5% после стандартной АС-Т-терапии [p<0,05]. Пациентам с местнораспространенным HER2-позитивным РМЖ проведение неоадъювантной таргетной терапии (трастузумаб+пертузумаб+химиотерапия, включающая таксаны) позволяет достигать патоморфологически полного ответа (pCR или RCB-0) от 63,3% пациентов по сравнению с 47,8%, получавших один трастузумаб+химиотерапию [p<0,05].
Прогностически неблагоприятными факторами, оказывающими влияние на эффективность органосохраняющего лечения, коррелирующими с ухудшением общей выживаемости, являются наличие мутации BRCA1, недостижение RCB0, 1. Наличие мутации BRCA1 повышает шанс умереть от основного заболевания в 0,35 раза (отношение рисков – ОР=0,349, 95% доверительный интервал [ДИ]: 0,231–0,528; р<0,001). Интерпретация шкалы RCB оказалась независимым прогностическим фактором для всех подтипов РМЖ. Недостижение RCB0,1 увеличивает риск смерти от рака молочной железы в 4 раза (ОР=4,177, 95% ДИ: 1,490–11,712; p<0,005).
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы на соискание ученой степени канд. мед. наук: «Эффективность органосохраняющего лечения минимальных резидуальных опухолей после неоадъювантной терапии рака молочной железы».



