Кардиоваскулярная безопасность нестероидных противовоспалительных препаратов (НПВП) – объект пристального внимания исследователей и врачей в последние годы [1, 2]. Согласно данным недавно опубликованных мета-анализов, НПВП повышают риск ишемического инсульта, развития хронической сердечной недостаточности (ХСН) и ухудшения ее течения [3–5].
Согласно рекомендациям Евро-пейской антиревматической лиги (The European League Against Rheumatism, EULAR) 2016 г., необходима осторожность при назначении НПВП больным ревматоидным артритом (РА) и псориатическим артритом (ПсА), особенно пациентам с документированными сердечно-сосудистыми заболеваниями (ССЗ) или при наличии факторов риска ССЗ [6]. По данным недавнего мета-анализа, неселективные НПВП и коксибы неблагоприятно влияют на течение ССЗ у больных РА и ПсА [7]. Тем не менее повышенный кардиоваскулярный риск обусловлен главным образом рофекоксибом, изъятым из продажи еще в 2004 г. Более того, согласно последним данным, индуцированный НПВП риск ССЗ ниже у больных РА по сравнению с общей популяцией [8].
Повышенный риск ССЗ на фоне приема НПВП обусловлен несколькими причинами, в т.ч. прогипертензивными эффектами. По данным мета-анализов, результаты которых были опубликованы в 1993 и 1994 гг. [9, 10], прием НПВП сопровождается повышением среднего артериального давления (АД) на 5 мм рт.ст. у больных артериальной гипертензией (АГ) и существенно снижает антигипертензивную эффективность β-адреноблокаторов [10]. Наибольший прогипертензивный эффект был описан для индометацина (повышение среднего АД на 3,59 мм рт.ст.) и напроксена (повышение АД на 3,74 мм рт.ст.) [9]. Позже была показана способность НПВП уменьшать антигипертензивную эффективность ингибиторов ангиотензинпревращающего фермента (АПФ) и блокаторов ангиотензиновых рецепторов [11], в меньшей степени отмечено снижение эффективности терапии антагонистом кальция [12].
По данным систематического обзора A. Morrison и соавт. [13], посвященного влиянию неселективных НПВП на АД и частоту АГ, наибольший прогипертензивный эффект наблюдался у ибупрофена: повышение систолического АД на 3,54 мм рт.ст., 95% доверительный интервал (ДИ) – 2,70–4,39; диастолического АД – на 1,16 мм рт.ст., 95% ДИ – 0,68–1,64. Сходное влияние на АД продемонстрировал индометацин. В то же время изменение АД на фоне приема диклофенака не отличалось от эффекта плацебо. Применение ибупрофена увеличивает вероятность развития АГ по сравнению с плацебо (отношение шансов [ОШ] – 2,85, 95% ДИ – 1,44–5,65) [13].
Немногочисленные исследования с применением суточного мониторирования АД продемонстрировали, что неселективные НПВП и в большей степени ингибиторы циклооксигеназы-2 (ЦОГ-2) повышают среднесуточное АД [14, 15]. Особенно выраженный эффект на среднесуточное систолическое АД оказывает эторикоксиб [15]. Кроме того, НПВП отрицательно влияют на суточный ритм АД: увеличивается число пациентов с недостаточным снижением АД в ночное время [16]. В другом исследовании показано, что рофекоксиб существенно повышает средненочное систолическое и диастолическое АД, в то время как набуметон повышает среднесуточное АД без влияния на суточный профиль [17].
С другой стороны, есть противоречащие данные о снижении среднесуточного АД у больных хорошо контролируемой АГ и остеоартрозом на фоне терапии лумиракоксибом 100 мг в сутки по сравнению с ибупрофеном 600 мг в сутки (3 приема) [18]. При сравнении целекоксиба и плацебо у больных АГ и остеоартрозом, получавших терапию ингибитором АПФ лизиноприлом, не было отмечено значимого повышения АД или снижения эффективности ингибитора АПФ [19].
Терапевтический эффект всех НПВП реализуется за счет блокады индуцируемого в области воспаления ЦОГ-2, что приводит к снижению образования простагландина Н2 (ПГН2) и последующих продуктов его метаболизма. Центральным медиатором как хронического, так и острого воспаления на сегодняшний день рассматривается именно простагландин Е2 (ПГЕ2), в основном синтезируемый из ПГH2 с помощью трех различных энзимов: микросомальной простагландин Е2 синтазы-1 (мПГЕ2С-1), цитозольной синтазы ПГЕ2 (цПГЕ2С) и микросомальной ПГЕ2 синтазы-2 (мПГЕ2С-2). Последние два энзима структурно и биологически отличаются от мПГЕ2С-1 – основного энзима, ответственного за биосинтез ПГЕ2 во время воспалительной реакции [20].
К биологическим эффектам ПГЕ2 относятся гастропротекция, вазодилатация, гипералгезия, гипертермия в зависимости от того, с каким рецептором он взаимодействует. Выделяют четыре варианта рецепторов (ЕР1-4) к ПГЕ2. Так, взаимодействие ПГЕ2 с рецептором ЕР2 обусловливает развитие гипертермии и гипералгезии, а взаимодействие с ЕР3 обеспечивает гастропротективное свойство: усиление выработки бикарбоната и слизи и уменьшение выработки соляной кислоты. Снижение образования ПГЕ2 за счет ингибирования мПГЕ2С-1 рассматривается как терапевтический подход к лечению воспалительных заболеваний с целью снизить развитие типичных нежелательных побочных эффектов (желудочно-кишечную, почечную и сердечно-сосудистую токсичность), наблюдаемых при лечении НПВП. И хотя механизм действия всех НПВП принципиально не различается, но именно различия в биохимическом строении молекулы определяют особенности взаимодействия с ЦОГ. Так, в отношении производных бензотиазина оксикамов выявлены интересные отличия фармакологического действия от остальных препаратов группы НПВП.
Термин «оксикам» введен Советом США по принятию названий (The United States Adopted Names Council, USANC) для описания НПВП, принадлежащих к классу энолиновых кислот, производных 4-гидрокси-1,2-бензотиазина 3-карбоксамида. Первым представителем данной группы был пироксикам, далее следовали изоксикам, мелоксикам, теноксикам и лорноксикам. Оксикамы фиксируются к активной зоне ферментативного канала при помощи множественных гидрофобных связей и единственной непосредственной водородной связи между 4-гидроксильной группой оксикама и аминокислотой Ser-530 ЦОГ. При этом две фиксированные молекулы воды в активной зоне обеспечивают дополнительные полярные связи между молекулой оксикама и структурами ЦОГ в каталитической вершине и зоне сужения ферментативного канала. Контакт боковой цепи оксикама с аминокислотой Leu-531 ЦОГ приводит к формированию особой пространственной конформации комплекса и появлению нового гидрофобного «кармана», составленного из 8 аминокислотных остатков фермента (Met-113, Val-116, Leu-117, Ile-345, Val-349, Leu-531, Leu-534 и Met-535). Как представляется создателям модели взаимодействия оксикамов и ЦОГ, наличие данной структуры объясняет более длительный противовоспалительный эффект этих препаратов, а также открывает новые возможности модификации оксикамов и создания новых перспективных молекул [21].
Недавно интерес к этому классу НПВП возрос благодаря открытию того факта, что некоторые производные оксикамов являются сильнодействующими ингибиторами не только мПГЕ2С-1, но и мПГЕ2С-2, осуществляющего конечный синтез основного медиатора воспаления – ПГЕ2. Сильное ингибирование этих ферментов с помощью оксикамов в анализе in vitro делает их притягательными молекулами для разработки новых противовоспалительных лекарственных средств, нацеленных на селективный биосинтез ПГЕ2.
В 2014 г. опубликован один из крупнейших мета-анализов W. Asghar и F. Jamali, в котором изучено 2422 публикации, из них отобрано 19 обсервационных или рандомизированных контролируемых исследований, содержащих сведения о кардиальной или общей летальности (длительность приема препарата – более 90 дней) и/или сосудистых/почечных осложнениях (любая длительность приема) на фоне применения мелоксикама [22]. Согласно данным 5 исследований, прием мелоксикама и напроксена в течение более 90 дней не ассоциировался с повышением риска кардиальных осложнений (диагностированная ишемическая болезнь сердца, остановка сердца, нарушения сердечного ритма, сердечная недостаточность), в то время как прием рофекоксиба и диклофенака сопровождался повышением кардиального риска (см. таблицу).

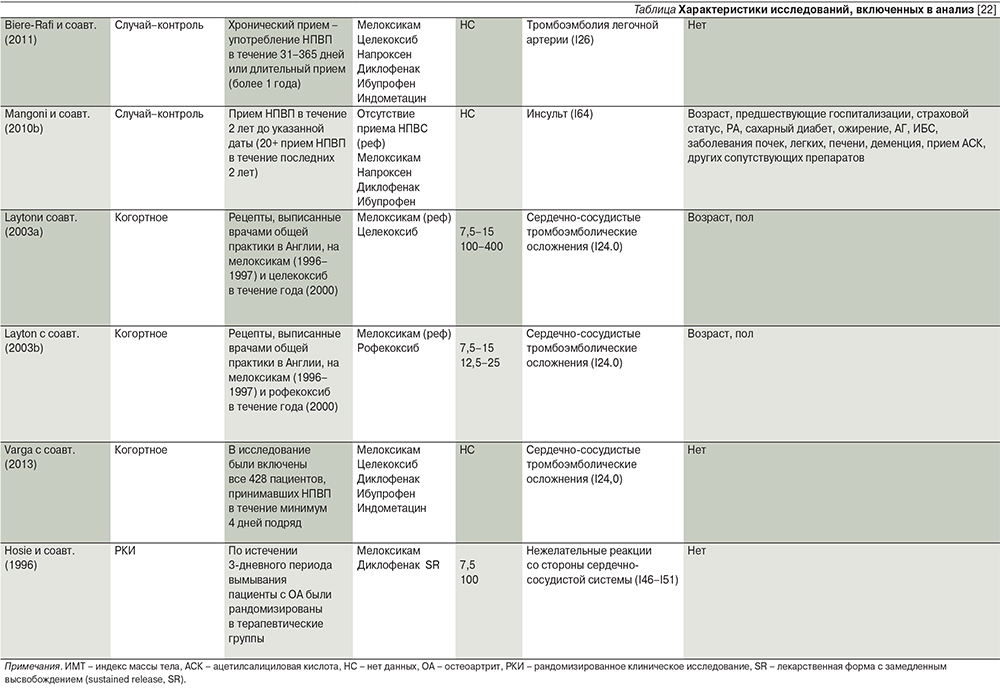
По результатам семи исследований, содержащих сведения о влиянии приема мелоксикама любой продолжительности на сосудистую систему, выявлено увеличение отношения шансов (ОШ) на фоне приема мелоксикама.
К анализируемым сосудистым осложнениям отнесли развитие острого нарушения мозгового кровообращения, субарахноидальное, внутримозговое кровоизлияние, эмболию и тромбоз артерий. Прием других НПВП также приводит к увеличению ОШ с расположением препаратов в следующем порядке: напроксен, диклофенак, ибупрофен, индометацин и целекоксиб [22]. При анализе всех 19 исследований установлено, что прием мелоксикама ассоциируется с незначительным повышением совокупного риска (ОШ – 1,14; 95% ДИ – 1,04–1,25), в основном за счет сосудистого компонента (ОШ – 1,35; 95% ДИ – 1,18–1,55) в отсутствие повышения кардиального (ОШ – 1,13; 95% ДИ – 0,98–1,32) или почечного риска (ОШ – 0,99; 95% ДИ – 0,72–1,35) [22]. По сравнению с мелоксикамом прием других НПВП приводит к дозозависимому повышению совокупного риска с расположением препаратов по степени риска в следующем порядке: рофекоксиб>индометацин>диклофенак>целекоксиб>напроксен>ибупрофен. На величину ОШ также оказывали влияние тип заболевания, используемый препарат сравнения, а также сочетанный прием ацетилсалициловой кислоты [22].
Согласно данным мета-анализа, проведенного Р. Ungprasert и соавт., применение НПВП как единой группы связано с небольшим, но статистически незначимым риском геморрагического инсульта (ОШ – 1,09; 95% ДИ – 0,98–1,22). Однако для групп пациентов, принимающих диклофенак и мелоксикам, выявлено достоверное увеличение риска (ОШ – 1,27; 95% ДИ – 1,02–1,59 и 1,27; 95% ДИ – 1,08–1,50 соответственно). Оценка риска для рофекоксиба составила 1,35; 95% ДИ – 0,88–2,06 [23]. Декомпенсация ХСН на фоне приема НПВП является редким, но безусловно серьезным состоянием. ХСН чаще развивается при приеме неселективных НПВП больными, уже имеющими данную патологию, а также пациентами с АГ, патологией почек и сахарным диабетом [24]. Риск повышается при применении высоких доз НПВП [25]. Согласно данным С. Varas-Lorenzo и соавт., проанализировавших 3829 статей, наиболее часто используемые в клинической практике НПВП, за исключением напроксена, связаны с повышенным риском инфаркта миокарда в высоких дозах или лицами с диагностированной ишемической болезнью сердца. Так, ОШ было самым низким для напроксена – 1,06 (95% ДИ – 0,94–1,20), далее следуют целекоксиб – 1,12 (1,00–1,24), ибупрофен – 1,14 (0,98–1,31), мелоксикам – 1,25 (1,04–1,49), рофекоксиб – 1,34 (1,22–1,48), диклофенак – 1,38 (1,26–1,52), индометацин – 1,40 (1,21–1,62), этодолак – 1,55 (1,16–2,06) и эторикоксиб – 1,97 (1,35–2,89) [26]. Особенно высок риск сердечно-сосудистых осложнений (в т.ч. фатальных) для больных ишемической болезнью сердца, перенесших инфаркт миокарда, а также операции на сердце и сосудах (аортокоронарное шунтирование, стентирование) Так, в исследовании G.H. Gislason и соавт. из 58 432 пациентов, прошедших успешный курс лечения после первого инфаркта миокарда за период с 1995 по 2002 г., в дальнейшем 9773 пациента перенесли инфаркт повторно, 16 573 умерли. Как показал анализ, прием любых НПВП ассоциировался с повышением риска смерти пациентов: ОШ для целекоксиба составило 2,57 (95% ДИ – 2,15–3,08); для диклофенака – 2,40 (95% ДИ – 2,09–2,80), для ибупрофена – 1,50 (95% ДИ – 1,36–1,67) для других НПВП – 1,29 (ДИ – 1,16–1,43) [27].
Таким образом, мелоксикам, применяющийся на российском рынке с 1996 г., т.е. уже на протяжении 20 лет, характеризуется высокой противовоспалительной и анальгетической активностью, отличается достаточно высоким уровнем безопасности. Он структурно отличается от других ингибиторов ЦОГ-2, например коксибов, связываясь с верхней частью канала ЦОГ-2, а не с боковой частью этого фермента, не влияет на агрегацию тромбоцитов и время кровотечения, что объясняет его улучшенный профиль кардиоваскулярной безопасности. Недавние исследования ЦОГ в комплексе с оксикамами представляют первое подробное изображение способа связывания оксикамов через сеть с двумя молекулами воды в главном канале активной зоны ЦОГ. Особое внимание привлечено к группе оксикамов благодаря открытию факта, что некоторые их производные являются сильнодействующими ингибиторами мПГЕ2С-1, осуществляющего конечный синтез основного медиатора воспаления – ПГЕ2. Эти данные открывают перспективы к созданию нового класса селективных ингибиторов ПГЕ2.



