Введение
За последние годы увеличивается заболеваемость хроническими болезнями печени (ХЗП). Несмотря на успехи гепатологии, особенно в лечении гепатита С, ежегодно только от вирусных гепатитов умирают более 1 млн человек. Одним из грозных осложнений и причин смерти при ХЗП остается портальная гипертензия (ПГ). Известно, что основой для формирования ПГ у больных ХЗП является образование внутрипеченочного гемодинамического блока и позднее – периферической (спланхнической) вазодилатации [1, 2]. К первичным ранним факторам, ведущим к ПГ, относится увеличение внутрипеченочного сосудистого сопротивления, которое приводит к нарушениям портопеченочной гемодинамики еще задолго до ПГ. Однако механизмы данного процесса в настоящее время изучены недостаточно, ПГ – это «неоткрытая страна» («undiscovered country») [3]. Увеличение сосудистого сопротивления и гемодинамический блок обусловлены механическим (фиброз, воспаление) и динамическим компонентами [4]. Важный компонент сосудистого сопротивления – динамический, регулирующийся комплексом связей между поврежденными гепатоцитами, синусоидальными эндотелиальными клетками, звездчатыми клетками печени (ЗКП) и клетками Купфера, влияющими на диаметр синусоидов [3]. На ранних стадиях заболевания такие нарушения составляют основной компонент процесса нарастания патологии. Но и на завершающей, цирротической, стадии заболевания их вклад в развитие осложнений остается значительным – на уровне 20–30% [4]. Динамический компонент повышения сосудистого сопротивления (дисфункция эндотелия, активация ЗКП, клеток Купфера и множество дополнительных недостаточно изученных факторов) формируется еще на ранних, доцирротических, стадиях ХЗП, приводя, вероятно, к нарушению внутрипеченочной гемодинамики [5, 6]. А нарушение портопеченочной гемодинамики обусловливает изменение морфофункционального печеночного континуума –
нарушение регенерации, метаболизма гепатоцитов, прогрессирование фиброза печени. Ряд исследователей считают, что именно гемодинамическим расстройствам принадлежит ведущая роль в патогенезе заболеваний печени и развития осложнений [5, 7, 8]. Нарушения внутрипеченочного кровотока провоцируют патологические изменения морфофункционального состояния печени, что усугубляется уже механическим сдавливанием кровеносных сосудов в результате развития воспаления и фиброза [9]. Поэтому выявление нарушений внутрипеченочного кровотока, изучение их механизмов еще на ранних стадиях формирования фиброза – фундаментальные и актуальные направления современной гепатологии. Неоднородность патогенетических гемодинамических расстройств, возникающих при формировании ПГ, требует дифференцированного подхода, учитывающего специфику выявляемых расстройств [10]. Своевременная коррекция портопеченочной гемодинамики может иметь большое профилактическое значение в развитии необратимых, угрожающих жизни осложнений ХЗП [11]. Однако указанное направление существенно сдерживается из-за отсутствия доступных методик оценки внутрипеченочной гемодинамики [12]. Поэтому сохраняется актуальность разработки методов диагностики, а также оптимизации терапии основных осложнений ХЗП, связанных с перестройкой портопеченочной гемодинамики, формирующейся еще на начальных стадиях формирования фиброза.
Локальные механизмы регуляции внутрипеченочного кровотока
Начнем с того, что печень – это орган с развитой сосудистой сетью, которой принадлежит важная роль в патогенезе многих заболеваний печени. Площадь сосудистого эндотелия в организме составляет 900 м2, в печени – 400 м2, что соответствует площади двух теннисных кортов(!), а длина монослоя эндотелиальных клеток превышает 7 км [13]. Приток крови к печени обеспечивается воротной веной (2/3 потока крови) и печеночной артерией (1/3 потока крови), в синусоидах эта кровь перемешивается. Однако необходимый градиент давления между воротной и печеночной венами небольшой и кровоток обеспечивается благодаря механизму артериовенозной инжекции. Данный механизм заключается в том, что артериальная кровь, протекая под большим давлением, как бы «подхватывает» венозную кровь, обеспечивая достаточный приток крови к печени. Отток крови через печеночную вену существенно зависит от «присасывающего» действия дыхания, обеспечиваемого движением диафрагмы. Снижение на вдохе внутригрудного давления увеличивает системный венозный возврат и объем правого желудочка [14]. Еще на рисунках Леонардо да Винчи по анатомии человека было показано, что сердце как бы «высасывает» кровь из печени.
Какие же механизмы обеспечивают нормальную портопеченочную гемодинамику на микроциркуляторном уровне печени? Обсуждаются роль эндотелия, нормальное равновесие между вазоспастическими и вазодилатирующими факторами, адекватная продукция оксида азота (NO), значение клеток Купфера, ЗКП, находящихся в спокойном неактивированном состоянии и др.
Звездчатые клетки печени и печеночный кровоток
ЗКП руководят многими важными функциями в печени, также обеспечивают колебания внутриорганного и внутрисосудистого давления в пределах 5–25 мм вод.ст. от 3 до 20 раз в минуту по принципу ритмогенного аппарата сердечного синусового узла в режиме собственного печеночного автоматизма [15]. Активация и последующая дисфункция ЗКП связаны со многими осложнениями, включая печеночный фиброз, ПГ и рак печени [16, 17]. При ХЗП под воздействием провоспалительных цитокинов, оксидативного стресса наблюдается активация ЗКП: теряются жировые включения, липоцит постепенно превращается в фибробласт, увеличивается контрактильность клетки. В ходе острого или хронического повреждения печени ЗКП проходят фенотипическую трансформацию от «неактивных» (непролиферирующих и несокращающихся) до «активированных» профиброгенных и провоспалительных миофибробластоподобных клеток, способствуя прогрессированию фиброза печени [18–21]. Более того, в процессе активации повышается контрактильность ЗКП и развивается соответствующий аппарат для сокращения и расслабления в ответ на ряд вазоактивных веществ-стимулов [19, 20, 22]. Активация ЗКП происходит при воздействии эндотелина, норадреналина, ангиотензина 2, лейкотриена, тромбоксана А2 [23]. В 2016 г. в исследовании английских авторов [24] было показано, что активация ЗКП индуцируется также аммиаком, уровень которого часто повышен не только при циррозе, но и на доцирротической стадии гепатита [25]. Результаты исследования английских коллег продемонстрировали, что аммиак оказывает пагубные морфологические и функциональные воздействия на ЗКП in vitro, патофизиологические концентрации аммиака были ассоциированы с выраженными структурными изменениями и модуляцией ЗКП: контрактильностью, повышением уровней маркеров активации ЗКП (α-SMA, миозин IIa, IIb, PDGF-Rβ). Было показано, что ЗКП в эксперименте экспрессируют глутамин-синтетазу и избыточный аммиак, что может производить пагубное действие на активность и функционирование человеческих ЗКП по аналогии с астроцитами. Это не было связано с каким-либо доказательством клеточной гибели, эти эффекты были обратимыми, и при удалении аммиака in vitro или при снижении аммиака in vivo биология ЗКП восстанавливалась. Следовательно, подтверждается утверждение об обратимости аммиак-индуцированной дисфункции ЗКП. Кроме того, есть данные, что аммиак самостоятельно может инициировать каскад патологических событий, таких как оксидативный стресс, приводящий к окислению РНК, и нитрозативный стресс, ведущий к азотизации ключевых белков и опять же активации ЗКП [26]. Было показано, что снижение концентрации аммиака в клинически значимой экспериментальной модели цирроза на крысах с использованием L-орнитин фенилацетата, лекарственного препарата для лечения гипераммониемии и печеночной энцефалопатии, приводило к деактивации ЗКП, снижению портального давления и повышению активности печеночной эндотелиальной синтазы NO (eNOS) in vivo. Это улучшение портального давления было ассоциировано со снижением уровней маркеров оксидативного и нитрозативного стрессов, таких как индуцибельная синтаза NO (iNOS) и 5-нитротирозин, и индукцией ферментативной активности eNOS. Это предполагает, что аммиак является возможной целью для терапии и оправдывает клиническое испытание препарата, снижающего уровень аммиака, ПГ [24]. Другие авторы показали действие данного препарата в плане повышения активности eNOS в головном мозге [27]. Поэтому применение гипоаммониемических средств при ХЗП получило новое обоснование.

Нитроксидергическая система и печеночный кровоток
В патогенезе хронического гепатита и прогрессировании в цирроз большое значение имеет нарушение портопеченочной гемодинамики, что может быть связано с повреждением эндотелия синусоидов и дисфункции эндотелия. Механизмы данных процессов нуждаются в дальнейшем изучении [5]. С открытием молекулы NО возникло новое направление – биология NО, эндотелиальная функция. Это не только имеет теоретическое значение, но и может иметь большое практическое значение для медицины, гепатологии, в частности, NO выполняет различные функции в организме, которые включают клеточные сигналы, антимикробное действие, регуляцию сосудистого тонуса, антиоксидантные свойства и др. Важно, что NО способствует релаксации ЗКП, тормозит пролиферацию коллагена, являясь противофиброзной молекулой [23, 28]. NO и синтазы NО (нитроксидергическая система) в физиологических концентрациях служат важным фактором регуляции печеночного кровотока [29]. NO образуется преимущественно при помощи ферментов iNOS и eNOS в печени и является важной детерминантой тонуса кровеносных сосудов и кровоснабжения печени.
В основе эндотелиальной дисфункции (ЭД), которая возникает еще до развития воспаления и фиброза печени, лежит снижение синтеза NO в эндотелии [30]. Выявлена связь нарушений портальной и центральной гемодинамики с такими маркерами ЭД, как эндотелин и NO при ХЗП, более выраженной при циррозе [12, 31–33].Существует мнение, будто регуляторная функция NO проявляется при его нормальных концентрациях, при больших концентрациях проявляется цитотоксическое действие, т.е. NО может обладать как протекторными, так и повреждающими свойствами в зависимости от концентрации. Предполагается, что eNOS и iNOS играют разные роли в развитии ХЗП [34].Снижение экспрессии и/или активности еNOS (при активации ингибиторов синтаз) приводит к снижению продукции NО в синусоидах, развивается вазоконстрикция, повышение внутрипеченочного сосудистого сопротивления и, возможно, снижение кровотока в печени [29, 35], что может способствовать фиброзу печени [37]. Авторы показали, что экспрессия еNOS снижена в модели фиброза у мышей, вызванного ССl4 в эксперименте, при этом донатор NО (L-аргинин) снижал развитие фиброза, поддерживая еNOS на постоянном уровне, индуцируя синтез NО в синусоидном эндотелии, поддерживая нормальный кровоток.
Динамический компонент повышения сосудистого сопротивления в печени может быть обратимым и модифицируемым (дисфункция эндотелия, контрактильность миофибробластов, перицитов) [36, 38].С одной стороны, дисбаланс между NО и эндотелином в пользу последнего приводит к активации ЗКП и фиброгенезу [39], сужению синусоидов, а активированные ЗКП в свою очередь сами продуцируют эндотелин-1 [23, 31, 40]. С другой стороны, с началом индукции iNOS при воспалительном процессе продуцируется повышенное количество NO, который является одним из маркеров воспалительного ответа и выявляется при ХЗП [41–44]. iNOS продуцируется в активированных макрофагах под действием цитокинов, aктивация iNOS способствует образованию высокой концентрации NО, которая приводит к инициации перекисного окисления липидов (ПОЛ), оксидативному стрессу и повреждению клеток печени [45–47]. Кроме того, повышение уровня NO в плазме у пациентов с ХЗП определяет становление системной вазодилатации и формирование гиперкинетического типа гемодинамики [32, 48]. Хотя другими авторами показано, что при ХЗП уровень NO снижен в плазме крови [5]. ЭД (нарушение активности NOSe, NO в синусоидах, повышение в спланхнической циркуляции) ведет к повышению внутрипеченочного сопротивления и ПГ [38,49]. Таким образом, нитроксидергическая система принимает участие в развитии сложных гемодинамических расстройств, ангиогенезе, дальнейшем сосудистом ремоделировании печени и фиброгенезе [50]. Вопрос о том, влияет ли NO благотворно или негативно при ХЗП, остается открытым. Данные о роли нитрооксидергической системы при ХЗП противоречивы, до конца не ясны, работы в основном носят экспериментальный характер. Нормальная сохранная микроциркуляция в печени имеет большое значение, обеспечивая нормальную функцию гепатоцитов, регенерацию клеток, сохраняя структуру органа. Расстройство внутрипеченочного кровотока и развитие фиброза печени – единый патогенетический процесс [4]. В настоящее время данное напрaвление существенно сдерживается из-за отсутствия методики оценки внутрипеченочной микроциркуляции [12, 36]. Понимание механизмов расстройства внутрипеченочной гемодинамики поможет оптимизации патогенетической терапии ХЗП еще на доцирротической стадии ХЗП, до формирования и прогрессирования ПГ.
Однако лечение разработано только для ПГ:
а) модификация структурных аномалий посредством специфического лечения (противовирусное и пр.);
б) обсуждается коррекция динамического компонента повышения внутрипеченочного сопротивления (ингибиторы ангиотензинпревращающего фермента, антиоксиданты, селективные NO-доноры, аргинин, статины как добрые кандидаты для лечения дисфункции эндотелия при циррозе, способствующие вазодилатации за счет улучшения функции eNOS) [51];
в) уменьшение спланхнического гипердинамического синдрома – неселективные β-адреноблокаторы, нитраты, сорафениб (ингибитор мультикиназ).
А как быть на ранних стадиях нарушений внутрипеченочной гемодинамики, при которых динамический компонент повышения сосудистого сопротивления в печени может быть обратимым и модифицируемым на фоне коррекции дисфункция эндотелия, деактивации ЗКП [36, 38]?
Актуальные направления в данной проблеме:
- Ранняя неинвазивная диагностика нарушений внутрипеченочного кровотока как основного предиктора развития ПГ у больных ХЗП с начальными стадиями фиброза. «…Направление существенно сдерживается из-за отсутствия доступной методики по оценке состояния портопеченочной гемодинамики...» [36].
- Дальнейшее изучение механизмов формирования динамического компонента повышения сосудистого сопротивления у больных ХЗП (состояние нитрооксидергической системы, активности ЗКП и клеток Купфера) на ранних стадиях хронического гепатита.
- Разработка фармакологических методов коррекции подобных нарушений.
Задачи настоящего исследования:
- изучить особенности нарушений портопеченочной гемодинамики у пациентов с ХЗП с начальным фиброзом печени;
- исследовать функциональное состояние эндотелия с помощью окклюзионного стресс-теста;
- оценить состояние нитрооксидергической системы: содержание конечных стабильных метаболитов NO в крови и характер экспрессии i-NOS и e-NOS в ткани печени;
- изучить взаимосвязи состояния нитрооксидергической системы, некровоспалительного процесса в печени, оксидативного стресса (ПОЛ);
- разработать методы коррекции нарушений портопеченочной гемодинамики.
Материал и методы
Обследованы 97 пациентов хроническими вирусными гепатитами В (n=31) и С (n=66), преимущественно в репликативной фазе, 30 пациентов с алкогольным стеатогепатитом (АСГ) и неалкогольным стеатогепатитом (НАСГ), с начальным фиброзом печени 0–1 стадии.
Критерии исключения: возраст старше 35 лет, фиброз печени 2–4-й стадий, ВИЧ-инфекция, наркомания, курение, сопутствующая патология, влияющая на печеночный кровоток.
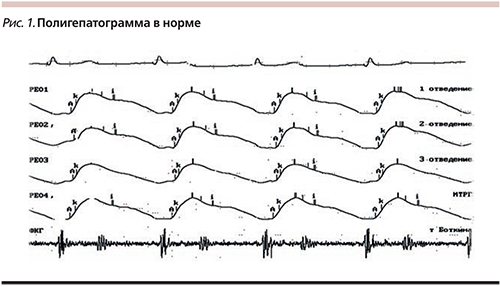
Всем больным провели клинико-биохимические анализы; вирусологические анализы, включая серологические и молекулярно-генетические методы; исследование оксидантной системы ПОЛ (диеновые конъюгаты – ДК); определение метаболитов NO в периферической крови по Гриссу; полигепатографию (ПГГ) – неинвазивный метод (модифицированная импедансометрия печени для интегральной оценки нарушений портопеченочной гемодинамики, внутрипеченочного кровотока и оценки фиброза печени). ПГГ интегрально регистрирует кровоток в зоне проекции правой, левой долей печени, селезенки, тела (всего 4 отведения) (рис. 1), одновременно проводится электро- и фонокардиография. ПГГ включает также функциональные тесты вазодилатации с нитратами и глубоким дыханием. Для определения уровня гемодинамического блока чувствительность метода составляет 92%, специфичность – 93%, в определении признаков ПГ – 92 и 93% соответственно [7, 52]. По методике получено 10 патентов РФ. Основные направления анализа полигепатограмм: величина базового сопротивления, которая характеризует кровенаполнение печени, амплитуда пульсовых волн кровенаполнения характеризует эластичность сосудистого русла, форма волн кровенаполнения в области печени – локализацию гемодинамического блока, функциональные пробы с нитроглицерином и глубоким дыханием характеризуют функциональность данных нарушений. Оценка функции эндотелия проводилась с использованием метода периферической артериальной тонометрии (ПАТ) с помощью аппаратно-программного комплекса Еndo-PAT 2000, разработчик «Itamar Medical Ltd». Данный метод рекомендован международными экспертами для неинвазивной оценки ЭД и имеет хорошую доказательную базу (www.itamar-medical.com). О наличии ЭД судили при индексе реактивной гиперемии (RHI) менее 1,67. Проводилась биопсия печени (25 пациентов) с определением стадии фиброза, индекса гистологической активности (ИГА), экспрессии синтаз NO iNOS, eNOS методом иммуногистохимии (NVision) с использованием для визуализации оптической плотной метки диаминобензидин. В отсутствие биопсии проводили эластографию печени. Было проведено ультразвуковое исследование органов брюшной полости.
В плане коррекции нарушений портопеченочной гемодинамики использовали препараты и методы, регулирующие печеночный кровоток: нитропрепараты, упражнения на диафрагмальное дыхание. С учетом многочисленных экспериментальных данных по эффективности донатора NO L-аргинина и гипоаммониемического препарата L-орнитина фенилацетата для коррекции нарушений печеночного кровотока и ПГ в исследовании решили использовать L-орнитин-L-аспартат (Гепа-Мерц).
Результаты исследования
ПГГ выполнена 127 пациентам с ХЗП с начальным фиброзом печени, преимущественно 0–1 стадии. Нарушения портопеченочной гемодинамики выявлены у всех(!) пациентов с ХЗП в виде нарушений формы и амплитуды кривых на фоне снижения кровенаполнения печени, повышения базового сопротивления (рис. 2, 3). У некоторых больных при фиброзе 0 стадии гемодинамические нарушения исчезали во время функциональных проб с диафрагмальным дыханием и нитратами. Изменение формы кривых ПГГ позволило определить локализацию гемодинамических нарушений в микроциркуляторной системе печени. У пациентов с хроническими вирусными гепатитами (ХВГ) В и С выявлены нарушения портопеченочной гемодинамики на пресинусоидальном уровне (нарушение притока), в группе пациентов АСГ и НАСГ тип нарушений гемодинамики соответствовал сниженному венозному оттоку. Вазорегулирующую функцию эндотелия оценивали по методу периферической артериальной тонометрии с использованием Endо-РАТ 2000 в группе пациентов с ХВГ. Индекс RHI в среднем оказался снижен и составил 1,43 (пороговая величина – 1,67). Содержание метаболитов NO было достоверно повышено в сыворотке крови у пациентов с ХВГ: 5,80±0,31 (ХВГ С), 7,13±0,65 (ХВГ В), 6,46±0,52 (ХВГ С+ХВГ В), 4,21±0,45 (контроль). Оценка ПОЛ (ДК) выявила достоверное повышение: в основной группе – 4,77±0,40 (ХВГ С+ХВГ В), в контрольной – 3,54±0,47. Выявлена слабая корреляция между повышением уровня метаболитов NO и ПОЛ (рис. 4) – экспрессия iNOS в непаренхиматозных клетках печени. Концентрация iNOS-положительных клеток (%): при ХВГ С в базолатеральных зонах составила 3,78±0,51, в центральных – 3,9±0,63, в портальных зонах – 5,58±0,97, при ХВГ В экспрессия iNOS оказалась достоверно выше: в базолатеральных зонах составила 5,82±0,79, центролобулярных – 5,41±0,83, портальных – 10,28±1,89. Как видно из представленных данных, экспрессия iNOS была выше в портальных зонах, что соответствует локализации основного воспалительного процесса при вирусных гепатитах (рис. 5), причем у пациентов с ИГА 9–12 баллов концентрация iNOS выше. Концентрация eNOS-положительных непаренхиматозных клеток (%) в ткани печени была недостаточной: при ХВГ С в базолатеральной зоне составила 59,27±2,98, в центральной – 62,58±2,67, в портальной – 56,61 ± 2,6; при гепатите В в базолатеральной зоне – 57,46±2,76, в центральной – 60,11±2,68, в портальной – 59,06±3,16 (рис. 6). Достоверных отличий по eNOS между различными зонами синусоида и между гепатитами В и С не получено. Анализ эффективности различных препаратов для коррекции нарушений портопеченочной гемодинамики показал, что нитраты были более эффективными для пациентов с пресинусоидальным типом нарушений кровотока (при вирусных гепатитах) за счет улучшения венозного притока. В то же время упражнения на диафрагмальное дыхание приводили к улучшению венозного оттока при стеатогепатитах, L-орнитин-L-аспартат улучшал показатели внутрипеченочного кровотока у пациентов с различными типами нарушений портопеченочной гемодинамики (патент № 2286773) [55] (рис. 7).
Заключение
У всех больных ХЗП c фиброзом 0–1 стадии методом ПГГ выявлены нарушения портопеченочной гемодинамики, при ХВГ В и С – преимущественно на пресинусоидальном уровне (нарушение притока), при АСГ и НАСГ – преимущественно на синусоидальном уровне (нарушение оттока). Гемодинамические нарушения были представлены начальными изменениями, у больных ХЗП с фиброзом 0 стадии носили динамический характер, что определялось на фоне функциональных тестов с глубоким дыханием и нитратами. Полученные данные свидетельствуют о том, что уже на ранних стадиях ХЗП формируются нарушения внутрипеченочной микроциркуляции различной локализации в зависимости от этиологии заболевания печени. У больных ХЗП выявлены признаки дисфункции эндотелия: нарушение эндотелийзависимой вазодилатации, повышение метаболитов NO в периферической крови, нарушение экспрессии синтаз NO в ткани печени (снижение экспрессии eNOS и появление iNOS). Данные результаты свидетельствуют о функциональной неоднородности эндотелия при ХЗП: снижение экспрессии еNOS в синусоидальном эндотелии печени приводит к уменьшению продукции NO и нарушению микроциркуляции в печени, а появление iNOS в ткани печени и повышение продукции NO, вероятнее всего, необходимо трактовать как провоспалительный эффект. Провоспалительный эффект в данном случае также подтверждается положительной корреляцией повышения уровня NO и ПОЛ. Кроме того, концентрация iNOS у пациентов с вирусными гепатитами была выше в перипортальной зоне, что соответствует локализации воспаления при данной патологии. Эти данные подтверждают предположение, будто iNOS появляется в печени при патологии и генерирует множество NO, который в больших концентрациях обладает цитотоксичностью в основном за счет образования пероксинитрита. Данное исследование подтверждает выводы экспериментальных исследований по изучению роли синтаз в патогенезе заболеваний печени.
Наше исследование показало, что для коррекции пресинусоидального гемодинамического блока у пациентов с ХВГ были эффективны нитраты, у пациентов с синусоидальным типом нарушений гемодинамики (при нарушении оттока) – упражнения на диафрагмальное дыхание.
У всех пациентов с различным типом гемодинамики L-орнитин-L-аспартат (Гепа-Мерц) улучшал портопеченочный кровоток. Прежде всего орнитин и аспартат – это субстрат для синтеза аргинина, который образуется в процессе орнитинового цикла Кребса и является донатором NO [13, 53]. L-орнитин-L-аспартат – активный вазоактивный препарат, за счет стимуляции синтеза аргинина увеличивает продукцию NO, улучшая кровоток во многих органах (печень, мышцы, головной мозг, поджелудочная железа) [54, 55]. Кроме того, L-орнитин-L-аспартат снижает уровень аммиака в крови и за счет этого, вероятно, происходит деактивация ЗКП, снижение их контрактильности и улучшение печеночного кровотока. Действительно, существуют данные, согласно которым L-орнитин фенилацетат (гипоаммониемическое средство), снижая уровень аммиака в крови, уменьшал признаки активации ЗКП, повышал уровень eNOS в печени, улучшал печеночную микроциркуляцию в эксперименте in vivo [24]. Необходимо отметить, что деактивация ЗКП, активация еNOS и продукции NО приводят к торможению фиброгенеза. Немаловажно и то, что данный препарат обладает известными т.н. гепатопротективными свойствами: улучшает энергетические процессы за счет повышения АТФ в гепатоците, синтез белка, регенерацию клеток печени [13, 56, 57]. С учетом этих свойств L-орнитин-L-аспартат имеет большой потенциал для более широкого применения при ХЗП различной этиологии. Таким образом, раннее выявление и дифференцированная коррекция нарушений портопеченочного кровотока сужит важным фактором оптимизации патогенетической терапии ХЗП в плане сохранения морфофункционального континуума в печени и замедления фиброгенеза.



