Интерфероны (ИФН) были открыты и описаны как гетерогенный класс растворимых гликопротеинов, обладающих сильной противовирусной активностью, почти 60 лет назад (в 1957 г.) в работах A. Айзекса, Дж. Линдеманна и Р. Валентайна [1, 2].
Результаты системных биологических исследований ИФН, выполненных в течение последних двух десятилетий, привели к пониманию, что ИФН представляют собой большое семейство регуляторных сигнальных гормоноподобных белков, обладающих плейотропным действием [3].
В настоящее время показана сложная генетическая и регуляторная организация системы ИФН у человека, включающая наличие трех типов ИФН. Для каждого типа ИФН в клетке имеются генетически детерминированные высокоспецифические клеточные рецепторы. Современная классификация основана на наличии у человека специфических клеточных мембранных рецепторов для каждого типа ИФН (I, II и III), а именно: ИФН I типа (кодируются генами, экспрессия которых приводит к синтезу молекул, относящихся к пяти субтипам: ИФН-α – 14 изоформ, 13 функциональных генов, локализованных в хромосоме 9, ИФН-β – хромосома 9, ИФН-κ – хромосома 9, ИФН-ε – хромосома 9, ИФН-ω – 1 функциональный ген IFNW1 и несколько псевдогенов – IFNWP2, IFNWP4, IFNWP5, IFNWP9, IFNWP15, IFNWP18, IFNWP19, локализованных в хромосоме 9) [4–15], ИФН II типа (единственный представитель – ИФН-γ, ген ИФН-γ локализован в хромосоме 12) [16–22] и ИФН III типа (ИФН-γ1, ИФН-γ2 и ИФН-γ3, известные также как интерлейкин-29 – ИЛ-29, ИЛ-28А, ИЛ-28В), соответственно, гены ИФН III типа локализованы в хромосоме 19 [23–31].
ИФН воздействуют, хотя и дифференцированно, на большинство клеток организма, экспрессирующих специфические рецепторы. Связывание молекулы ИФН со специфическим клеточным рецептором приводит к активации множественных сигнальных путей и трансдукции сигналов, приводящих к транскрипционной активации в клетках организма многочисленных ИФН-регулируемых (или стимулируемых) генов. В международной on-line-базе данных INTERFEROME v. 2.0 аннотировано более 2000 ИФН-регулируемых (или стимулируемых) генов (IRGs), из них более 380 генов протестированы на антивирусную активность [32–35].
ИФН оказывают многообразное воздействие на клетки, включая антивирусное защитное действие [36, 37], модуляцию роста, дифференцировку, пролиферацию, выживание, апоптоз и подвижность [38].
В системе естественного и адаптивного иммунитета эти базовые свойства приводят к способности ИФН регулировать развитие и активность большинства эффекторных клеток иммунной системы. Вследствие этого ИФН рассматриваются как первичные сигнальные молекулы, действие которых направлено на сохранение и поддержание гомеостаза и на противодействие патологическим процессам. ИФН как ранние цитокины системы естественного иммунитета вовлечены в процессы ответа организма на инфекцию, воспаление, онкотрансформацию клетки и другие локальные и системные нарушения в клетках и организме в целом.
Наиболее хорошо изучены ИФН I типа (ИФН-α, ИФН-β) и ИФН II типа (ИФН-γ). Многие виды клеток продуцируют ИФН I типа, среди которых макрофаги, миелоидные дендритные клетки (ДК), фибробласты, эпителиальные клетки, но плазмоцитоидные дендритные клетки секретируют в больших количествах ИФН I типа (ИФН-α и ИФН-β), являясь основными ИФН-продуцирующими клетками в ответ на вирусную инфекцию [39–42].
ИФН I типа массово продуцируются в большинстве типов клеток в ответ на вирусные и другие микробные инфекции и играют жизненно важную роль в процессах реализации реакций естественного врожденного иммунитета организма против широкого спектра вирусов через индукцию противовирусных эффектов как непосредственно, так и опосредованно. Быстро и немедленно реагирующая сигнальная система ИФН, запускающая индукцию многочисленных антивирусных генов, является выработанным в процессе эволюции грозным естественным барьером против размножения вирусов для защиты популяций интактных клеток зараженного вирусом организма, переводя клетки в т.н. антивирусное состояние повышенной готовности к ответу на инфекцию [43–47].
Механизмы противовирусного действия ИФН представляют собой сложный многофакторный комплекс ИФН-индуцируемых/стимулируемых защитных реакций клетки, ограничивающих рост вируса на уровнях проникновения, раздевания, синтеза, процессинга и лизиса вирусных иРНК, репликации вирусных РНК и ДНК, синтеза клеточных и вирусных белков и сборки вирусного потомства. То есть ИФН-индуцируемые эффекторы нацелены и способны воздействовать на многочисленные стадии жизненного цикла вирусов [32, 36, 37, 48–50].
Что касается опосредованной роли в процессах противовирусной защиты, ИФН I типа также обладают иммуномодулирующим эффектом за счет активации естественных киллеров (NK-клетки), макрофагов и ДК, т.е. клеток, являющихся неотъемлемыми эффекторными клетками системы врожденного иммунитета. ИФН I типа и ИФН-индуцируемые белки оказывают потенцирующее влияние на созревание ДК, являющихся одними из основных антигенпрезентирующих клеток, и в настоящее время ИФН I типа признаются в качестве ключевых цитокинов, играющих роль связующего звена между врожденной и адаптивной иммунной системами, координированное взаимодействие которых необходимо для формирования эффективного и сбалансированного гуморального и клеточного иммунного ответа организма на инфекционные агенты [51–55].
Исследования в области биологии ИФН I типа – этих ключевых цитокинов, также способствовали лучшему пониманию важной физиологической роли выявленного наличия слабых сигналов со стороны конституитивно продуцируемых в организме низких пороговых уровней ИФН I в отсутствие вирусной инфекции в модификации клеточной реактивности в иммунной и других биологических системах организма. Действительно, показано, что наличие слабых сигналов со стороны ИФН-α и ИФН-β, продуцируемых конституитивно на пороговом уровне, является критически важным фактором для реализации повышенной готовности клеток организма в отношении способности к незамедлительному ответу на внезапную инфекцию путем массированной амплификации индукции ИФН I типа, ИФН-регулируемых антивирусных белков, других цитокинов и осуществления положительных регулирующих функций в системе адаптивного иммунного ответа, в частности такой, как активация и пролиферация CD8 Т-клеток [55–60].
Поэтому слабый сигнал от конституитивно продуцируемых в организме молекул ИФН I типа обеспечивает поддержание готовности и способности клеток к внезапной необходимости повышения клеточных реакций на быстрые изменения окружающей среды, таких, например, как вирусные инфекции. По механической аналогии это явление можно сравнить с работой двигателя автомобиля на холостом ходу, готового к старту, что позволяет незамедлительно начать движение и ускорение, а образно – этот механизм можно назвать «системой контроля оборотов», которая в клеточных системах с помощью слабого сигнала ИФН I типа участвует в процессе индукции надежных клеточных реакций против вирусных инфекций различной этиологии. Поэтому оно может рассматриваться как уникальный физиологический механизм регулирования усиления клеточного реагирования для реализации процессов естественной защиты организма [55, 60].
Вышеописанные различные свойства ИФН привели к обширным исследованиям их терапевтического потенциала, и в настоящее время ИФН (главным образом, высокодозированные человеческие рекомбинантные ИФН) используются для лечения тяжелых хронических вирусных инфекций (например, вирусные гепатиты С и В), некоторых видов рака и рассеянного склероза. Введение рекомбинантных ИФН также имеет побочные эффекты, связанные с дозозависимой токсичностью. В результате существует значительный интерес исследователей к пониманию процессов регулирования индукции и сигнализации ИФН [61–65].
Вклад отечественных ученых в развитие проблемы ИФН значителен. Первыми отечественными монографиями, посвященными ИФН, были книги Ф.И. Ершова и А.С. Новохатского «Интерферон и его индукторы» (1980), В.Д. Соловьева и Т.А. Бектемирова «Интерфероны в теории и практике медицины» (1981) [66, 67]. Именно российским ученым принадлежит приоритет широкомасштабного клинического использования ИФН и их индукторов для лечения и профилактики гриппа, острых респираторных вирусных инфекций (ОРВИ), лечения вирусных гепатитов, герпеса, цитомегаловирусной и ряда других вирусных инфекций [68–72].
При большинстве вирусных инфекций имеет место снижение уровня естественного врожденного иммунитета. Это снижение может быть как связано с неблагоприятными внешними воздействиями на организм (переохлаждение, стрессы, нарушение питания, сна и т.п.), так и обусловлено выраженной иммуносупрессирующей активностью многих патогенных вирусов, включая все респираторные вирусы (ортомиксовирусы: вирусы гриппа; парамиксовирусы: вирусы парагриппа, респираторно-синцитиальный вирус, метапневмовирус; коронавирусы; аденовирусы; пикорнавирусы: риновирусы; парвовирусы: парвовирусы и бокавирусы человека), ключевым звеном патогенеза которых является подавление системы ИФН на самых ранних стадиях развития инфекции [68, 69, 73–106]. Пионерскими в этом направлении стали опубликованные еще в 1968–1969 гг. результаты исследований В.Д. Соловьева и соавт. [107–109], в которых было показано снижение продукции ИФН в первые 2 дня болезни у пациентов с гриппом, а также значимые различия продукции ИФН у здоровых детей и у детей с ОРВИ и энтеровирусными инфекциями, выразившиеся в значительном снижении способности лейкоцитов от больных детей к индукции и продукции ИФН вплоть до 2–3-го дня болезни. В последующем опубликованные наблюдения В.Д. Соловьева и соавт. нашли подтверждение в ряде опубликованных зарубежных клинических исследований детей с острыми и особенно с рецидивирующими респираторными вирусными инфекциями («часто болеющие дети» – ЧБД), в которых было выявлено значительное снижение способности к индукции/продукции ИФН I типа в ответ на вирусную инфекцию [110–121]. Дефект продукции ИФН у детей с рецидивирующими респираторными инфекциями носит транзиторный характер и является индуктор-специфичным, он не связан с врожденными генетическими дефектами системы естественного иммунитета. Поскольку ИФН-статус может возвращаться к норме, в т.ч. при использовании ИФН-замещающей терапии [113, 115, 118], большинство авторов склоняются к точке зрения, согласно которой выявленные нарушения ИФН-статуса у ЧБД в отсутствие врожденных нарушений иммунной системы можно рассматривать как проявления приобретенной иммуносупрессии, носящие комплексный характер, связанный с иммуномодуляцией вследствие повторяющихся эпизодов вирусной инфекции, особенно в раннем возрасте в период созревания иммунной системы.
Также в этом отношении может представлять интерес проблема этиологической взаимосвязи перенесенных ОРВИ (особенно в раннем детском возрасте) с последующим развитием бронхиальной астмы (БА). За последнее десятилетие опубликованы многочисленные работы, подтверждающие связь ОРВИ со значительно повышенным риском возникновения БА у детей. В опубликованных исследованиях представлены доказательства, указывающие на наличие нарушений в системе естественного врожденного противовирусного иммунитета, выражающихся в сниженной способности клеток дыхательных путей у пациентов с астмой к индукции ИФН I и III типов в ответ на респираторную вирусную инфекцию [122–142]. Несмотря на то что до сих пор не вполне ясна причинно-следственная связь между вирусными респираторными инфекциями и сниженной способностью пациентов с астмой к индукции ИФН в ответ на вирусную инфекцию, в публикациях обсуждается наличие явной обратной отрицательной регуляторной петли y пациентов с атопическими проявлениями, в результате чего отсутствие или значительное снижение секреции ИФН-α/ИФН-β в системе врожденного естественного иммунитета в ответ на вирусную инфекцию способствует развитию аллергических Th2-клеток [143–147]. Кроме того, известна роль ИФН I типа (ИФН-α/ИФН-β) в подавлении аллергических воспалительных процессов путем блокировки активации гранулоцитов и ИЛ-4-опосредованного переключения В-клеток на продукцию изотипа иммуноглобулина Е (IgE). Эти данные свидетельствуют в пользу модели, согласно которой аллергические и ранние противовирусные реакции системы врожденного естественного иммунитета способны перекрестно регулировать друг друга [148]. В поддержку этой модели также приводятся имеющиеся данные клинических наблюдений и экспериментальных исследований относительно терапевтического потенциала ИФН I типа в отношении блокирования аллергических воспалительных процессов, в т.ч. при астме [148–159].
Несмотря на текущее относительное отсутствие надежных обобщающих данных иммуно- и эпигенетических эпидемиологических, иммунологических и вирусологических исследований, направленных на выявление критически важных защитных путей и механизмов патогенеза рецидивирующих респираторных вирусных инфекций у детей, приводящих к нарушениям ранних цитокиновых противовирусных защитных реакций и как следствие – к транзиторной иммуносупрессии, замедленной элиминации вирусов, повышенной восприимчивости к повторным вирусным респираторным инфекциям, дисбалансу Th1/Th2 цитокинового ответа, развитию хронического воспаления эпителия дыхательных путей и запуску патогенетических механизмов развития аллергии и БА. Нельзя не отметить ключевую роль выявленных нарушений в системе ИФН, которые, как полагают, могут лежать в основе патогенеза этих процессов. Восстановление «работоспособности» системы ИФН в организме является одним из важнейших условий ее эффективной защиты как от респираторных вирусных инфекций, так и от возможных проявлений иммунной дисрегуляции в клетках эпителия дыхательных путей по Th2-типу, запускающих патологические процессы, приводящие к астме и аллергии.
В связи с комплексностью процессов регуляции системы ИФН и их плейо-тропном участии в процессах поддержания биологического гомеостаза и модуляции многочисленных звеньев защитных иммунных реакций организма научным сообществом до сих пор окончательно не решены вопросы клинической значимости как отдельных величин, так и интегративных показателей системы ИФН в норме и при патологии (т.н. интерфероновый статус). Определенный приоритет во внедрение понятия «интерфероновый статус» и методических подходов к его определению принадлежит отечественным ученым [160–171]. Наиболее подробно вопросы интерферонового статуса в норме и при патологии обобщены в главе 9 монографии Ф.И. Ершова и О.И. Киселева «Интерфероны и их индукторы (от молекул до лекарств)» [68]. В основу оценки интерферонового статуса положено определение трех основных параметров: циркулирующих в крови (сывороточных) ИФН; интерфероновой реакции лейкоцитов (уровень продукции ИФН-α в ответ на обработку вирусными индукторами in vitro); уровня продукции ИФН-γ в ответ на обработку лимфоцитов митогенами. Наиболее частым типом нарушений интерферонового статуса, в частности, при ОРВИ является различная степень повышения титров циркулирующего ИФН с одновременным подавлением интерферониндуцирующей способности иммуноцитов. При хронических (рецидивирующих) респираторных вирусных инфекциях, как правило, выявляется глубокое подавление интерфероногенеза, при этом фоновые показатели сывороточного ИФН сочетаются с резко подавленной способностью иммуноцитов к индукции ИФН-α и ИФН-γ.

Острые и рецидивирующие вирусные инфекции дыхательных путей у детей во всем мире представляет серьезную проблему как в отношении терапевтических подходов к лечению и профилактике, так и в плане социально-экономических последствий высокого уровня заболеваемости [172–176].
По данным Всемирной организации здравоохранения (ВОЗ), от ОРВИ погибают приблизительно 3,9 млн человек в год. Респираторные инфекции являются одной из пяти основных причин смертности во всем мире, и во многих развивающихся странах они остаются ведущей причиной смерти детей в возрасте до 5 лет. Приблизительно половина острых респираторных инфекций вызывается респираторными вирусами. Существующий арсенал современных фармакологических средств, используемых для профилактики ОРВИ, в основном ограничен противогриппозными вакцинами, а для терапии – противовирусными препаратами для лечения гриппа. Вместе с тем отсутствуют вакцины и другие фармакологические подходы к лечению других широко распространенных респираторных вирусов (помимо вирусов гриппа, РС-вирусов). С ОРВИ связывают развитие примерно половину случаев внебольничных пневмоний у детей, более чем 90% случаев бронхиолитов у детей раннего возраста, а также 85–95% случаев обострений БА. Респираторные вирусы прямо или косвенно обусловливают возникновение ряда других тяжелых заболеваний, таких как отит, синусит, острый бронхит, хронические заболевания легких. Высокий уровень заболеваемости ОРВИ является общей проблемой для всех стран, приводящей к огромным медицинским и экономическим последствиям. В связи с особой важностью проблемы ОРВИ ВОЗ и Детский фонд Организации Объединенных Наций (ЮНИСЕФ) предприняли усилия по разработке глобального плана действий для решения вопросов профилактики и лечения ОРВИ. В ноябре 2012 г. ВОЗ/ЮНИСЕФ организовали технические консультации «Исследование потребностей в борьбе против респираторных вирусов», в которых приняли участие 60 экспертов из 42 различных медицинских научно-исследовательских и клинических учреждений мира, занимающихся исследованиями респираторных вирусов. В рамках консультационной встречи ВОЗ и ЮНИСЕФ была сформулирована и одобрена международная инициатива, сокращенно названная BRaVe (Battle against Respiratory Viruses Initiative) – Инициатива по борьбе с респираторными вирусами.
В 2013 г. были сформулированы и приняты основные направления работ в рамках новой инициативы BRaVe, среди которых (см. п. 3) рассматриваются перспективы расширения возможных фармакологических подходов к лечению и профилактике ОРВИ [177–180]:
- Исследования по этиологии и эпидемиологии ОРВИ и оценке экономического бремени, связанного с ОРВИ.
- Исследования по патогенезу и течению ОРВИ.
- Исследования и разработки по расширению возможных фармакологических подходов к лечению и профилактике ОРВИ.
- Исследования и разработки по совершенствованию клинической лабораторной диагностики ОРВИ и созданию новых диагностических тестов.
- Совершенствование клинического ведения пациентов с ОРВИ и внебольничными пневмониями.
- Исследования по оптимизации стратегий общественного здравоохранения в отношении ОРВИ.
За рубежом за последнее десятилетие отмечается определенный ренессанс в отношении разработки и исследований новых противовирусных фармацевтических препаратов универсально широкого действия, механизм которых направлен на активацию толл-подобных рецепторов (TLR – Toll-like receptor) – ключевых сенсоров системы естественного врожденного иммунитета с использованием т.н. TLR-агонистов, что приводит к индукции эндогенных ИФН, стимуляции ИФН-регулируемых генов, определяющих антивирусное состояние клетки и организма, и к выраженным иммуномодулирующим эффектам на систему адаптивного (клеточного и гуморального) иммунитета. TLR-агонисты, способные взаимодействовать с отдельными толл-подобными рецепторами (TLR7, TLR8, TLR9, TLR3, TLR2, TLR4, TLR6), которые представляют собой низкомолекулярные соединения различной природы (синтетические миметики модифицированных РНК – аналог поли(И):поли(Ц); производные имидазохинолинов – имиквимод, резиквимод; модифицированные липополисахариды, в частности эриторан тетранатриевая соль – синтетический аналог липида А, представляющего часть эндотоксина липополисахарида; липопептиды; пептидогликаны; маннаны; изаторбин или 5-амино-3-бета-D-рибофуранозил-тиазоло(4,5-d)пиримидин-2,7(3Н,6Н)-дион моногидрат; птеридинон или GS-9620-2-амино-7-этил-4(3H)-птеридинон), и по сути являются индукторами ИФН (ИИ). В настоящее время такие разработки ведутся на различных доклинических и клинических стадиях многими крупнейшими мировыми фармацевтическими компаниями, такими как Pfizer, GlaxoSmithKlein, Gilead Sciences, 3M Pharma, Hemispherx Biopharma, Eisai Inc., Anadys Pharmaceuticals Inc. /Roche, Coley Pharmaceutical Group, Inc., Idera Pharmaceuticals, InvivoGen Inc., и рядом других. Некоторые TLR-агонисты (ИИ), такие как производные имидазохинолинов имиквимод (Алдара™), Резиквимод™, уже разрешены в клинической практике для лечения генитальных и перианальных папиллом, вызванных вирусом папилломы человека, контагиозного моллюска (поксвирус) (Алдара™), генитального герпеса (Резиквимод™). Другое производное имидазохинолинов – Gardiquimod™ – разрешено FDA (Food and Drug Administration) для клинических испытаний в качестве адъюванта при разработке интраназальных противовирусных вакцин. Ведутся доклинические и клинические исследования синтетических миметиков модифицированных двуспиральных РНК – поли(И):поли(Ц), поли(И):поли(Ц)/полилизин (Hiltonol™), поли(И):поли (Ц12У) (Ampligen™) в отношении ВИЧ, хронических вирусных гепатитов С и В, тяжелого гриппа, коронавирусной и других опасных вирусных инфекций, синдрома хронической усталости, их использования в области онкологии, а также в качестве адъювантов при разработке противовирусных вакцин (Hiltonol™) [190–211]. Следует также отметить возврат интереса к исследованиям ИИ группы флуоренонов, а именно тилорона и его новых производных, в качестве антивирусных этиотропных препаратов с широким спектром активности, в частности против вирусов простого герпеса [212–216].
Следует отметить уникальный опыт российской фармакологии и клинической медицины в области создания противовирусных препаратов, относящихся к индукторам эндогенного ИФН. На протяжении почти 30 лет целенаправленно разрабатывались теоретические и прикладные аспекты этой проблемы. Впервые разработаны методы отбора (скрининга) и оценки ИИ. В результате многолетнего целенаправленного скрининга отечественным исследователям удалось создать ряд оригинальных препаратов – ИИ, имеющих высокий химиотерапевтический индекс. Обладая универсально широким противовирусным действием, ИИ были внедрены в стране, подтверждена и доказана на основе опыта нескольких десятилетий клинического применения эффективность их использования как этиотропных универсальных противовирусных средств. Помимо противовирусного действия ИИ обладают выраженной иммуномодулирующей активностью, что позволяет отнести их к бифункциональным препаратам, действующим и регулирующим ИФН-комплексные реакции взаимодействия систем естественного врожденного и адаптивного (клеточного и гуморального) иммунного ответа, направленные на поддержание и восстановление гомеостаза организма, нарушенного при вирусной инфекции. В синтезе эндогенных ИФН, индуцированных различными по химической структуре ИИ, принимают участие различные популяции иммуноцитов: Т-клетки, В-клетки, макрофаги, фибробласты, гранулоциты, нейтрофилы, дендритные клетки, эндотелиальные клетки.
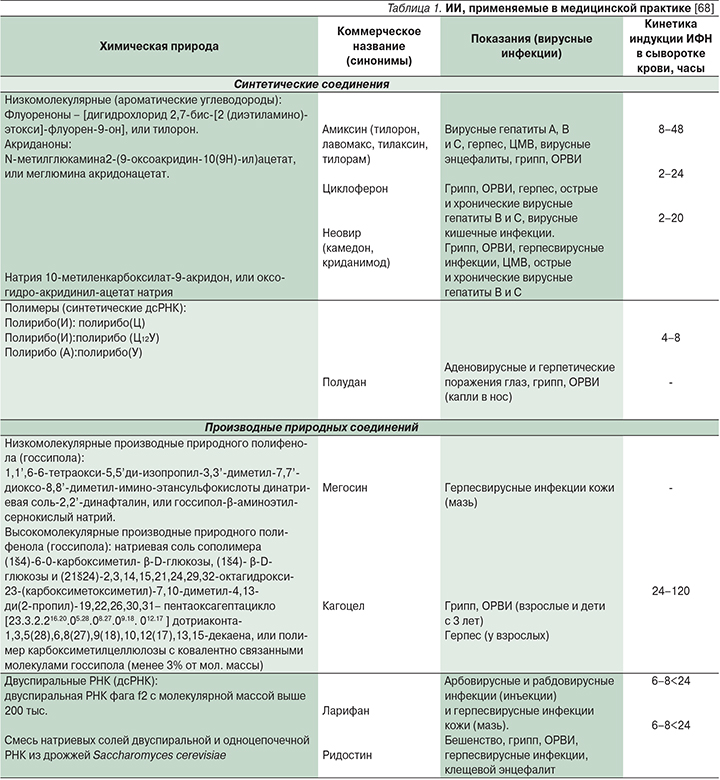
Впервые отечественные ученые предложили классификацию ИИ (табл. 1), доказали широкий спектр их противовирусных и иммуностимулирующих эффектов [68, 72, 217–223].
Предложенная классификация ИИ учитывает химическую природу и происхождение (синтетическое, природное) активных молекул, обладающих ИФН-индуцирующим действием, а также кинетику накопления и длительность циркуляции индуцированного ИФН в сыворотке крови (суммарный ответ организма на введение ИИ) – т.н. ранние и поздние ИИ:
- синтетические низкомолекулярные ароматические углеводороды – флуореноны – дигидрохлорид 2,7-бис-[2 (диэтиламино)-этокси]-флуорен-9-он], или тилорон (Амиксин);
- акриданоны – [N-метилглюкамина 2-(9-оксоакридин-10(9H)-ил)ацетат], или меглюмина акридонацетат (Циклоферон) и натрия 10-метиленкарбоксилат-9-акридон], или оксо-гидро-акридинил-ацетат натрия (Неовир);
- полимеры-миметики двуспиральных РНК (синтетические дсРНК) – полирибо(И):полирибо(Ц); полирибо(И):полирибо (Ц12У); полирибо(А):полирибо(У) (Полудан);
- низкомолекулярные производные природного полифенола (госсипола): [1,1’,6-6-тетраокси-5,5’ди-изопропил-3,3’-диметил-7,7’-диоксо-8,8’-диметил-имино-этансульфокислоты динатриевая соль-2,2’-динафталин], или госсипол-β-аминоэтил-сернокислый натрий (Мегосин);
- высокомолекулярные производные природного полифенола (госсипола): [натриевая соль сополимера (1→4)-6-0-карбоксиметил- β-D-глюкозы, (1→4)- β-D-глюкозы и (21→24)-2,3,14,15,21,24,29,32-октагид-рокси-23-(карбоксиметоксиметил)-7,10-диметил-4,13-ди(2-пропил)-19,22,26,30,31- пентаоксагептацикло [23.3.2.216.20.05.28.08.27.09.18.012.17] дотриаконта-1,3,5(28),6,8(27),9(18),10,12(17),13,15-декаена] (Кагоцел).
Препараты природных дсРНК (миметики вирусных дсРНК): двуспиральная РНК-фага f2 (Ларифан), смесь натриевых солей двуспиральной и одноцепочечной РНК из дрожжей Saccharomyces cerevisiae (Ридостин).
Отечественные препараты ИИ, среди которых хорошо известны Амиксин®, Кагоцел®, Ларифан®, Неовир®, Полудан®, Ридостин®, Циклоферон®, нашли широкое клиническое применение при вирусных гепатитах, герпес- и цитомегаловирусной инфекциях, вирусных энцефалитах, гриппе, ОРВИ и ряде других заболеваний [222].
В обзорной статье Ф.И. Ершова и соавт. (2013), посвященной результатам и перспективам использования ИИ в лечении инфекционных болезней [222], подчеркивается, что они обладают плейотропным действием, включающем в ряде случаев прямое противовирусное, противовоспалительное и иммуномодулирующее (прямое и опосредованное) действия. Различные клетки обладают неодинаковым потенциалом к продукции ИФН под воздействием отдельных ИИ. В ответ на конкретный индуктор в синтезе ИФН могут принимать участие различные клетки иммунной системы, но некоторые ИИ обладают уникальной способностью «включать» продукцию ИФН только в определенных популяциях клеток, что имеет преимущество перед поликлональной стимуляцией иммуноцитов экзогенными ИФН. Иммуноциты начинают отвечать синтезом ИФН в ответ на индукторы через разные промежутки времени, поэтому скорость накопления сывороточных ИФН в организме определяется степенью участия той или иной популяции иммуноцитов в продукции ИФН в ответ на применяемый ИИ. Так, на воздействие ИИ группы акриданонов (в частности, меглюмина акриданонацетат) отвечают главным образом В-лимфоциты, продуцирующие «ранние» ИФН, динамика накопления которых выявляется в виде одного высокого пика. Для ИИ группы флуоренонов (тилорон) характерно усиление образования ИФН клетками эпителия кишечника, гепатоцитами, Т-лимфоцитами и гранулоцитами, причем Т-лимфоциты являются ведущей популяцией клеток, ответственных за синтез «поздних» ИФН без посредства макрофагов. TLR-агонисты группы двуспиральных природных и синтетических РНК (миметики вирусных дсРНК – Ларифан, Ридостин) являются поликлональными стимуляторами, способными вызывать индукцию ИФН в клетках мононуклеарно-фагоцитарного ряда (T- и В-лимфоциты, макрофаги, нейтрофилы, гранулоциты, а также клетки эндотелия и фибробласты), но наиболее активный синтез «ранних» ИФН в ответ на введение дсРНК осуществляют Т-лимфоциты, которые продуцируют ИФН только в присутствии макрофагов. TLR-агонисты группы высокомолекулярных производных природного полифенола (Кагоцел) стимулируют длительную продукцию «поздних» ИФН практически во всех популяциях клеток организма: Т- и В-лимфоцитах, макрофагах, гранулоцитах, фибробластах, эндотелиальных клетках. При пероральном приеме динамика накопления индуцированных ИФН в кишечнике (через 4 часа) не совпадает с таковой титров циркулирующих в сыворотке крови ИФН, достигающих максимума через 48 часов и длящейся до 4–5 суток. Среди достоинств ИИ данной группы – низкая токсичность, широкий спектр иммуномодулирующих эффектов, хорошая растворимость в биологических жидкостях и способность легко выводиться из организма [68].
TLR-агонисты различаются также по количественной динамике накопления индуцированных ИФН в различных органах и тканях. Способность ИИ вызывать синтез эндогенных ИФН в той или иной ткани играет ключевую роль в распределении ИФН в организме и может в той или иной мере служить ориентиром в определении стратегии клинического применения ИИ [68, 222]. Так, в мышцах ИФН синтезируются главным образом в ответ на индукцию высокомолекулярными (полимерными) молекулами ИИ (Кагоцел, Ридостин, Ларифан), но не в ответ на низкомолекулярные ИИ групп флуоренонов и акриданонов. Высокая количественная динамика продукции ИФН в легких характерна при применении таких ИИ, как Кагоцел, Ларифан, Циклоферон. Практически все без исключения ИИ вызывают образование значительного количества ИФН в печени. В отношении индукции ИФН в селезенке лидируют Циклоферон и Ларифан. Лишь немногие ИИ способны индуцировать ИФН в кишечнике, среди них – Кагоцел и Амиксин.
В монографии Ф.И. Ершова, О.И. Киселева [68] были обобщены преимущества применения ИИ, органично дополняющих препараты ИФН перед экзогенными ИФН:
- при использовании ИИ синтезируется собственный ИФН, который в отличие от рекомбинантных ИФН не обладает антигенностью;
- при передозировках коммерческих ИФН может возникнуть ряд побочных эффектов;
- участвуя в иммунных реакциях организма, ИФН стимулируют неспецифическую цитотоксичность иммуноцитов, кроме того, вызывает экспрессию молекул HLA (Human Leucocyte Antigen) в тех популяциях клеток, которые обычно не экспрессируют антигены. В свою очередь это может стать причиной усугубления аутоиммунного ответа организма. При использовании ИИ такой опасности нет, поскольку синтез ИФН сбалансирован и контролируется механизмами, надежно обеспечивающими защиту организма от избытка ИФН;
- однократное введение ИИ обеспечивает относительно длительную циркуляцию ИФН на терапевтическом уровне, тогда как для достижения подобных концентраций при применении экзогенных ИФН требуется многократное введение значительных доз препаратов;
- некоторые ИИ обладают уникальной способностью «включать» синтез ИФН в определенные популяции клеток и органов, что в ряде случаев дает определенные преимущества перед поликлональной стимуляцией иммуноцитов ИФН;
- TLR-агонисты дают те же эффекты, что и ИФН. Прежде всего они оказывают иммуномодулирующее влияние и прекрасно сочетаются с другими противовирусными препаратами. При таком комбинированном использовании препаратов в ряде случаев наблюдается аддитивный и даже синергидный эффекты.
Наиболее часто ИФН и их индукторы применяют в отношении детей с частыми респираторными заболеваниями, поскольку именно у данного контингента наиболее часто выявляется вторичная дисфункция иммунитета. Часто болеющий ребенок (ЧБД) – это ребенок с повторной или рецидивирующей респираторной вирусной, бактериальной или смешанной инфекционной патологией ЛОР-органов (аденоидиты, тонзиллиты, отиты), верхних (ларингиты) или нижних (трахеиты, бронхиты, пневмонии) дыхательных путей, развивающихся на фоне сниженного иммунитета или неадекватного лечения острого респираторного заболевания, с повышенным риском развития местных гнойных, системных воспалительных и функциональных легочных (круп, бронхообструкция) и сердечно-сосудистых осложнений [224].
Проблема ЧБД, рассмотрение патогенетических основ развития вторичных иммунодефицитов у пациентов этой категории, а также подходы к выбору рациональной фармакотерапии ЧБД всесторонне рассмотрены М.Г. Романцовым, Ф.И. Ершовым в изданном в 2006 г. руководстве для врачей «Часто болеющие дети: рациональная фармакотерапия» [225].
В книге подчеркивается, что термин «часто болеющие дети» появился в отечественной медицинской литературе в начале 1980-х гг. Таких детей выделяли при диспансерном наблюдении: заболеваемость у них выше, чем у сверстников. Термин «часто болеющие дети» зарубежные педиатры не используют, нет его и в Международной классификации болезней 10-го пересмотра. Отечественная педиатрическая служба выделяет эту категорию детей, т.к. у них значительно чаще выявляются хронические заболевания ЛОР-органов и бронхолегочной системы, чаще встречаются и тяжелее протекают бронхиальная астма и ряд других заболеваний. У ЧБД даже в период клинического благополучия выявляются отчетливые изменения в межклеточном взаимодействии в иммунной системе, повышается содержание провоспалительных цитокинов (ИЛ-2, ИЛ-4), а также цитокинов, участвующих в хронизации процессов воспаления (ИЛ-6, ИЛ-8), что сопровождается снижением клеточной цитотоксичности, дизиммуноглобулинемией, повышением числа клеток, экспрессирующих рецепторы, индуцирующих апоптоз. Выявлена недостаточность резервных возможностей интерфероногенеза, особенно в плане синтеза ИФН, осуществляющих мощную противовирусную защиту, что объясняет сохранение вялотекущего воспаления в организме даже в отсутствие клинических признаков острого респираторного заболевания (ОРЗ). У часто и длительно болеющего ребенка иммунная система характеризуется крайним напряжением процессов иммунного реагирования, недостаточностью резервных возможностей. Наиболее часто (от 23 до 40%) встречаются сочетанные изменения в системах Т- и В-звеньев иммунитета. Снижение продукции лейкоцитами у 40% ИФН-γ, а у 20% детей ИФН-α при сочетанном снижении α-, γ-типов ИФН отмечено у 16% детей в интерморбидном периоде. Клинико-иммунологический анализ позволяет утверждать, что выявленные дефекты иммунной и интерфероновой систем способствуют частому повторению эпизодов ОРЗ и возникновению осложнений. Ежегодно ОРЗ болеют десятки миллионов детей. На долю ЧБД приходится от 67 до 75% всех случаев ОРЗ, которые относятся к наиболее распространенным заболеваниям у детей и способствуют формированию хронической патологии. Согласно руководству М.Г. Романцова, Ф.И. Ершова [224], «…к часто болеющим относят детей в соответствии с инфекционным индексом (ИИ), определяемым как отношение суммы всех случаев ОРЗ (в течение года) к возрасту ребенка. У ЧБД ИИ составляет от 1,1 до 3,5, а у редко болеющих детей он колеблется от 0,2 до 0,3. Если наблюдение за ребенком продолжается меньше года, то рассчитывают индекс резистентности (I) – это отношение числа перенесенных ребенком острых заболеваний к числу месяцев наблюдения. В соответствии с этим часто болеющим можно считать ребенка, если его I составляет 0,33 и более. К клиническим признакам относятся частые обострения хронических воспалительных заболеваний разной этиологии; повторные респираторные вирусные инфекции (более 5 раз в год); частые обострения герпетической инфекции; длительный субфебрилитет; лимфаденопатия; отсутствие достаточного клинического эффекта стандартной терапии по поводу имеющегося у пациента заболевания».
В структуре ОРЗ преобладают ОРВИ. Этиология ОРВИ чрезвычайно разнообразна: их вызывают более 200 различных представителей четырех семейств РНК-содержащих вирусов (ортомиксо-, парамиксо-, корона-, пикорнавирусы) и двух семейств ДНК-содержащих вирусов (адено- и герпесвирусы). Полиэтиологичность ОРВИ создает серьезные трудности для профилактики и терапии, поскольку вакцино- и химиопрофилактика не имеет больших перспектив, т.к. вряд ли возможно введение более сотни вакцин и применение десятков химиотерапевтических средств. Здесь нужны новые подходы, одним из которых является активизация естественного иммунитета с помощью ИИ и иммуномодуляторов. Оздоровление детей, часто и длительно болеющих ОРЗ, имеет огромное медицинское и социально-экономическое значение. Снижение заболеваемости ОРЗ у ЧБД возможно только при систематической и комплексной иммунореабилитации. Появление в арсенале иммунокорректоров с противовирусными свойствами (ИФН и их индукторы, разрешенные для детской практики) открывает новые перспективы иммунореабилитации этого контингента.
Следует подчеркнуть особую ответственность со стороны врача при лечении детей, которые относятся к данной группе, поскольку именно им часто назначают иммуномодулирующие препараты. Сложность при лечении ЧБД заключается в том, что нередко на приеме врачи имеют дело с детьми, которые уже неоднократно получали какое-либо лечение различными препаратами, в т.ч. ИФН, иммуномодуляторами и ИИ.
Одна из задач настоящего исследования заключалась в сравнительном изучении различий лабораторных показателей состояния гуморального иммунитета и ИФН-статуса у ЧБД и у эпизодически болеющих детей (ЭБД). Принимая во внимание всю сложность и ответственность врача в выборе индивидуальных подходов и средств лечения ЧБД, в частности в отношении обоснования выбора препарата группы ИИ для лечения ОРВИ, в данном исследовании была поставлена дополнительная задача по анализу индивидуальной чувствительности данного контингента детей к отдельным ИИ, определяемая in vitro на основе интегративной оценки уровней продукции лейкоцитами/лимфоцитами цельной крови ИФН-α в ответ на препарат ИИ и ИФН-γ в ответ на фитогемагглютинин (ФГА) а также спонтанной продукции ИФН in vitro лейкоцитами/лимфоцитами в сопоставлении с уровнем циркулирующего в крови сывороточного ИФН. Данный метод – Способ определения индивидуальной чувствительности лейкоцитов крови людей к лекарственному препарату, запатентованный в РФ Р.А. Арутюняном и С.С. Григорян в 2009 г., начал применяться в клинической практике сравнительно недавно: в 2010 г. [226]. При использовании данного метода стало возможным проведение индивидуального подбора лекарственных средств и, соответственно, достижение большей клинической эффективности терапии ЧБД. Иными словами, моделируется и оценивается костимулирующее/корригирующее воздействие лекарственного средства на 2 наиболее информативных показателя интерфероногенеза и реактивности системы ИФН данного пациента на основе количественной оценки чувствительности лейкоцитов/лимфоцитов цельной крови к каждому из исследуемых препаратов, т.е. определяется индивидуальный индекс костимуляции и коррекции каждого препарата для данного пациента. Согласно разработанному методу, для расчета индекса костимуляции и коррекции используются следующие количественные показатели ИФН-статуса в норме у детей:
- Сывороточные ИФН: 8 ЕД/мл.
- Спонтанные ИФН: 2 ЕД/мл–640 ЕД/мл.
- Индуцированный ИФН-γ (дети от года до 12 лет) – 64–128 ЕД/мл.
Материал и методы
В качестве исходных материалов при проведении данной работы использованы результаты открытого проспективного исследования, проведенного с 2009 по 2012 г. в педиатрическом отделении № 1 филиала № 2 поликлиники ОАО «Газпром» Москвы.
В исследование были включены 143 ребенка в возрасте от года до 17 лет.
Критерии включения в исследование:
- возраст от года до 17 лет;
- постоянное проживание в Москве с рождения;
- дети с повторными эпизодами острой респираторной инфекции за год по критериям, разработанным В.Ю. Альбицким и А.А. Барановым (от года до 3 лет – 6 эпизодов в год и более; от 4 до 5 лет – 5 эпизодов в год и более; старше 5 лет – 4 эпизодов в год и более; по инфекционному индексу у детей старше 3 лет, равному 1,5–3,5);
- отсутствие тяжелой сопутствующей патологии (врожденные пороки развития, онкологические заболевания, сахарный диабет);
- информированное согласие законных представителей пациента для включения ребенка в исследование.
Критерии исключения:
- дети первого года жизни;
- непостоянное проживание в Москве;
- наличие тяжелой сопутствующей патологии;
- отсутствие согласия законных представителей ребенка для включения его в исследование.
Были сформированы 2 группы пациентов: группа 1 (n=120) – дети с частыми повторными ОРЗ в течение года (ЧБД); группа 2 (n=23) – группа контроля, представленная детьми с эпизодическими ОРЗ (ЭБД). Все дети были с основным клиническим диагнозом: ОРВИ.
Оценка гуморального звена иммунитета (количественное определение IgA, IgM и IgG) выполнялась с использованием биохимического анализатора COBAS c501, (производства Roche Diagnostics GmbH, Hitachi High-Technologies Corporation, ФГА, Япония), калибраторов и реагентов производства Roche (Швейцария).
Для оценки ИФН-статуса проводили количественное определение циркулирующих ИФН-α и ИФН-γ в сыворотке крови пациентов, а также спонтанную и индуцированную продукцию данных цитокинов лейкоцитами/лимфоцитами периферической крови in vitro методом иммуноферментного анализа. Оценка результатов проводилась по степени недостаточности ИФН-α и ИФН-γ (табл. 2) [227].
Пациента считали чувствительным к исследуемым препаратам, если клетки его крови отвечали увеличением индуцируемой ФГА продукции ИФН-γ после воздействия исследуемого препарата.
Статистическую обработку полученных данных проводили с помощью программы Statistica 8 (StatSoft, США). C помощью критерия Шапиро–Уилка было установлено, что исследуемые признаки не подчиняются закону нормального распределения (p<0,001). Поэтому для описания количественных признаков использовали медиану (Me), верхний и нижний квартили (25%; 75%), а для анализа – методы непараметрической статистики. Достоверность гипотезы об отсутствии различий (0-гипотезы) в связанных группах проверяли с помощью критерия Уилкоксона, а в независимых группах – с помощью критерия Манна–Уитни. Для описания качественных порядковых и номинальных признаков вычисляли абсолютные и относительные частоты. Для проверки 0-гипотезы об отсутствии различий между относительными частотами одной группы использовали двусторонний критерий статистической значимости, а в двух связанных группах – критерий МакНемара. Достоверность гипотезы об отсутствии различий качественных признаков в группах 1 и 2 проверяли с помощью χ2-критерия с поправкой Йетса на непрерывность, т.к. предварительный анализ показал неустойчивость χ2-критерия. Различия значений считали статистически значимыми при p<0,05. Оценка влияния исследуемых факторов на риск развития частых ОРИ у детей осуществлялась методом логистического регресса.
Результаты исследования
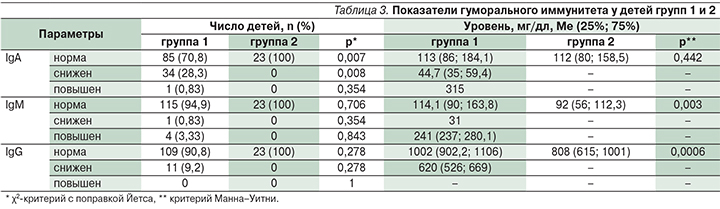
Данные исследования гуморального иммунитета представлены в табл. 3. Уровень IgA был в пределах нормы у всех ЭБД и у большинства (85, 70,8%) – ЧБД (p=0,007). При этом его значения в группах существенно не различались (p=0,442). Снижение уровня IgA выявлено у 34 (28,3%) ЧБД, и только у 1 (0,83%) ребенка группы ЧБД уровень IgA был повышен.
Уровень IgM был в пределах нормы также у всех ЭБД и у большинства (94,9%) – ЧБД. Причем его значения хотя и находились в пределах нормы, но были существенно ниже в группе ЭБД, чем в группе ЧБД, – вероятно, из-за меньшего числа инфицированных детей.
Уровень IgG хотя и был в пределах нормы у 100% ЭБД и у 90,8% ЧБД (p=0,278), но оказался существенно ниже у ЭБД.
Таким образом, у большинства ЧБД и у всех ЭБД показатели гуморального иммунитета не были изменены. Однако у 41 (34,2%) ЧБД были выявлены изменения уровней иммуноглобулинов. При этом у 32 (26,7%) ЧБД были выявлены изолированные изменения уровней иммуноглобулинов классов A, M и G, а у 9 (7,5%) ЧБД – одновременное изменение уровней двух или трех классов иммуноглобулинов.
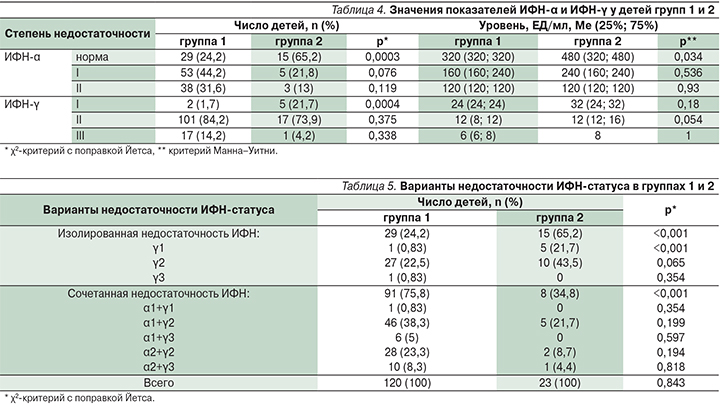
В табл. 4 и 5 представлены показатели значений ИФН-α и ИФН-γ. Уровень ИФН-α был в пределах нормы у 65,2% детей группы контроля и значительно ниже – у 24,2% детей группы ЧБД (p<0,001).
Недостаточность ИФН-α 1-й степени (α1) была выявлена у 44,2% ЧБД и у 21,8% ЭБД (p=0,076). Недостаточность ИФН-α 2-й степени (α2) выявлена у 31,6% ЧБД и у 13% ЭБД (p=0,119). Нормальных показателей ИФН-γ не было выявлено ни у одного ребенка в группах как ЧБД, так и ЭБД. При этом недостаточность ИФН-γ 1-й степени (γ1) была выявлена у 21,7% ЭБД и только у 1,7% ЧБД (p<0,001), в то же время у большинства (84,2%) ЧБД и ЭБД (73,9%) преобладала недостаточность ИФН-γ 2-й степени (γ2). Недостаточность ИФН-γ 3-й степени (γ3) была выявлена у меньшего числа детей обеих групп. Таким образом, недостаточность системы ИФН была выявлена у всех ЧБД и ЭБД. У большинства (75,8%) ЧБД была выявлена сочетанная недостаточность как α-, так и γ-ИФН, в то время как в группе контроля таких детей было существенно меньше – 34,8% (p<0,001).
Проведенный анализ показателей гуморального иммунитета и ИФН-статуса выявил, что в группе ЧБД у 65,8% детей имела место недостаточность только системы ИФН, а у 34,2% выявлены нарушения гуморального иммунитета в сочетании с недостаточностью системы ИФН. У 6 (5%) детей (ЧБД) выявлена недостаточность ИФН-α в сочетании с нарушением гуморального иммунитета, а у 35 (29,2%) – недостаточность как ИФН-α, так и ИФН-γ в сочетании с нарушением гуморального иммунитета. В то же время у всех 23 (100%) детей группы ЭБД выявлена только недостаточность системы ИФН, а показатели гуморального иммунитета были в пределах нормы.
В связи с выявленными нарушениями иммунного статуса стала очевидной необходимость их коррекции. Однако у ЧБД, в отношении которых ранее нередко применялись различные иммуномодулирующие препараты, для достижения более эффективного лечения необходим индивидуальный подход к иммунокоррекции. Выбор препарата для иммунокорригирующего воздействия должен осуществляться с учетом индивидуальной чувствительности ребенка.
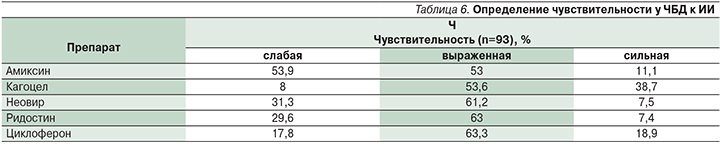
С этой целью в исследовании было проведено определение чувствительности лейкоцитов/лимфоцитов цельной крови к препаратам ИИ у 93 детей группы ЧБД (в возрасте от года до 15 лет). Для определения чувствительности лейкоцитов/лимфоцитов цельной крови у детей группы ЧБД была использована панель из пяти препаратов ИИ: Амиксина, Кагоцела, Неовира, Ридостина и Циклоферона.
Амиксин (тилорон) – пероральный препарат, низкомолекулярный синтетический ИИ ароматического ряда, относящийся к классу флуоренонов, индуцирует образование в организме «поздних» ИФН-α, β- и γ-. Основными продуцирующими ИФН в ответ на введение тилорона являются клетки эпителия кишечника, гепатоциты, Т-лимфоциты, нейтрофилы и гранулоциты. После приема препарата внутрь максимум продукции ИФН определяется в последовательности кишечник–печень–кровь через 4–24 часа; у детей применяется с 7-летнего возраста. Режим дозирования: при неосложненных формах гриппа и других ОРВИ – по 60 мг 1 раз в сутки на 1-й, 2 и 4-й дни от начала лечения, курсовая доза – 180 мг (3 таблетки); при возникновении осложнений гриппа или других ОРВИ – по 60 мг 1 раз в сутки на 1-й, 2, 4 и 6-й дни от начала лечения. Курсовая доза — 240 мг (4 таблетки).
Кагоцел – пероральный препарат, индуцирует образование «поздних» ИФН (ИФН-α и ИФН-β) с максимальным подъемом в сыворотке крови к 48 часам с последующей длительной циркуляцией до 4–5 суток, вместе с тем индукция ИФН в кишечнике отмечается уже через 4 часа. Кагоцел вызывает продукцию ИФН практически во всех популяциях клеток, принимающих участие в противовирусном ответе организма: Т- и В-лимфоцитах, макрофагах, гранулоцитах, фибробластах, эндотелиальных клетках. Согласно инструкции, он может применяться взрослыми и детьми с 3-летнего возраста. Режим дозирования: для лечения гриппа и ОРВИ детям в возрасте от 3 до 6 лет назначают в первые два дня по 1 таблетке 12 мг 2 раза в сутки, в последующие два дня – по 1 таблетке 1 раз в сутки, всего на курс – 6 таблеток, длительность курса – 4 дня; детям в возрасте от 6 лет назначают в первые два дня по 1 таблетке 12 мг 3 раза в сутки, в последующие 2 дня – по 1 таблетке 2 раза в сутки; всего на курс – 10 таблеток, длительность курса – 4 дня. Профилактика гриппа и ОРВИ у детей в возрасте от 3 лет проводится 7-дневными циклами: 2 дня – по 1 таблетке 12 мг 1 раз в сутки, 5 дней перерыв, затем цикл повторить. Длительность профилактического курса – от одной недели до нескольких месяцев.
В 2007–2009 гг. проведены рандомизированные слепые плацебо-контролируемые исследования безопасности и эффективности применения препарата Кагоцел для лечения и профилактики гриппа и ОРВИ в отношении детей старше 6 лет, а затем у детей от 3 до 6 лет. Окончательные результаты исследований были опубликованы в 2012 г. [228]. Была доказана высокая противовирусная активность Кагоцела, отсутствие токсичности. На фоне терапии наблюдались (по сравнению с группой контроля) купирование катаральных симптомов, более раннее снижение температуры, уменьшение интоксикации [228]. Терапевтическая эффективность Кагоцела была подтверждена в отношении детей с обструктивным ларингитом (с осложненным и неосложненным течением), на контингенте ЧБД, у детей при вирусных поражениях желудочно-кишечного такта [229–231].
Неовир – парентеральный (раствор для внутримышечного введения) и пероральный препарат, относится к фармакологическим группам: противовирусные (за исключением ВИЧ) средства, оказывает противовирусное (в отношении ДНК- и РНК-геномных вирусов) и ИИ – низкомолекулярный ИИ, относящийся к классу акриданонов, индуцирует образование высоких уровней «ранних» ИФН (α- и β-). Пик активности ИФН в крови и тканях наблюдается через несколько часов после внутримышечного введения и сохраняется в течение 16–20 часов. Инъекция 250 мг Неовира внутримышечно по динамике сывороточного титра ИФН эквивалентна введению 6–9 млн МЕ рекомбинантного ИФН-α. Активирует стволовые клетки костного мозга, Т-лимфоциты и макрофаги. Нормализует баланс между субпопуляциями Т-хелперных и Т-супрессорных клеток. Препарат способен снижать продукцию фактора некроза опухоли (при ВИЧ-инфекции, герпесе), активировать естественные киллерные клетки (при опухолевых заболеваниях). Обладает выраженным стимулирующим действием в отношении активности полиморфноядерных лейкоцитов. Режим дозирования (взрослые): раствор для внутримышечного введения: разовая терапевтическая доза – 250 мг (4–6 мг/кг), при необходимости – до 500 мг; курс лечения – 5–7 инъекций в разовой дозе с интервалом 48 часов, продолжительность курса – 8–12 дней; при длительном или профилактическом применении рекомендуется интервал между инъекциями, равный 3–7 суткам. Неовир-таблетки, покрытые оболочкой, 0,125 г (растворимые в кишечнике), разовая терапевтическая доза – 750 мг; при необходимости – до 1500 мг; курс лечения – 5–7 приемов таблеток в разовых дозах с интервалом 48 часов, продолжительность курса – 8–12 дней; при длительном или профилактическом применении рекомендуется интервал между приемом таблеток, равный 3–7 суткам. Неовир не применяется у детей.
Ридостин (рибонуклеат натрия) – препарат для парентерального применения, индуцирует образование «ранних» ИФН, не применяется у детей младше 7 лет.
Циклоферон – препарат для перорального и парентерального (внутримышечного введения), индуцирует синтез «ранних» ИФН, применяется взрослыми и детьми с 4-летнего возраста.
Результаты исследования представлены в табл. 6.
При обследовании детей с рекуррентными заболеваниями наибольшая чувствительность (выраженная и сильная) была выявлена к двум препаратам ИИ – Кагоцелу и Циклоферону. У многих препаратов группы ИИ существуют различные ограничения, в основном они касаются возраста: Амиксин и Ридостин не применяются у детей младше 7 лет, Циклоферон – до 4 лет, Неовир у детей не применяется. Одной из особенностей препаратов группы ИИ является феномен развития рефрактерности (или гипореактивности) ответа организма на повторное введение ИИ. О наличии возможного проявления феномена рефрактерности у препарата ИИ можно судить по имеющемуся в инструкции рекомендуемому интервалу в дозировании при терапевтическом использовании, обычно составляющему 1–2 или 3 (до 7) суток. Отсутствие эффекта лечения в связи с феноменом рефрактерности (гипореактивности) требует замены на другой препарат группы ИИ. В этом отношении только один препарат ИИ – Кагоцел, очевидно, благодаря близкой к физиологической динамике индукции эндогенного ИФН и продолжительной его циркуляции в сыворотке имеет в инструкции непрерывный режим дозирования для терапии гриппа и ОРВИ.
Врачи, решающие вопрос о назначении фармакотерапии пациентов с ОРВИ группы ЧБД, встречаются с проблемой выбора адекватных для каждого конкретного случая препаратов не только с учетом существующих возрастных ограничений, но главным образом в зависимости от состояния ребенка, точной диагностики, факторов риска, сопутствующих заболеваний, наличия иммунодефицитов, сопутствующих заболеваний, на основе чего может быть принято решение о необходимости применения этиотропной (противовирусной и противовоспалительной), а также иммуномодулирующей терапии.
В настоящем исследовании у большинства пациентов группы ЧБД по сравнению с группой ЭБД выявлены изолированные отклонения в звене гуморального иммунитета, что скорее можно интерпретировать в пользу наличия незрелого инфантильного типа иммунного реагирования в отсутствие серьезных конституитивных дефектов, приводящих к транзиторной иммуносупрессии, связанной с рекуррентными ОРВИ, но вместе с тем это свидетельствует о крайней напряженности процессов иммунного реагирования и недостаточности резервных возможностей.
Выявленные более значимые отклонения в системе ИФН у пациентов группы ЧБД также свидетельствуют о недостаточности резервных возможностей интерфероногенеза, особенно в плане синтеза ИФН-α, осуществляющего мощную противовирусную защиту, что объясняет сохранение вялотекущего воспаления в организме даже в отсутствие клинических признаков ОРЗ. По показателям ИФН-статуса можно судить об иммунореактивности организма. Низкая продукция ИФН у ЧБД служит основанием для назначения ИФН-стимулирующей терапии с применением препаратов группы ИИ. Для эффективного лечения необходим мониторинг показателей ИФН-статуса с проведением контрольного исследования через 2,5–3,0 месяца. О восстановлении ИФН-статуса свидетельствует нормализация показателей.
Заключение
Таким образом, изучение показателей ИФН-статуса и гуморального иммунитета у ЧБД, а также определение индивидуальной чувствительности лейкоцитов/лимфоцитов цельной крови к ИФН-индуцирующему воздействию различных препаратов группы ИИ позволяют врачу выбирать и назначать фармакотерапевтическое вмешательство с доказанной эффективностью. Исходя из данных настоящего исследования, а также на основании других опубликованных клинических работ [228–231], одним из препаратов выбора для лечения и профилактики ОРВИ у ЧБД является отечественный противовирусный препарат группы ИИ Кагоцел, применение которого позволяет не только сокращать сроки заболевания, но и предупреждать назначение антибиотиков, которые в последние годы неоправданно часто назначаются детям данной группы, формируя лекарственную устойчивость у микроорганизмов и приводя к полипрагмазии.



