Вреальных клинических условиях пациенты с коморбидными соматическими заболеваниями, как правило, получают комбинированную терапию. Для преодоления полипрагмазии и ятрогении при выборе нестероидных противовоспалительных средств (НВПС) для купирования болевого синдрома врачу необходимо прогнозировать эффекты взаимовлияния лекарственных препаратов. Цель данной статьи – продемонстрировать высокий уровень безопасности мелоксикама (Мовалис) не только по отдельным, но и по сочетанным рискам развития побочных эффектов для пациентов разных возрастов и с разными коморбидными заболеваниями.
В настоящее время достаточно хорошо изучено негативное влияние НВПС на желудочно-кишечный тракт (ЖКТ). Известно, что гастроинтестинальные побочные эффекты более характерны для неселективных НВПС, которые ингибируют как циклооксигеназу-1 (ЦОГ-1), так и ЦОГ-2, нежели для селективных, которые характеризуются высокой безопасностью по отношению к ЖКТ. Опубликованные в 2013 г. результаты мета-анализа (124 514 пациентов из 280 исследований) еще раз продемонстрировали, что поражения ЖКТ на фоне терапии НВПС встречаются часто, при этом относительный риск гастроинтестинальных осложнений почти в два раза выше у таких неселективных НВПС, как ибупрофен и напроксен, по сравнению с диклофенаком и коксибами [1].
Более чем за 20-летний период желудочно-кишечная безопасность мелоксикама была продемонстрирована во многих исследованиях. И в одном из первых мета-анализов с участием разных НВПС в 1999 г. было отмечено, что в отличие от неселективных НВПС при терапии мелоксикамом, в т.ч. длительной, риск развития осложнений со стороны ЖКТ достоверно низкий (отношение шансов [ОШ]=0,64; 95% доверительный интервал [ДИ] – 0,59–0,69). Также низкий риск был для диспепсии (ОШ=0,73; 95% ДИ – 0,64–0,84), симптоматических язв, гастроинтестинальных кровотечений и перфораций (ОШ=0,52, 95% ДИ – 0,28–0,96) [2]. Гораздо позже, в 2012 г., результаты сравнительного исследования (с участием добровольцев) влияния мелоксикама в дозе 10 мг/сут и селективного ингибитора ЦОГ-2 целекоксиба в дозе 200 мг/сут с помощью капсульной эндоскопии показали, что мелоксикам – безопасный препарат: через 14 дней общая частота поражения слизистой оболочки тонкой кишки на мелоксикаме составила 26,7%, целекоксибе – 42,9%, (р=0,45) [3].
Интересно, что заявления о высокой гастроинтестинальной безопасности некоторых неселективных НВПС не убедительны и требуют проведения сравнения препаратов в более однородных условиях. Так, например, авторы сравнительного исследования безопасности ацеклофенака, рофекоксиба и мелоксикама в обсуждении отмечают, что полученные ими результаты о преимуществе ацеклофенака над более селективными НВПС все же имеют ряд важных ограничений. Во-первых, анализируемая информация о побочных эффектах неоднородна, что связано с источниками, которые не всегда были доступными для анализа. Выход ацеклофенака на рынок и высокая настороженность врачей предопределили более частое применение мелоксикама и рофекоксиба пациентами с неблагоприятным ЖКТ-анамнезом и высоким риском побочных гатроинтестинальных эффектов. В то же время ацеклофенак использовался пациентами с благополучным гастроинтестинальным анамнезом, что предопределило положительные результаты. Во-вторых, авторы отметили, что в ряде исследований имело место занижение общего числа побочных эффектов, а также были трудности в установлении причинно-следственных связей между побочным эффектом и вводимым препаратом [4]
Итак, поскольку риск развития гастроинтестинальных побочных эффектов выше для неселективных НВПС, с 1998 г. FDA (Food and Drug Administration) были одобрены три специфических ингибитора ЦОГ-2: целекоксиб, рофекоксиб и вальдекоксиб, которые продемонстрировали высокую безопасность по отношению к ЖКТ. Предполагалось, что «коксибы» (селективные ингибиторы ЦОГ-2), ингибируя воспаление, будут оказывать мощное антиатерогенное влияние. Однако результаты крупных рандомизированных исследований рофекоксиба VIGOR (8076 пациентов) и целекоксиба CLASS (8059 пациентов) показали, что за счет уменьшения выработки простациклина1 «коксибы» усиливают протромботическую активность, что невозможно не учитывать при назначении НВПС-терапии пациентам с коморбидными сердечно-сосудистыми заболеваниями [5].
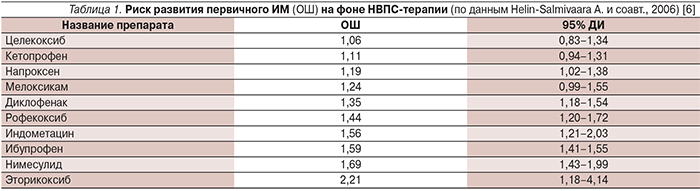
Опубликованные в 2006 г. результаты популяционного исследования (в которое вошли 33 309 больных инфарктом миокарда [ИМ] и 138 949 человек группы контроля) показали, что риск развития ИМ на фоне приема различных НВПС абсолютно различен (табл. 1). На фоне терапии мелоксикамом этот риск увеличивается в 1,25 раза (ОШ=1,25; 95% ДИ – 0,99–1,55), что в несколько больше, чем у напроксена, на котором риск события увеличен в 1,19 раза (OШ=1,19; 95% ДИ – 1,02–1,38), и целекоксиба – в 1,06 раза (ОШ=1,06; 95% ДИ – 0,83–1,34), но меньше по сравнению с диклофенаком, на фоне которого риск ИМ увеличивается в 1,35 раза (OШ=1,35; 95% ДИ – 1,18–1,54), и особенно нимесулидом, риск развития события на фоне которого повышается в 1,69 раза (OШ=1,69; 95% ДИ – 1,43–1,99), а также эторикоксибом, на котором риск ИМ возрастает в 2,21 раза (ОШ=2,21; 95% ДИ – 1,18–4,14) [6].
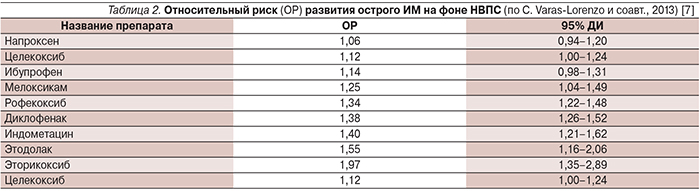
Опубликованные в 2013 г. результаты мета-анализа продемонстрировали величину относительного риска (ОР) развития ИМ у пациентов с ИБС в анамнезе на фоне приема наиболее часто используемых НВПС (табл. 2). Для напроксена ОР события был минимальным и составил 1,06 (95% ДИ – 0,94–1,20), но было установлено дозозависимое увеличение риска ИМ. Для мелоксикама ОР ИМ составил 1,25 (95% ДИ – 1,04–1,49). Для диклофенака и рофекоксиба зависимости от дозы выявлено не было: для них характерен абсолютно высокий риск ИМ при приеме как низких, так и высоких доз. Один из самых высоких рисков ИМ был выявлен у эторикоксиба (ОР=1,97; 95% ДИ – 1,35–2,89) [7].
Немаловажен риск развития цереброваскулярных осложнений терапии НВПС. Результаты сравнительного исследования оригинальных препаратов целекоксиба и мелоксикама показали, что при меньшем риске ИМ целекоксиб имеет более высокий, чем мелоксикам, риск развития ишемического инсульта (ОР=1,66 [1,10; 2,51] против ОР=0,69 [0,52; 0,9]; p<0,05) [8]. Эти данные соотносятся с результатами другого проспективного исследования 7636 пациентов без инсульта в анамнезе, которые показали, что прием любых НВПС связан с риском инсульта. После корректировки показателей индекса массы тела, артериального давления, уровня холестерина и статуса курения исследователи обнаружили, что риск инсульта увеличивается в 1,58 раза для неселективных НВПС и в 2,40 раза – для ЦОГ-2 селективных НВПС [9].
Для пожилых пациентов, получаю-щих длительное лечение низкими дозами ацетилсалициловой кислоты с целью профилактики кардиоваскулярных событий, прекращение его приема (или действия) может быть чревато серьезными последствиями. В настоящее время доказано, что в отличие от неселективных НВПС мелоксикам не взаимодействует с низкими дозами аспирина и не уменьшает антитромбоцитарный потенциал последних [10]. Более того, он может применяться пациентами, у которых ранее возникали кожные аллергические или бронхоспастические реакции при использовании аспирина или других «традиционных» НВПС [11–12].
Также установлено, что мелоксикам не влияет на противоопухолевую активность доксорубицина (широко применяемый в онкологии химиопрепарат с мощным кардиотоксическим влиянием), но в то же время достоверно смягчает доксорубицин-индуцированное повышение уровня сывороточных ферментов (креатинкиназы, лактатдегидрогеназы и тропонина-I), маркеров перекисного окисления липидов, каспазы-3 и простагландина E2, а также значительно уменьшает доксорубицин-индуцированную кардиомиопатию. Другими словами, мелоксикам защищает сердце от токсичности доксорубицина, не затрагивая его противоопухолевой активности [13].
В целом благоприятный профиль безопасности в отношении сердечно-сосудистой системы оригинального мелоксикама в суточных дозах 7,5 и 15 мг был продемонстрирован при анализе 28 исследований с участием 24 196 пациентов [14]. Это предопределяет широкий круг пациентов, в т.ч. имеющих сочетанную патологию, которым препарат может быть назначен как короткими курсами, так и для длительной терапии. В то же время неселективные НВПС возможно применять исключительно короткими курсами в отношении пожилых пациентов с умеренным риском развития сердечно-сосудистых осложнений и не имеющих существенных факторов риска развития НВПС-гастропатии. При этом обязательно прикрытие ингибиторами протонной помпы. Высокоселективные НВПС применяют для кратковременного обезболивания преимущественно у молодых пациентов в отсутствие выраженной сопутствующей сердечно-сосудистой патологии и имеющих умеренно выраженный риск развития гастринтестинальных осложнений.
Начиная с 1996 г. стали появляться публикации о безопасности применения мелоксикама в дозе 15 мг/сут пациентами с ревматическими заболеваниями и коморбидной умеренной почечной недостаточностью [15]. Опубликованные в 2005 г. результаты оценки применения диклофенака, ибупрофена, мелоксикама и напроксена среди 386 916 пациентов общей практики в Великобритании в возрасте от 50 до 84 лет показали, что использование неселективных НВПС характеризуется в 3 раза бóльшим риском развития острой почечной недостаточности по сравнению с мелоксикамом (после поправки на возраст, пол, индекс массы тела и ряд сопутствующих заболеваний) [16]. Это объясняется тем, что мелоксикам меньше других НВПС влияет на скорость клубочковой фильтрации [17].
Опубликованные в 2015 г. результаты мета-анализа продемонстрировали, что прием мелоксикама ассоциировался с незначительным повышением комбинированного сердечно-сосудистого/почечного риска (ОШ=1,14; 95% ДИ – 1,04–1,25), в основном за счет сосудистого компонента (ОШ=1,35; 95% ДИ – 1,18–1,55), в отсутствие повышения кардиального (ОШ=1,13; 95% ДИ – 0,98–1,32) и почечного риска (ОШ=0,99, 95% ДИ – 0,72–1,35). В то же время у других НВПС комбинированный риск был выше и дозозависимым: рофекоксиб (ОШ=1,50; 95% ДИ – 1,36–1,66) >диклофенак (ОШ=1,47; 95% ДИ – 1,40–1,53) >индометацин (ОШ=1,46; 95% ДИ – 1,31–1,64) >целекоксиб (ОШ=1,27; 95% ДИ – 1,40–1,41) >напроксен (ОШ=1,18; 95% ДИ – 1,11–1,25) [18].
Печень – это еще один потенциальный орган-мишень при применении НВПС. Клинически НВПС-поражение печени может проявляться «трансаминитом» (транзиторным повышением уровня печеночных трансаминаз), острым гепатитом, хроническим активным гепатитом и острой фульминантной печеночной недостаточностью. Прогностически неблагоприятным признаком является желтуха: летальность таких больных составляет 25%. И хотя гепатотоксичность – явление относительно редкое (1–24 на 100 тыс. пролеченных пациентов) по сравнению с гастроинтестинальными и кожными побочными эффектами, тем не менее значительная часть случаев НВПС-индуцированной гепатотоксичности относится к тяжелым [19]. Гепатотоксичность может проявляться в любой период на фоне НВПС-терапии, однако чаще она развивается в первые 6–24 недели лечения. В связи с этим необходимо контролировать уровень трансаминаз перед началом, через неделю и через месяц (или каждый месяц) НВПС-терапии.
По данным когортного исследования 397 537 больных, получавших НВПС в 1997–2001 гг., было установлено, что частота гепатотоксичных реакций была самой низкой у мелоксикама [20].
Частота НВПС-гепатотоксичных реакций:
- Мелоксикам – 23,6 эпизода на 100 тыс. человеко-лет;
- нимесулид – 35,2 эпизода на 100 тыс. человеко-лет;
- диклофенак – 39,2 эпизода на 100 тыс. человеко-лет;
- ибупрофен – 44 эпизода на 100 тыс. человеко-лет.
В более поздних исследованиях мелоксикам, а также целекоксиб показали себя как наиболее безопасные по риску развития гепатотоксичности препараты, в то время как при лечении диклофенаком, рофекоксибом и нимесулидом чаще всего развиваются побочные эффекты со стороны печени [19], вплоть до фульминантной печеночной недостаточности на нимесулиде [21]. В экспериментальных исследованиях на животных моделях (на людях такие исследования не могут быть проведены) установлены молекулярно-клеточные механизмы его гепатотоксичности. Нимесулид изменяет трансмембранный потенциал митохондриальной мембраны, нарушает протонофорез и проницаемость мембранных пор, что вызывает необратимые морфологические и динамические изменения мембраны митохондрии [22]. Повышенная проницаемость последней для избытка ионов Са2+ усиливает свободно-радикальное окисление, что в итоге ведет к гибели клеток [23]. Есть данные, свидетельствующие, что наряду с нимесулидом терапия ацеклофенаком также ассоциирована с высоким риском поражения печени [24].
С учетом благоприятного профиля безопасности мелоксикама в последние годы активно исследуется его влияние на гепатоциты при хроническом гепатите С. В рандомизированных исследованиях показано, что препарат усиливает действие противовирусной терапии и тормозит снижение числа нейтрофилов. Это позволяет применять мелоксикам в качестве вспомогательного средства (адъювантной терапии) для лечения больных хроническим гепатитом С [25], что еще раз отражает хороший коморбидный профиль безопасности препарата.
В заключение важно отметить, что наряду с анальгетическим и противовоспалительным эффектами НВПС характеризуются широким спектром побочных эффектов, которые могут не только негативно влиять на состояние разных систем организма, но и изменять эффективность и переносимость сопутствующего лечения. Гатроинтестинальные поражения (от диспепсии до фатального кровотечения и перфораций) – частые побочные эффекты. Риск сердечно-сосудистых осложнений НВПС-терапии значительно возрастает у лиц пожилого возраста, а также у тех, у кого имеют место коморбидное сердечно-сосудистое заболевание, хроническая почечная недостаточность, ревматоидный артрит или хроническая обструктивная болезнь легких [26]. В то же время существуют и другие побочные эффекты, включая кожные и аллергические реакции, нарушение функции печени и почек. Поэтому современные рекомендации предписывают придерживаться следующего правила: минимально эффективная доза на возможно короткий период. При этом другие факторы, в первую очередь коморбидные факторы риска, должны быть учтены во время выбора терапии конкретного пациента.
Более 20 лет мелоксикам в одобренных дозах (7,5 или 15 мг/сут) с успехом применяется в лечении болевых синдромов. В рамках обсуждения выбора оптимального НВПС стоит отметить, что анальгетический эффект мелоксикама, как и других НВПС, реализуется путем снижения возбудимости периферических ноцицепторов, а также влияния на механизмы центральной сенситизации, опосредованной гиперпродукцией простагландинов при асептическом нейрональном воспалении и активацией глиальных клеток в ответ на стойкое и мощное болевое раздражение структур ноцицептивной системы [27]. В то же время мелоксикам характеризуется наиболее благоприятным спектром эффективности и безопасности [28], что особенно важно для пациентов с коморбидной патологией и/или принимающих сочетанную терапию.
В настоящее время многие исследователи выступают за более детальное изучение НВПС с целью прогноза потенциальных рисков побочных соматических эффектов. Особенно это касается новых препаратов, клинический опыт применения которых не позволяет судить об их полной безопасности. Это международная проблема. Во многих странах не организован системный мониторинг сочетанного применения различных классов препаратов [29]. Поэтому такой препарат, как Мовалис, – препарат с «хорошей историей» и большим опытом применения – до сих пор остается приоритетными при выборе сочетанной терапии и является «золотой серединой» НВПС-терапии [27].



