Введение
В последние годы активно изучается роль микронутриентов в когнитивном развитии детей. Получена существенная доказательная база по эффективности использования витаминов группы В [1], омега-3 полиненасыщенных жирных кислот (ПНЖК), магния и др. для улучшения когнитивной функции [2]. Известно, что витамин D играет важную роль в гомеостазе кальция и опорно-двигательного здоровья. Исследования, проведенные за последние 10 лет, указали на важную роль витамина D в развитии мозга, поддержании когнитивной функции и памяти [3, 4].
Результаты эпидемиологических исследований, в которых проводились измерения уровней 25(ОН)D в крови, позволяют утверждать, что в настоящее время не менее 30–50% населения в различных странах и регионах мира характеризуются низкой обеспеченностью витамином D [5–8]. Напомним, что уровни витамина 25(ОН)D в плазме крови менее 10 нг/мл соответствуют глубокому дефициту и авитаминозу, уровни 10–20 нг/мл – дефициту витамина D, уровни 20–30 нг/мл – недостаточности витамина D, а уровни более 30 нг/мл – нормальному содержанию витамина D. По данным крупномасштабных скринингов, проведенных российскими исследователями, нормальное содержание витамина D в крови (более 30 нг/мл) наблюдается менее чем у 10% российских детей разных возрастных групп [7, 8]. При этом оптимальное развитие и функционирование нейронов коры головного мозга происходят при уровнях витамина D в крови более 30 нг/мл [4].
Данные фундаментальных и клинических исследований показывают, что витамин D играет важную роль в развитии и функционировании центральной нервной системы [9, 10]. Витамин D фактически является нейроактивным стероидным гормоном, необходимым для развития мозга эмбриона, поддержания функционирования мозга у детей и взрослых. Дефицит витамина ассоциирован со снижением когнитивных способностей, нервно-психическими расстройствами (депрессия, шизофрения), повышенным риском болезни Паркинсона, болезни Альцгеймера [11].
Развитию дефицита витамина D способствуют недостаточное потребление продуктов, содержащих витамин D, ожирение, низкие уровни витамина D в материнском молоке (для новорожденных), низкая инсоляция, снижение синтеза биологически активных форм витамина D при дисфункции печени и почек и многие другие факторы [5, 6]. Кроме того, вредные пищевые привычки способствуют поддержанию долговременного дефицита витамина D. Например, потребление напитков типа колы детьми в возрасте 5 лет прогнозирует потребление питательных веществ в позднем детстве и в подростковом возрасте. Дети, потребляющие данную разновидность напитков, характеризуются более высоким потреблением простых сахаров и сниженным потреблением белка, клетчатки, кальция, витамина D, магния и калия (n=170) [12].
Далее последовательно рассмотрена роль витамина D в поддержании гомеостаза нейромедиаторов, развитии коры головного мозга, поддержании когнитивных способностей и функции памяти, а также в нормализации состояния психоэмоциональной сферы.
Нейромедиаторная роль витамина D
Витамин D является стероидным гормоном, принципиально необходимым для формирования и функционирования нейрональных систем [13]. Начиная с внутриутробного периода витамин D является важным модулятором развития мозга. Хроническая недостаточность витамина D в системе «мать–плод» нарушает программу развития центральной нервной системы у плода; повышает риск формирования психоневрологических расстройств и у плода, и у матери. Как нейростероид витамин D необходим для деления, роста и дифференциации нейронов и также оказывает нейропротективное действие.
Нейрофизиологические эффекты витамина D осуществляются прежде всего посредством геномных механизмов: взаимодействиями рецептора витамина D (VDR) с геномной ДНК. Проведенный нами ранее полногеномный биоинформационный анализ показал, что биологические роли витамина D во всех типах клеток, в т.ч. в клетках нервной системы, включают поддержание стабильности генома (в т.ч. цикла деления клетки, ремонт ДНК, реструктурирование хромосом), поддержку процессов синтеза и деградации белков, иммунитета, регулировку эмбриогенеза, энергетический метаболизм [13].
Полногеномный анализ также показал, что геномные функции витамина D включают нейростероидные роли и осуществление эффектов нейротрофических и ростовых факторов. Дефицит витамина D будет существенно утяжелять течение наследственной идиопатической невропатии (G60), в т.ч. болезни Шарко–Мари–Тута, наследственной атаксии (G11), спинальной мышечной атрофии (G12). Важность витамина D как нейростероида (т.е. нейроактивного стероидного гормона) подтверждается рядом фактов [13–21], приведенных в таблице.
Одним из важнейших нейростероидных эффектов витамина D является воздействие на биосинтез нейромедиатора дофамина. Дофамин вырабатывается в головном мозге и принципиально важен для обеспечения когнитивной деятельности. При недостаточном биосинтезе дофамина у детей отмечается замедленность когнитивных процессов (брадифрения), повышенная инертность, нарушается процесс переключения внимания с одного этапа когнитивной деятельности на другой, нарушается тонкая моторика (в частности, навыки письма) [14]. В результате снижается способность ребенка к обучению. В подростковом возрасте нормальный метаболизм дофамина существенно повышает устойчивость к формированию зависимостей (алкогольной, наркотической, никотиновой и др.).
Воздействие витамина D на биосинтез дофамина связано с активацией генной экспрессии основного фермента биосинтеза дофамина – тирозин гидроксилазы (ген ТН). Максимальное увеличение экспрессии гена ТН (в 2–3 раза) отмечено при концентрации 1,25(OH)2D около 10-8 M. Комбинированное воздействие 1,25(OH)2D3 и 20 мкМ никотина не имело аддитивного эффекта на экспрессию гена ТН, что указывает на взаимосвязь механизма активации экспрессии этого гена с никотиновыми рецепторами ацетилхолина [21]. 1,25(OH)2D3 дозозависимо защищает дофаминергические нейроны от нейротоксического действия глутамата [22].
 Активная форма витамина D защищает мозг от нейротоксических доз метамфетамина, который, как известно, приводит к снижению уровней дофамина и серотонина. У животных, получавших метамфетамин и плацебо, были отмечены значительные снижения уровней дофамина и серотонина в стриатуме и в nucleus accumbens. У животных, получавших метамфетамин и кальцитриол, это снижение существенно сократилось [23, 24]. Таким образом, дефицит витамина D создает условия для быстрого формирования зависимости и развития нейротоксических эффектов метамфетамина.
Активная форма витамина D защищает мозг от нейротоксических доз метамфетамина, который, как известно, приводит к снижению уровней дофамина и серотонина. У животных, получавших метамфетамин и плацебо, были отмечены значительные снижения уровней дофамина и серотонина в стриатуме и в nucleus accumbens. У животных, получавших метамфетамин и кальцитриол, это снижение существенно сократилось [23, 24]. Таким образом, дефицит витамина D создает условия для быстрого формирования зависимости и развития нейротоксических эффектов метамфетамина.
Кроме влияния на уровни дофамина и серотонина витамин D играет определенную роль в регулировании уровней и других моноаминовых нейротрансмиттеров. Например, экспериментальный дефицит витамина D был ассоциирован со значительным уменьшением уровней эндогенного норадреналина, причем нарушение синтеза/секреции норадреналина связано с нарушениями регуляции уровней кальция в нейронах [25]. Сниженные уровни эндогенного норадреналина ассоциированы с падением когнитивного потенциала, алекситемией, обедненным эмоциональным фоном.
Витамин D противодействует моторным и нейропсихологическим нарушениям, возникающим при повреждении дофаминергических нейронов в черном веществе головного мозга. В эксперименте витамин D ослабляет двигательные расстройства при моделировании дофаминергической нейротоксичности ротеноном посредством увеличения аутофагии поврежденных нейронов по сигнальным путям LC3 и Beclin-1 [26].
Витамин D и развитие коры головного мозга
Активированный рецептор VDR воздействует на сигнальные пути рецепторов нейротрофических и ростовых факторов (фактора роста нервов, фактора роста фибробластов, инсулина, трансформирующего фактора роста β, фактора роста эндотелия сосудов), принципиально важных для формирования сложной цитоархитектоники коры.
Внутриутробный период развития мозга и период раннего детства отличаются огромным потенциалом нейропластичности, что требует достаточного синтеза нейротрофических факторов. Воздействие витамина D на метаболизм дофамина неразрывно связано с повышением экспрессии нейротрофического фактора глии (GDnF – Glial Cells Derived neurotrophic Factor) и нейротрофического фактора мозга (BDnF – brain derivedneurotrophic factor). GDnF, в частности, имеет существенное влияние на синтез дофамина в полосатом теле [26, 27].
Нейропротекторное действие витамина D включает не только нейротрофическое действие (стимулирование синтеза/секреции нейротрофинов), но и регуляцию уровней ионов Са2+ (вовлеченных, как известно, в процессы апоптоза), антиоксидантные и нейроиммуномодуляторные эффекты [28–30]. Такое комплексное нейропротекторное действие витамина D особенно важно для детей, страдающих детским церебральным параличом, синдромом дефицита внимания с гиперактивностью и для компенсации последствий черепно-мозговой травмы. При этих заболеваниях у детей отмечаются хронически повышенный оксидативный стресс в нейронах центральной нервной системы, нарушения иммуномодуляции, недостаточная регенеративная способность мозга.
Данные фундаментальных исследований эффектов воздействия витамина D на развитие мозга подтверждаются результатами клинических исследований. Например, лонгитудинальное исследование пар мать–ребенок (n=1020) показало, что низкий уровень 25(ОН)D во время беременности повышает риск нарушений в развитии языковых способностей ребенка. Средний уровень 25(OH)D во II триместре составил 22,3 нг/мл (95% доверительный интервал [ДИ] – 5,9–68,4), 42% значений – менее 20 нг/дл.
Когнитивные и языковые показатели развития увеличивались ступенчато с увеличением уровней 25(OH)D, которые во II триместре выросли от <20 до >30 нг/дл даже после поправок на социально-экономический статус, расу, использование табачных изделий, гестационный возраст ребенка при рождении и возраст ребенка во время обследования [31].
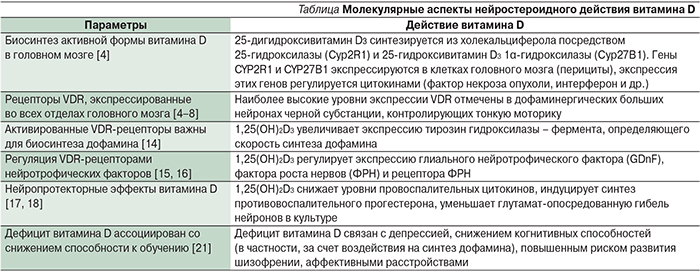
В другом исследовании измерения уровней 25(OH)D в сыворотке крови на 18-й неделе беременности (n=743) позволили установить значимые линейные корреляции между квартилями уровня витамина D у матери и нарушениями речи в 5 и 10 лет. Так, у женщин с недостаточным уровнем витамина D во время беременности (<19 нг/мл) риск рождения ребенка, у которого разовьются клинически значимые языковые трудности, был в два раза выше по сравнению с женщинами с уровнями 25(OH)D более 28 нг/мл (р<0,05) [32] (рис. 1).
Еще в одном исследовании концентрацию 25(OH)D в крови матери измеряли на 32-й неделе беременности и наблюдали младенцев в возрасте 6 месяцев (n=960). Оценка познавательной, двигательной, социально-эмоциональной деятельности и языкового развития проведена по шкалам Бэйли (3-е издание). У 60% женщин установлены 25(OH)D уровни <30 нг/мл на 32-й неделе беременности. Младенцы, рожденные женщинами с дефицитом 25(OH)D (<15 нг/мл), характеризовались сниженным баллом развития речи на -3,48 балла (95% ДИ – -5,67–-1,28) по сравнению с младенцами, рожденных женщинами с нормальным уровнем витамина во время беременности (>30 нг/мл) [33].
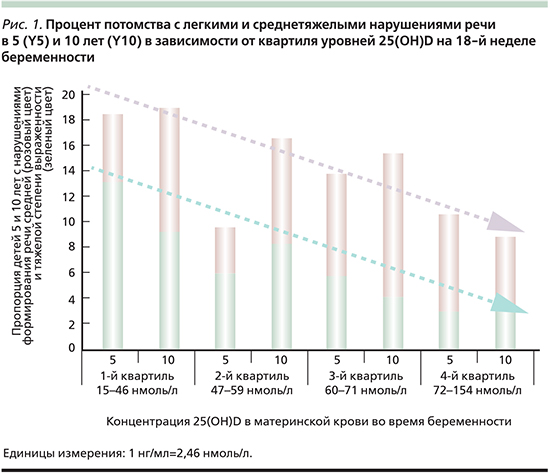
Уровни витамина D в крови пуповины связаны с нейрокогнитивным развитием малышей-«ползунков» (ребенок, ползающий и начинающий ходить, n=363, возраст – 16–18 месяцев). Индекс когнитивного развития (ИКР) и индекс психомоторного развития (ИПР) у детей раннего возраста были оценены по шкалам Бэйли для оценки развития младенцев. У детей с самыми низкими уровнями витамина D (нижний квинтиль уровней 25(OH)D в пуповинной крови) отмечен ИПР ниже на -7,6 балла (95% ДИ – -12,4–-2,82; р=0,002; рис. 2) и ИКР ниже на -8,04 балла (95% ДИ – -12,9– -3,11; p=0,001) по сравнению с 3-м квинтилем. Неожиданно у малышей в самом высоком квинтиле концентраций 25(OH)D в пуповинной крови также отмечено значительное снижение ИКР на -12,3 балла (95% ДИ – -17,9–-6,67; р<0,001) [34].
 Витамин D и когнитивные способности
Витамин D и когнитивные способности
Дефицит витамина D ассоциирован со снижением темпов нервно-психического развития детей [35], широким диапазоном неврологических и нейродегенеративных заболеваний [36]. Неврологические расстройства, связанные с дефицитом витамина D, включают нарушения мозгового кровотока [37], снижение памяти и когнитивные нарушения [38], склонность к судорогам [39]. Низкая обеспеченность витамином D отягчает течение нейродегенеративных патологий (рассеянного склероза, болезней Паркинсона и Альцгеймера, идиопатической невропатии, наследственной атаксии, спинальной мышечной атрофии) [40]. Дефицит витамина D является независимым фактором риска общего снижения когнитивных способностей у клинически стабильных пациентов на перитонеальном диализе [41].
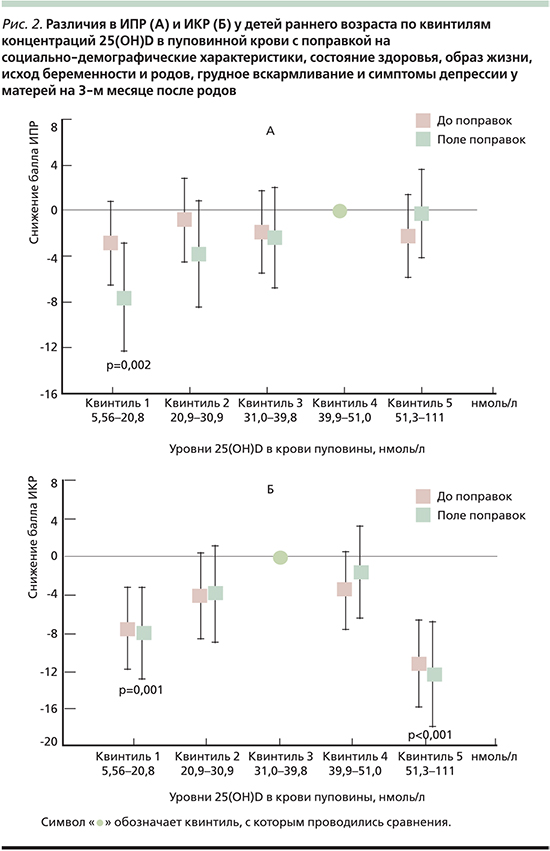
Сахарный диабет (СД) связан со снижением памяти и осложняет процесс обучения. В эксперименте дотации витамина D улучшали обучение и память в стрептозотоциновой модели диабета у мышей. Положительный эффект витамина D на когнитивный статус при СД связан, в частности, с его нейропротективными ролями [42] (рис. 3).
Экспериментальные протеомные исследования показали, что дефицит витамина D в организме матери в период роста эмбриона приводит к комплексным нарушениям экспрессии многочисленных белков в нейронах мозга. У потомства, рожденного от самок, подвергнутых дефициту витамина D во время беременности, на 10-й неделе установлены достоверные нарушения уровней 36 нейрональных белков, участвующих в энергетическом метаболизме нейронов, поддержании окислительно-восстановительного баланса, цитоскелета, кальциевого гомеостаза, синаптической пластичности и нейротрансмиссии. Системно-биологический анализ результатов этого протеомного исследования показал, что установленные нарушения экспрессии также характерны для моделей шизофрении, рассеянного склероза и митохондриальной дисфункции нейронов [43].
В эксперименте витамин D снижает связанное с возрастом гиперфосфорилирование тау-белка и улучшает результаты когнитивных тестов. Крысы в возрасте 20 (в возрасте) и 6 месяцев (молодые) были рандомизированы на прием витамина D или подкожные инъекции 1,25-дигидроксивитамина D3 в течение 21 дня. Витамин D снизил возрастное тау-гиперфосфорилирование на фоне улучшения энергетического метаболизма мозга и результатов когнитивного тестирования [44].
Результаты экспериментальных исследований были подтверждены клинико-эпидемиологическими данными. Уровни 25(OH)D в сыворотке значительно ниже у детей со сниженным умственным развитием: установлены корреляции между уровнем 25(OH)D и баллом по шкале обучения Векслера для оценки интеллекта у детей [45].
Недостаточность витамина D [25(OH)D<20 нг/мл] была ассоциирована с нарушениями нейромоторных и нейропсихологических функций у пожилых мужчин и женщин (n=463, 70–90 лет). Недостаточность витамина была ассоциирована со снижением силы верхних и нижних конечностей, замедлением времени реакции, нарушением баланса, более медленной скоростью походки, нарушениями исполнительной функции и зрительно-пространственной ориентации [46]. Низкий уровень витамина D коррелировал с когнитивными нарушениями у пациентов на гемодиализе [47], ухудшал долговременную зрительную память (тест Рея) при рассеянном склерозе [48] и был ассоциирован с алекситимией (оценка по торонтовской шкале алекситимии) [49].
Недостаточность витамина D ассоциирована с истончением коры головного мозга с возрастом. Лонгитудинальное исследование изменений толщины коры головного мозга на основе магнитно-резонансного сканирования в группе 203 здоровых людей в возрасте 23–87 лет (средний интервал наблюдения – 4 года) показало, что более высокие уровни витамина D, докозагексаеновой кислоты и физической активности тормозили истончение коры головного мозга, а более высокие уровни холестерина и повышенный индекс массы тела усугубляли истончение коры [50]. В исследовании с участием 75 пациентов было установлено, что 4-кратное повышение риска когнитивных нарушений на фоне дефицита витамина D (менее 20 нг/мл) было также ассоциировано со снижением объема различных отделов головного мозга (например, белого вещества и височных долей) [51].
Эффекты воздействия дефицита витамина D на когнитивные способности наблюдаются в различных возрастных группах. У детей с низкой успеваемостью в школе отмечены более низкие уровни 25(OH)D в сыворотке крови. Низкие уровни 25(OH)D были достоверно ассоциированы со сниженными результатами теста Бентона на визуальную память (BVRT – Benton visual retention test) [45]. В когорте пациентов, рожденных в 1958 г. (n=6496), у детей с низкими концентрациями витамина D (<10 нг/мл) отмечено достоверное ухудшение кратковременной памяти на слова [52].
Дефицит витамина D (25(OH)D<20 нг/мл) соответствует более быстрому снижению когнитивной функции с возрастом (n=2777, 70–79 лет, 4 года наблюдений). При оценке когнитивных способностей с помощью модифицированной шкалы Mini-Mental State Examination (3MS) дефицит витамина D был ассоциирован как с более низким баллом по шкале 3MS (-0,9 балла; р=0,02), так и с более быстрым снижением балла в течение 4 лет (на -1,0 балл, 95% ДИ –-1,5–-0,6; р=0,05) [53, 54].
В исследовании здоровья медсестер (n=1185, 60–70 лет) низкие уровни витамина D в плазме крови соответствовали снижению когнитивных функций. При наблюдениях в течение 9 лет низкий уровень витамина D (низший квинтиль, средние уровни 14 нг/мл) был связан со снижением комплексной оценки по всем когнитивным тестам, в среднем на 20% (95% ДИ – 8–33%; р=0,009) по сравнению с женщинами в самом высоком квинтиле концентраций (среднее – 38,4 нг/мл) [55].
Систематический обзор связи между витамином D и когнитивными способностями включил 25 кросс-секционных и 6 проспективных исследований. На фоне дефицита витамина установлено достоверное снижение результативности когнитивных и функциональных тестов и более высокая частота развития деменции. Проспективные исследования со средним сроком наблюдения 4–7 лет показали более высокий риск когнитивных нарушений у участников с исходно более низким уровень витамина D [56]. Таким образом, результаты этих клинико-эпидемиологических исследований указывают на перспективность использования витамина D для профилактики снижения когнитивных способностей.
Витамин D и функция памяти
Гиппокамп и его зубчатая извилина имеют большое значение для поддержки функции памяти. В эксперименте дефицит витамина D связан со снижением долгосрочной потенциации гиппокампа [57], ухудшает пространственное обучение взрослых крыс (нахождение скрытой платформы водного лабиринта) [58] и ухудшает другие результаты неврологического тестирования.
Например, витамин-D-дефицитная диета (<10 нг/мл, 6 недель) у 10-недельных крыс приводила к снижению результатов тестов на реакцию (шкала 5C-SRT) и производительность (шкала 5C-CPT). На фоне дефицита витамина D отмечено увеличение базовых уровней ГАМК (γ-аминомасляная кислота) в стриатуме, что указывает на изменения в системах, регулирующих компульсивное поведение и поиск вознаграждения [59]. Витамин D3 опосредует возрастные воспалительные изменения в гиппокампе, действуя как противовоспалительное средство и тормозя возрастное увеличение активации микроглии и параллельное увеличение уровней интерлейкина-1β [60].
Пренатальный дефицит витамина D связан с нарушениями синаптической пластичности в зубчатой извилине у взрослых крыс. В частности, пренатальный дефицит витамина приводил к значительному ухудшению латентного торможения и нарушениям долгосрочного потенцирования. Эти нарушения, ассоциированные с пренатальным дефицитом витамина D, отчасти компенсировались использованием нейролептика галоперидола, что и указывает на нарушения синаптической пластичности гиппокампа на фоне дефицита витамина D [61].
Витамин D улучшает память и настроение у пациентов с болезнью Паркинсона (n=286). Установлены корреляции между дефицитом витамина D, снижением плавности речи (р<0,001) и вербальной памяти (р=0,0083) по шкале Hopkins Verbal Learning Test, повышением баллов по гериатрической шкале депрессии GDS – Geriatric Depression Scale (р=0,0083) [62].
Все нейродегенеративные заболевания в той или иной мере характеризуются снижением мнестической функции мозга. Рецепторы витамина D оказывают нейропротекторное и нейротрофическое действия, в т.ч. снижение отложений амилоидных бляшек – отличительная черта болезни Альцгеймера (БА) [63]. Биологические эффекты витамина D противодействуют патофизиологии БА, включая осаждение β-амилоида, воспаление, нарушения кальциевого гомеостаза и баланса кортикостероидов в корковых зонах и гиппокампе [64], возрастное снижение памяти и когнитивных способностей за счет снижения избыточного воспаления и отложений амилоида [65]. Экспериментальные исследования показали, что витамин D3 (кальцитриол) снижает накопление амилоида в мозге и улучшает когнитивные параметры в экспериментальных моделях БА (линии Tg2576 и TgCRND8 с избыточной экспрессией амилоидного белка). Лечение 1,25-дигидроксивитамином повышало уровни р-гликопротеина и снижало уровень амилоида в тканях мозга, особенно в гиппокампе [66].
Витамин D и психоэмоциональная сфера
Дефицит витамина D усугубляет течение неврологических заболеваний и ухудшает восстановление мозга после стресса, поэтому дефицит витамина D связан с широким спектром нервно-психических расстройств [67]. И наоборот, хронический непредсказуемый стресс воздействует на метаболизм витамина D в гиппокампе и миокарде [68].
Недостаточность витамина D отмечена у психиатрических пациентов. При скрининге пациентов, поступивших в психиатрическое отделение больницы (n=544), средний уровень витамина D при поступлении составил всего 22 нг/мл (4–79 нг/мл), а недостаточность витамина D (<30 нг/мл) была обнаружена у 75% пациентов [69].
У детей с синдромом дефицита внимания с гиперактивностью (n=37, 6–12 лет) уровни витамина D в сыворотке были значительно ниже (19,1±10,10 нг/мл), чем в контрольной группе (28,67±13,76 нг/мл; p<0,001) [70]. Прием витамина D улучшает психоэмоциональное состояние девушек-подростков с предменструальным синдромом на фоне тяжелого дефицита витамина D [71].
В эксперименте дефицит витамина D во время беременности приводит к увеличению импульсивного поведения потомства на фоне отсутствия ингибирующего контроля [72]. Такое сочетание признаков типично для когнитивного дефицита при шизофрении. У пациентов с шизофренией отмечены достоверно более низкие концентрации витамина D в сыворотке крови (15,0±7,3 нг/мл; n=50) по сравнению с пациентами с депрессией (19,6±8,3 нг/мл; n=30) и с контрольной группой (20,2±7,8 нг/мл; р<0,05; n=50) [73].
Высокая частота встречаемости дефицита витамина D отмечена у лиц с установленными психотическими расстройствами. Исследование случай–контроль пациентов с первым эпизодом острого психоза (n=69) и контрольной группы (n=69) показало, что дефицит витамина D в 3 раза чаще встречался именно среди пациентов (р<0,001) [74].
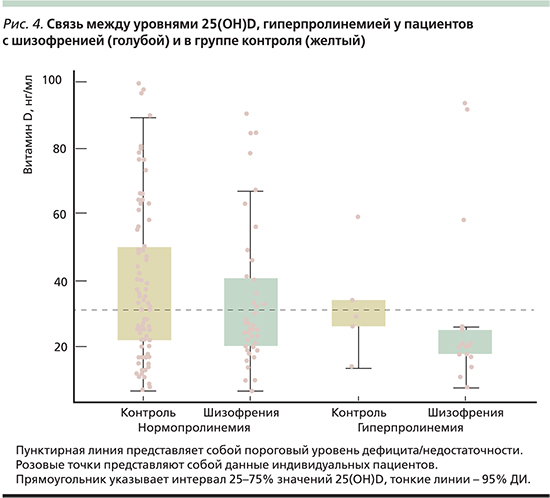
Низкие уровни 25(OH)D ассоциированы с большей восприимчивостью к шизофрении. В частности, витамин D является мощным активатором транскрипции гена пролиндегидрогеназы (PRODH), который находится на локусе 22q11 22-о1 хромосомы и ассоциирован с самым высоким из известных генетических рисков шизофрении. Пролиндегидрогеназа катализирует катаболизм пролина, который является нейромодулятором глутаматеэргических синапсов. Гиперпролинемия ассоциирована со снижением IQ, когнитивными нарушениями и шизофренией.
Ассоциации между уровнями 25(OH)D и шизофренией были исследованы у 64 пациентов и 90 участников контрольной группы. У пациентов уровни 25(OH)D были значительно ниже и дефицит 25(OH)D был связан с шизофренией (ОР=2,1, 95% ДИ – 1,0–4,5; р=0,044). Кроме того, участники с низкими уровнями 25(OH)D характеризовались в 3 раза (95% ДИ – 1,08–8,91) более высоким риском гиперпролинемии (р=0,035; рис. 4), которая является часто встречающимся симптомом при шизофрении [75].
Дефицит витамина D является вероятным фактором риска расстройств аутистического спектра [76]. Дети с расстройствами аутистического спектра характеризуются сложностями в обучении на фоне большей частоты встречаемости дефицита витамина D [77].
Обеспеченность витамином D способствует нормализации перепадов настроения в осенне-зимний период. Крайняя форма сезонной зависимости настроения проявляется как клинический синдром сезонного аффективного расстройства с углеводной «жаждой», гиперсомнией, вялостью и нарушениями циркадных ритмов. В небольшом рандомизированном исследовании здоровые добровольцы (n=44) получали по 400 или 800 МЕ/сут в течение 5 дней в конце зимы, что сопровождалось значительным улучшением настроения по сравнению с контролем [78]. Витамин D может быть использован для лечения сезонных аффективных расстройств (состояние пациентов оценивалось по опроснику сезонных расстройств SPAQ-SAD – Seasonal Pattern Assessment Questionnaire-Seasonal Affective Disorder) [79].
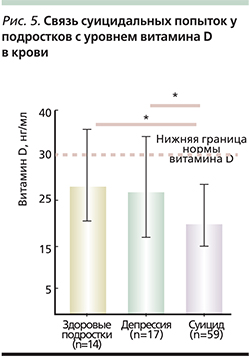
Низкий уровень 25(ОН)D3 у подростков коррелирует с частотой суицида и депрессией. Обращает на себя внимание то, что при обследовании 59 подростков, переживших попытку самоубийства, ни у одного из них не было отмечено нормы витамина D в крови! У 7% подростков, переживших попытку самоубийства, был отмечен уровень витамина D менее 10 нг/мл (соответствует авитаминозу), у 58% – менее 20 нг/мл (рис. 5) [80].
Витамин D ослабляет персеверативное поведение (настойчивое повторение ошибочных действий), связанное с фетальным алкогольным синдромом. В эксперименте холекальциферол давался до, во время и после воздействия алкоголя на плод в III триместре. Тестирование новорожденных крысят на пространственное обучение показало, что воздействие этанола приводит к значительному увеличению числа ошибок по сравнению с контрольной группой. Лечение холекальциферолом дозозависимо снижало персеверативное поведение, связанное с развитием воздействия алкоголя [81].
У пациентов, перенесших инсульт, установлена ассоциация между уровнями 25-гидроксивитамина D сыворотки с депрессией (критерии DSM-IV – Diagnostic and Statistical Manual of mental disorders). Через 6 месяцев после инсульта у 91 (37%) пациента была диагностирована депрессия, причем в этой группе пациентов уровни 25(OH)D были существенно ниже (8,3 нг/мл, 95% ДИ – 6,8–9,5), чем у пациентов без депрессии (16 нг/мл, 95% ДИ –13–20; р<0,001). Уровни 25(OH)D менее 11,2 нг/мл соответствовали повышению риска депрессии в 10 раз (ОР=10,32, 95% ДИ – 4,97–28,63; р<0,001) [82].
О коррекции дефицита витамина D у детей
В педиатрии и терапии гораздо более востребованы препараты витамина D3, в частности холекальциферол, который, являясь провитамином (пролекарством), конвертируется в активную форму гормона (кальцитриол) в необходимых организму количествах. Препараты на основе холекальциферола делятся на две группы: витамин D3 в масляном растворе и водный раствор мицеллированного витамина D3.
Мицеллированная форма витамина D3 [83] важна потому, что физиологическое усвоение витамина D3 в кишечнике происходит только при участии желчных кислот (что подразумевает образование мицелл). Сниженная секреция желчных кислот резко снижает усвоение витамина D (в т.ч. из масляных растворов) и других жирорастворимых витаминов. Мицеллированные («водорастворимые») растворы витамина D (холекальциферол) обеспечивают хорошую степень всасывания практически во всех возрастных группах пациентов (дети, взрослые, пожилые) с минимальной зависимостью от состава диеты, приема препаратов, состояния печени и биосинтеза желчных кислот.
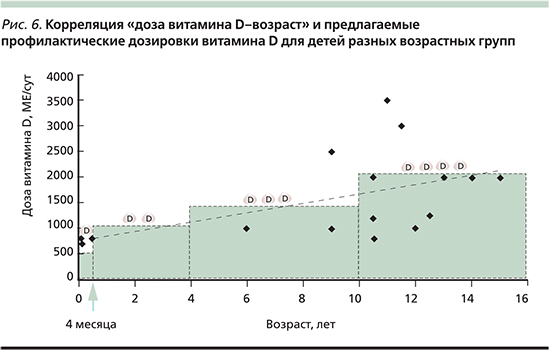
Неврологические применения витамина D подразумевают долговременный прием препаратов (не менее 6–12 месяцев). Проведенный ранее анализ данных результативных клинических исследований позволил сформулировать следующую ступенеобразную схему назначения витамина D: дети до 4 месяцев нуждаются в ежедневном приеме 500 МЕ/сут витамина D (для недоношенных – 800–1000 МЕ/сут); дети от 4 месяцев до 4 лет – 1000 МЕ/сут; от 4 до 10 лет – 1500 МЕ/сут, а старше 10 лет – 2000 МЕ/сут в течение всего года без перерыва на летние месяцы (рис. 6). При использовании такого рода режимов приема препарата (длительность курса, суточная доза) не наблюдается побочных эффектов [4].
Заключение
Многогранное действие витамина D на развитие и функционирование центральной нервной системы отражается на когнитивных, мнестических способностях и на эмоциональной сфере. Нейростероид витамин D способствует выживанию сетей нейронов при стрессовом воздействии. Развитые нейрональные сети – необходимое условие для формирования ассоциативного мышления, беглости речи, успешного обучения. Поэтому достаточная обеспеченность витамином D не только необходима во внутриутробном периоде и раннем детстве, но и принципиально важна для развития способности к обучению, ассоциативного мышления, формирования тонкой моторики в школьном возрасте. Наоборот, низкая обеспеченность витамином D усугубляет сезонные колебания настроения, депрессивные состояния, повышает риск суицида, способствует формированию персеверативного ошибочного поведения, способствует формированию болезней, зависимости и неустойчивого психоэмоционального поведения.



