Среди больных ревматоидным артритом (РА) довольно широко распространены не только коморбидные заболевания, но и их факторы риска. Наличие поливалентной патологии у больных РА может значительно ухудшить их качество жизни (КЖ). Наиболее часто у пациентов РА выявляются коморбидные состояния (например, вторичный остеопороз и др.) вследствие лечения основного заболевания («индексного»), особенно при приеме глюкокортикоидов (ГК). Хроническое активное воспаление также является предрасполагающим фактором развития полиморбидности [1].
Причины того, почему возникает вторичный остеоартроз (ОА), изучены недостаточно. Его, как правило, вызывает сочетание неблагоприятных факторов, влияющих на состояние суставной ткани и организма человека в целом. В ряде случаев его провоцирует хроническая болезнь суставов. Например, РА часто запускает процесс разрушения суставных тканей. Подобный результат может возникать, если у человека есть любая из деформаций суставного конца кости. Вторичный ОА вызывает системное метаболическое заболевание, и тогда поражаются преимущественно хрящевые ткани. При ОА наиболее часто выделяют интерлейкин-1β (ИЛ-1β), ИЛ-6, ИЛ-17, фактор некроза опухоли α (ФНО-α), лейкемический ингибирующий фактор. Из них, по данным J.P. Pelletier (1993), основными медиаторами, приводящими к деструкции хрящевых покровов, служат ИЛ-1β и ФНО-α, что также подтверждается результатами многочисленных исследований [2, 3].
Исходя из вышеизложенного и с учетом того факта, что часто РА и ОА могут быть коморбидными заболеваниями, в их патогенезе наблюдаются единые взаимосвязанные механизмы, среди которых большее значение придается медиаторам воспаления. ИЛ-1β, ФНО-α, оксид азота, простагландины (ПГ), показатели перекисного окисления липидов (ПОЛ) и др. можно обнаружить в синовиальной жидкости, а также выявить при исследовании хряща, субхондральной кости, синовиальной оболочки. Анализ отечественных и зарубежных исследований доказывает роль вышеперечисленных медиаторов воспаления в деструкции костной ткани и дальнейшей деградации суставного хряща [4–7].
Одним из препаратов, обладающих ингибирующим действием на выработку и активность ИЛ-1, является диацереин – ацетилированная форма реина. J. Martell-Pelletier и соавт. доказали ингибирующее действие диацереина и его активного метаболита реина не только на уровень синтеза ИЛ-1, но и на экспрессию рецепторов к цитокину на поверхности хондроцитов при ОА. В результате происходит снижение чувствительности клеток к патологическому влиянию ИЛ-1 [8].
Материал и методы
В клиническое исследование включили 248 больных вторичным ОА на фоне РА. Пациенты, подписавшие информированное согласие на участие в исследовании, были разделены на четыре группы. Пациенты I группы прошли 2-недельный курс лазерной терапии на фоне комбинации ингибитора ИЛ-1 и метотрексата; больные, вошедшие в группу II, получали базисную терапию в комбинации с ингибитором ИЛ-1; в III группе больные получали метотрексат и лазерную терапию, а пациенты группы контроля находились на базисной терапии.
Все пациенты в сравниваемых группах были сопоставимыми по возрасту (в среднем 50 лет), длительности основного заболевания (5–15 лет), активности «индексного» заболевания по DAS28 – Disease Activity Score 28 (II степень); диагноз РА уста-навливали в соответствии с критериями ACR (American College of Rheumatology, 1987) и EULAR (European League Against Rheumatism, 2010) [9, 10].
Среди ингибиторов ИЛ-1 был выбран диацереин (по 50 мг 2 раза в сутки), метотрексат стационаре с использованием низкоинтенсивного лазерного излучения (НИЛИ) по традиционной методике методом надвенного лазерного облучения крови и накожно в области проекции коленных суставов последовательно по полям. Курс включал ежедневные процедуры, длительность экспозиции на поле – 1–2 минуты.
Критерии исключения из исследования связаны с противопоказаниями к назначению метотрексата и ингибитора ИЛ-1 с учетом рекомедации Федерального агентства по фармаконадзору (FDA – Food and Drug Administration) [11].
Эффективность лечения в сравниваемых группах оценивали через 3 и 6 месяцев терапии.
Статистическая обработка результатов проведена с использованием статистического пакета Statistica 10 фирмы StatSoft, результаты представлены как средние±стандартная ошибка.
Результаты и обсуждение
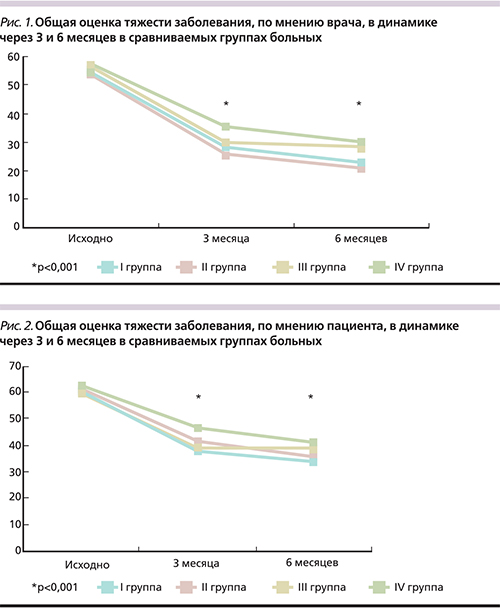
Через 3 месяца наблюдения статистически значимая динамика общего состояния больных по визуальной аналоговой шкале (ВАШ), по оценке специалиста, в I и во II группах на фоне применения ингибитора ИЛ-1 в комплексном лечении вторичного ОА у больных РА составила практически 50% от исходных значений. Немного уступили результаты в III и IV группах больных, хотя различия по сравнению с исходными показателями были статистически достоверными (p<0,001). При сравнении результатов в I и II группах больных по сравнению с III и IV отмечены значимые различия (p<0,05) (рис. 1).
Пациенты до лечения оценили тяжесть своего состояния в среднем на 5 мм выше во всех группах по ВАШ по сравнению с мнением врача. Динамика показателей через 3 месяца лечения в I и II группах составила 36% (p<0,001) и 33% (p<0,001) соответственно. При сравнении результатов пациенты отметили высокую эффективность терапевтического подхода с использованием ингибитора ИЛ-1 на фоне базисного лечения. В I и III группах больные отметили высокий эффект лечения, связанный с отсроченным эффектом курса лазерной терапии, примененной в этих группах. Вместе с тем статистически достоверные различия зафиксированы между показателями I и IV групп (p<0,05), что подтверждает преимущество использования курса лазерной терапии в комбинации с ингибитором ИЛ-1 на фоне базисного лечения по отношению к монотерапии метотрексатом (рис. 2).
Через 6 месяцев лечения во всех группах отмечено улучшение общего состояния, по мнению врача, что подтверждалось статистически достоверной динамикой: в I и II группах результаты достигли 22,34±0,93 (p<0,001) и 21,17±0,8 (p<0,001), что в динамике составило 59 и 61% соответственно. Положительное влияние лечения на общее состояние отмечено также пациентами I и II групп: уменьшение до 34,19±1,07 (p<0,001) и 35,75±1,42 (p<0,001) соответственно. Мнение специалиста в отношении эффективности лечения в III и IV группах также статистически достоверно (p<0,05) отличалось от мнения пациента: 28,32±0,93 (p<0,001) и 29,77±1,2 (p<0,001) против 38,87±1,37 (p<0,001) и 40,86±1,02 (p<0,001) соответственно. Отмечено статистически достоверное преимущество результатов лечения в I группе по сравнению с группой IV (p<0,001) (рис. 1, 2).
Таким образом, новый терапевтический подход с применением ингибитора ИЛ-1 в лечении вторичного ОА у больных РА на фоне базисной терапии достоверно эффективнее монотерапии метотрексатом по мнению как врача, так и пациента.
Не менее значимые результаты получены при оценке утренней скованности (рис. 3). Через 3 месяца терапии отмечено статистически достоверное уменьшение продолжительности утренней скованности в сравниваемых группах (p<0,05), однако значимые преимущества (p<0,05) отмечены в I группе больных, отражающие эффективность применения ингибитора ИЛ-1 и НИЛИ в комплексном лечении вторичного ОА у больных РА (рис. 3).
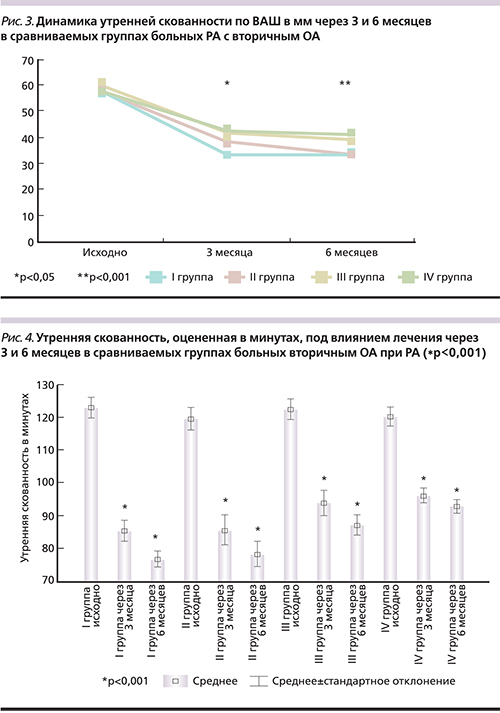
Шестимесячный курс лечения позволил значительно уменьшить продолжительность утренней скованности во всех группах сравнения. По отношению к исходным значениям отмечены статистически достоверные различия (p<0,001). Сравнительный анализ полученных результатов показал статистически достоверное преимущество (p<0,05) использования ингибитора ИЛ-1 в комплексном лечении вторичного ОА у больных РА. Достоверность различий I и II по отношению к III и IV группам составила p<0,05. Включение в комплексное лечение лазерной терапии не имело значимых преимуществ (рис. 3).
Полученные результаты динамики утренней скованности в минутах подтвердили значения, оцененные по ВАШ. Через 3 месяца лечения статистически достоверное преимущество было отмечено в I группе больных, которые помимо ингибитора ИЛ-1 на фоне базисного лечения прошли 2-недельный курс лазерной терапии. Значимые отличия зарегистрированы между I и II–IV группами (p<0,05) (рис. 4).
К концу 6-го месяца лечения показатели утренней скованности в I и во II группах больных статистичеcки достоверно отличались от результатов III и IV групп (p<0,05). При этом статистически высокодостоверные результаты отмечены у пациентов всех групп по сравнению с исходными значениями (p<0,001) (рис. 4).
Таким образом, применение ингибитора ИЛ-1 на фоне базисной терапии способствует уменьшению утренней скованности, оцененной в минутах и по ВАШ в мм у больных РА с вторичным ОА. Через 6 месяцев лечения мы отмечаем статистически достоверные преимущества по сравнению с монотерапией метотрексатом (в комбинации с лазерной терапией или без). Положительный терапевтический эффект 2-недельного курса лазерной терапии на фоне комбинации диацереина и метотрексата через 3 месяца способствовал достоверному уменьшению продолжительности утренней скованности в минутах и по ВАШ по сравнению как с исходными значениями, так и по отношению к остальным группам (II, III, IV).
Появившийся в последние годы препарат диацереин, являясь ингибитором ИЛ-1, уже доказал свою клиническую эффективность во многих многоцентровых исследованиях.
В настоящее время диацереин является перспективным препаратом для лечения различных форм ОА.
Несколько клинических исследований доказывают преимущества применения диацереина по сравнению с плацебо и нестероидными противовоспалительными средствами в отношении снижения боли и улучшения функционального состояния коленных и тазобедренных суставов [12, 13]. В исследовании А.В. Наумова отмечен плейотропный эффект диацереина, заключающийся во влиянии препарата на маркеры системного воспаления, что повышает эффективность лечения в комплексной терапии коморбидных пациентов [14].



