Введение
Кислотозависимые заболевания (КЗЗ) представляют одну из наиболее распространенных групп среди болезней органов пищеварения. К ним относят язвенную болезнь, гастроэзофагеальную рефлюксную болезнь (ГЭРБ), НВПС (нестероидные противовоспалительные средства)-эрозивно-язвенные гастропатии, синдром Золлингера–Эллисона и др. Оптимальный выбор лекарственных средств является непростой задачей с учетом высокой распространенности заболеваний, преморбидный фон, возможные побочные эффекты.
За последнее столетие подход к лечению данной категории больных претерпел значительные изменения. Антисекреторная терапия берет начало с применения растительных препаратов, обладающих холинолитическими свойствами, характеризующимися невысокой антисекреторной активностью. В первой половине ХХ в. английские ученые Henry Dale и George Barger удостоены Нобелевской премии за исследования, приведшие к открытию гистамина, что положило начало к разработке новой группы лекарственных средств. После установления прямой связи между внутривенным введением гистамина и язвенным поражением слизистой оболочки желудка стала ясной роль гистамина в регуляции желудочной секреции. Долгие исследования в этой области привели к появлению первых Н2-блокаторов во второй половине ХХ в., за что James Black в 1988 г. был удостоен Нобелевской премии. Эра Н2-блокаторов ознаменовалась разработкой 5 поколений препаратов (циметидин, ранитидин, фамотидин, низатидин, роксатидин), из которых наибольшее признание получили препараты 2-го и 3-го поколений ввиду их высокой эффективности, приемлемой цены, низкого профиля побочных эффектов и низкой частоты приема [1–3].
Через несколько лет появившиеся данные о H+-K+-АТФазе, получившей название «протонный насос», перевернули представления о механизмах желудочной секреции и привели к рождению новой группы препаратов, ингибирующих продукцию соляной кислоты на уровне мембраны париетальных клеток, именуемых «ингибиторами протонной помпы» (ИПП) – наиболее эффективных и безопасных антисекреторных препаратов [2, 3].
 В 1975 г. выходит первый промышленный образец ИПП – тимопразол, ставший предшественником омепразола, выпущенного четырьмя годами позднее. В настоящее время в нашей стране известно 5 представителей ИПП – омепразол, лансопразол, пантопразол, рабепразол, эзомепразол [2–4].
В 1975 г. выходит первый промышленный образец ИПП – тимопразол, ставший предшественником омепразола, выпущенного четырьмя годами позднее. В настоящее время в нашей стране известно 5 представителей ИПП – омепразол, лансопразол, пантопразол, рабепразол, эзомепразол [2–4].
Все ИПП являются производными бензимидазола и имеют близкое химическое строение. ИПП отличаются только структурой радикалов на пиридиновом и бензимидазольных кольцах. Механизм действия различных ИПП одинаков за исключением фармакодинамики и фармакокинетики [2, 4, 5].
До недавнего времени данная группа препаратов относилась к безопасной, имеющей минимальное число побочных эффектов и высокую приверженность применения. Однако на сегодняшний день в эру доказательной медицины представления об ИПП несколько изменились. Они обладают рядом побочных эффектов: снижение всасывания витамина В12, витамина С, кальция, магния, железа, развитие инфекционных осложнений, новообразований, поражение почек, на фоне приема ИПП с рядом кардиологических препаратов увеличивается риск развития желудочно-кишечных кровотечений, а при отмене препаратов нередко встречается рикошетная гиперсекреция соляной кислоты [6–9].
Клиническое наблюдение
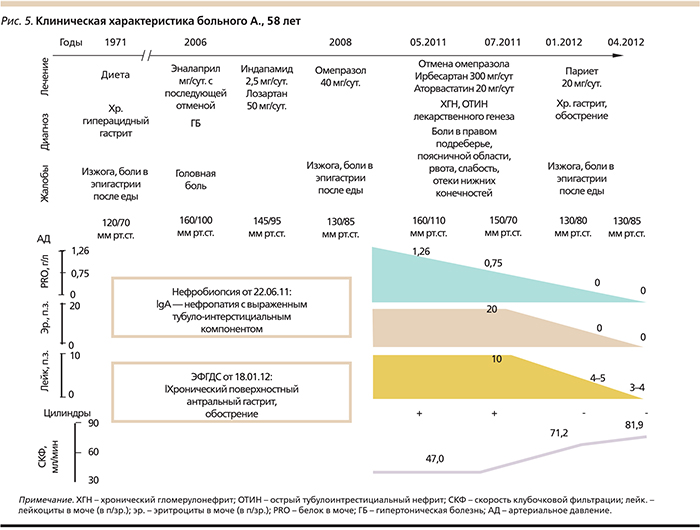
Пациент А 58 лет, мужчина, обратился к нефрологу с жалобами на боли в поясничной области, общую слабость, недомогание, повышение артериального давления до 160/110 мм рт.ст., отечность нижних конечностей.
Семейный анамнез – артериальная гипертензия, инфаркт миокарда у матери. Аллергия на препараты йода.
В течение 15 лет страдает изжогой, отрыжкой кислым содержимым и воздухом, эпизодами болей за грудиной, связанных с приемом пищи. Ухудшение состояния, связанное с усилением интенсивности и частоты симптоматики в течение последних 7 лет. При дообследовании диагностированы эндоскопические и рентгенологические маркеры гастроэзофагеальной рефлюксной болезни, скользящей хиатальной кардиальной грыжи, хронического гастрита. Эпизодический прием антацидов и ИПП сопровождался купированием симптомов. Однако в течение последних 3 лет отметил учащение изжоги и болей за грудиной, что было связано с особенностями профессиональной деятельности и характером пищевого поведения.
В связи с отсутствием эффекта от кратковременного приема антацидов и ИПП пациент перешел на постоянный режим терапии ИПП. В течение 2,5 года регулярно принимал омепрозол в суточной дозе дозе 20 мг/сут.
Артериальная гипертензия диагностирована 5 лет назад (максимальные цифры артериального давления – АД 160/100 мм рт.ст.), по поводу чего сначала принимал эналаприл без достижения целевых уровней АД с переходом на лозартан+индапамид со стабилизацией АД (130/85 мм рт.ст.). Месяц назад отметил боли в правом подреберье, поясничной области, рвоту, общую слабость, недомогание, повышение АД до 160/110 мм рт.ст. при неизменной антигипертензивной терапии, отечность нижних конечностей. При лабораторном обследовании выявлена микрогематурия (до 20 измененных эритроцитов в поле зрения – п/зр.), лейкоцитурия (до 10 в п/зр.), протеинурия до 1,26 ‰. Для уточнения диагноза пациенту выполнена нефробиопсия.
Объективно: пациент повышенного питания (индекс массы тела=29,8 кг/м2). Кожные покровы влажные, эластичные, бледные, тургор нормальный, высыпаний нет. Отмечается отеки стоп(+). При аускультации легких – дыхание везикулярное, хрипы отсутствуют. Частота дыхательных движений – 18 в минуту. Границы сердца не расширены. При аускультации сердца тоны приглушены, ритмичны, частота сердечных сокращений 70 ударов в минуту, патологические шумы отсутствуют. Систолическое АД 150 мм рт.ст., диастолическое АД 80 мм рт.ст. Живот при пальпации мягкий, безболезненный. Печень у края реберной дуги. Стул нерегулярный, склонный к запорам. Почки не пальпируются, симптом поколачивания слабоположительный с обеих сторон. Мочеиспускание свободное, безболезненное. Диурез адекватный до 2000 мл/сут.
Лабораторно: повышение эозинофилов периферической крови до 6%, скорости оседания эритроцитов до 20 мм/ч, креатинина крови до 0,141ммоль/л (скорость клубочковой фильтрации – СКФ по CKD-EPI – Chronic Kidney Desease Epidemiology Collaboration=47,0 мл/мин), снижение удельного веса мочи до 1005, суточная протеинурия – 0,75 г/сут, единичные гиалиновые цилиндры, гематурия до 20 измененных эритроцитов в п/зр., лейкоцитурия до 10 в п/зр., повышение уровня общего холестерина до 5,88 ммоль/л за счет липопротеидов низкой плотности – 3,35 ммоль/л, а также повышение уровня триацилглицеридов до 2,64 ммоль/л.
Ультразвуковое исследование (УЗИ) почек от 12.07.2011: левая почка – размеры 129×57 мм, форма обычная, контуры четкие, ровные, паренхима 22 мм, умеренно неоднородная, кортикомедулярная дифференциация сохранена, пирамидки подчеркнуты до 10 мм; правая почка – размеры 120×52 мм, форма обычная, контуры четкие, ровные, паренхима 21 мм, неоднородная, кортикомедулярная диффернциация сохранена, пирамидки подчеркнуты до 9 мм, в нижней трети кальцинат 3×2 мм, чашечно-лоханочная система (ЧЛС) не расширена.
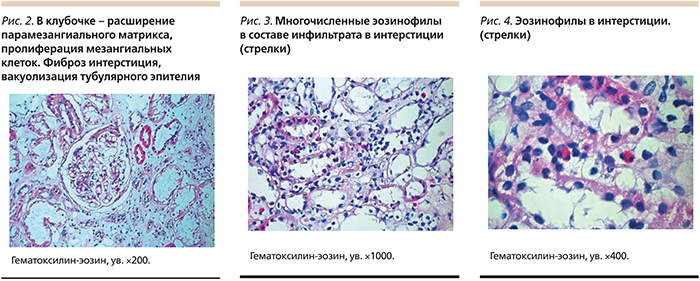
Результат биопсии от 22.06.2011. Светооптически: 16 клубочков, из них два – полностью склерозированы, в большинстве клубочков слабое расширение парамезангиальных участков базальных мембран без выраженной гиперклеточности, в отдельных клубочках – сегментарная гиперклеточность (рис. 1). Интерстиций значительно расширен за счет диффузно-очагового фиброза, имеется умеренная диффузная и плотно-очаговая лимфо- и гистиоцитарная инфильтрация интерстиция. Резко выраженная гидропическая дистрофия эпителия канальцев вплоть до вакуолизации клеток, единичные цилиндры в просвете канальцев, стенки артерий утолщены, гиалинизированы (рис. 2), окраска на амилоид отрицательная.
Иммунно-морфологически: отложение иммуноглобулина А (IgA) в клубочках положительное зернистое, линейно-прерывистое, в канальцах – отрицательное; С3-комплимент – зернистое в клубочках, яркое в стенке артериол, κ – слабое, зернистое в клубочках, λ – слабое зернистое в клубочках. IgG и IgM в клубочках и канальцах – отрицательное.
Электронно-микроскопически: в клубочках умеренная пролиферация мезангиальных клеток с очагами завершенной интерпозиции их пролиферирующих отростков в базальные мембраны. Депозиты плотные, парамезангиальные, очаги распластывания малых отростков подоцитов. В интерстиции – тучные клетки, эозинофилы в составе инфильтрата (рис. 3, 4).
Обсуждение
Диагноз хронического мезангиопролиферативного гломерулонефрита с отложением IgA (IgA-нефропатия) несомненно, однако обращают на себя внимание некоторые морфологические и клинические изменения, свидетельствующие о дополнительном патологическом процессе. Например, достаточно острое начало с резким повышением АД, уровня креатинина крови, интоксикационным синдромом. Наличие лейкоцитов в общем анализе мочи не совсем характерны для IgA-нефропатии. Морфологически обращает на себя внимание умеренное поражение гломерулярного аппарата почек (процент склероза не превышает 12,5%) и выраженного поражения тубулоинтерстиция (интерстиций значительно расширен за счет диффузно-очагового фиброза, умеренная лимфо-гистиоцитарная инфильтрация, гидропическая дистрофия эпителия канальцев вплоть до вакуолизации клеток), кроме того, в состав инфильтрата в интерстиции входят эозинофилы и тучные клетки. Если обратить внимание на УЗИ почек, то мы увидим утолщенную паренхиму с подчеркнутыми пирамидками и кальцинат в паренхиме правой почки.
Все вышеуказанное предполагает наличие тубулоинтерстициального нефрита. Отсутствие признаков бактериального воспаления, симптомов системных заболеваний заставляют задуматься о лекарственном поражении почек. Необходимо рассмотреть вопрос: мог ли длительный прием омепрозола привести к почечному повреждению?
Одним из редких, но серьезных побочных эффектов применения ИПП является острый тубулоинтерстициальный нефрит (ОТИН). Первое сообщение о развитии ОТИН вследствие приема омепразола датируется 1992 г. [10]. В 2004 г. появились сообщения о поражении почек после приема пантопрозола [11] и лансопрозола [12], а в 2005 г. – рабепрозола [13] и эзомепрозола [14]. Это говорит об общем влиянии данной группы препаратов на развитие почечной патологии. На сегодняшний день отсутствуют сведения о развитии ОТИН при употреблении декслансопрозола, что, вероятнее всего, связано с новизной и ограниченностью использования данного препарата. В Российской Федерации декслансопразол зарегистрирован с 2014 г.
Распространенность
Частота развития ОТИН вследствие применения ИПП, по результатам популяционных исследований, составляет 5 на 100 тыс. пациентов, принимающих препараты данной группы [15]. На сегодняшний день зарегистрировано более 500 случаев ОТИН в результате приема ИПП. Однако многие авторы подчеркивают наличие бессимптомных форм, распространенность которых в 1,5 раза превышает число случаев, сопровождающихся острым почечным повреждением [16]. При рассмотрении относительного риска данный показатель колеблется в пределах 3,2–5,16, по данным различных исследований [15, 17]. Если рассматривать риск развития поражения почек в зависимости от различных ИПП в группе, то результатом исследований международного центра по мониторингу лекарственных средств Всемирной организации здравоохранения (ВОЗ), лидерами по риску развития ОТИН являются омепрозол и пантопрозол (относительный риск – ОР=9,4, 95% доверительный интервал [ДИ] – 7,8–9,4; ОР=9,0, 95% ДИ – 5,4–15,0 соответственно) [18]. В связи с этим интересны результаты 18-летнего исследования Angela K. Muriithi и соавт. (2014), основанного на выявлении ОТИН в клинике Mayo по результатам нефробиопсий. За это время были выявлены 133 пациента с морфологически подтвержденным ОТИН.
В 70% случаев развитие ОТИН было связано с употреблением лекарственных средств, в 14% – после приема ИПП, лидером среди которых был омепразол – 11 (12%) больных, и 2 случая связаны с приемом эзомепрозола и рабепрозола [19]. Морфологическое исследование, проведенное N. Torpey и соавт. [12], включившее 296 нефробиопсий, выполненных за 4,5 года (1995–1999), выявило 24 случая ОТИН лекарственного генеза, из которых 8 связаны с приемом ИПП (6 – омепрозол, 2 – лансопрозол).
Патогенез
Механизм развития ОТИН при употреблении ИПП до конца не известен, вероятнее всего, в его основе лежит иммунологический механизм. Препараты могут вызывать иммунный ответ, приводящий к развитию ОТИН разными путями: за счет связывания препарата с базальной мембраной канальца, выполнения роли гаптена или антигена в тубулярной базальной мембране, интерстиции с последующим иммунным ответом [20].
Существуют дополнительные пути почечного повреждения; так, E.F. Wall и соавт. опубликовали случай ОПП, ассоциированного с приемом омепрозола, связанного с гиперкальцимией [21]. Кроме того, рассматривается возможность влияния генетических особенностей метаболизма ИПП, однако данные по этому вопросу противоречивы, что требует дополнительного изучения [22].
Морфология
При проведении биопсии у пациентов с ОТИН вследствие употребления ИПП выявляется преимущественное поражение канальцевого аппарата с наличием дистрофических изменений канальцевого эпителия и выраженной лимфогистиоцитарной инфильтрацией интерстиция с преимущественным вовлечением лимфоцитов или эозинофилов, а также возможным отложением иммунных комплексов вдоль тубулярной базальной мембраны.
Клиника
При возникновении поражения почек вследствие приема ИПП появляется неспецифическая симптоматика, включающая общую слабость, снижение аппетита, недомогание, головную боль, ночную потливость, сухость во рту, тошноту, рвоту, повышение температуры тела, озноб и лишь иногда специфичные симптомы (сыпь, кожный зуд, олигурию). Необходимо отметить наличие бессимптомных форм, сопровождающихся изменениями лабораторных показателей.
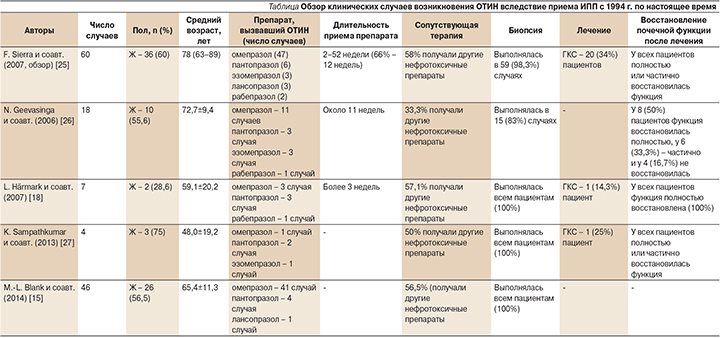
Для изучения клинических случаев возникновения ОТИН вследствие приема ИПП нами был проанализирован обзор F. Sierra и соавт. (2007), включивший 60 наблюдений, описанных в литературе с 1994 по 2006 г. Кроме того, мы рассмотрели дополнительные наиболее крупные наблюдения с 2006 г. по настоящее время, не вошедшие в базовый обзор [26]. Критерием выбора исследований стало число морфологически подтвержденных случаев, превышающее 50%. Нефробиопсия является «золотым» стандартом диагностики ОТИН [23, 24]. Обобщенные данные представлены в таблице.
Анализируя данные случаи, необходимо отметить пожилой возраст большинства пациентов (старше 60 лет). Гендерное распределение выявило преобладание женского пола, однако достоверных различий ни одна работа не продемонстрировала. Именно пожилой возраст и женский пол являются независимыми факторами риска развития хронической болезни почек (ХБП) в целом. Безусловно, при назначении терапии необходимо оценивать все дополнительные факторы риска развития почечной патологии у конкретного пациента.
Многие исследователи отмечают, что поражение почек может возникать при употреблении любого препарата группы ИПП, однако сводные данные демонстрируют наибольшую распространенность почечного повреждения при употреблении омепразола, несколько реже в описании встречались пантопразол и эзомепразол, наиболее редки случаи ОТИН на фоне приема лансопразола и рабепразола [13, 15, 25]. Данные различия могут быть связаны не только со способностью того или иного препарата вызывать почечное повреждение, но и с целым рядом субъективных обостоятельств, таких как время нахождения препарата на рынке, частота использования препарата в конкретном лечебном учреждении, и еще рядом факторов, что требует дальнейшего более детального изучения в проспективных исследованиях.
Временной диапазон от начала приема до развития ОТИН составлял от 2 до 52 недель, что говорит о неспецифичном и опосредованном поражении почек, вероятно, через активацию иммунной системы организма. Важно отметить, что половина пациентов помимо ИПП принимали другие потенциально нефротоксичные препараты, наиболее часто отмечалось совместное применение антибактериальных препаратов, диуретиков, НВПС. Кроме того, некоторые исследования говорят о повышении частоты развития ОТИН, индуцированного приемом ИПП пациентами, страдающими вторичными нефропатиями изначально, в частности диабетической нефропатией [12]. Это крайне важный факт, который в очередной раз свидетельствует о неспецифичности поражения почек лекарственного генеза и определяет возможность предупреждения развития данного побочного эффекта путем исключения опасных комбинаций препаратов, а также индивидуального расчета риска развития поражения почек у конкретного пациента.
На сегодняшний день нет однозначного подхода к терапии таких больных. Как видно из представленных работ, в среднем не более четверти пациентов подвергались активному лечению с использованием глюкокортикостероидов (ГКС). Восстановление функции почек регистрировалось у большинства больных, что свидетельствует о высокой вероятности выздоровления при симптоматической терапии. Крупных исследований по изучению различных подходов к лечению ОТИН, ассоциированного с приемом ИПП, на сегодняшний день не проводилось. Хотя некоторые исследователи говорят о благоприятном влиянии раннего начала терапии вне зависимости от ее характера [28]. Если рассматривать ОТИН лекарственного генеза как состояние, имеющего общий патогенез, не всегда в исследованиях выявляют достоверную связь между лечением ГКС и лучшим исходом заболевания [29]. Так, в работах A.K. Muriithi и соавт. (2014) не выявлено восстановления почечной функции, что авторы объясняют длительностью приема препаратов и отсрочкой назначения стероидной терапии [19]. Этот вопрос также требует более детального изучения.
Учитывая высокую вероятность развития тубулоинтерстициального поражения при приеме омепразола, наличие у пациента клинических и морфологических признаков лекарственного поражения почек, необходимо констатировать факт развития острого тубулоинтерстициального нефрита лекарственного генеза, вследствие приема ИПП у пациента, страдающего IgA-нефропатией.
Окончательный диагноз в представленном клиническом случае сформулирован следующим образом:
- Основной: острый тубулоинтерстициальный нефрит лекарственного генеза вследствие приема ИПП (омепразол).
- Фоновый: мезангиопролифератив-ный гломерулонефрит (IgA-нефропа-тия), мочевой синдром, обострение.
- Осложнения: неолигурическое острое почечное повреждение ренального генеза 1-й стадии (по AKIN – Acute Kidney Injury Network). Хроническая болезнь почек 2-й стадии. Синдром артериальной гипертензии.
- Сопутствующий: хронический неафтрофический гиперацидный гастрит вне обострения. Дислипидемия II типа (по ВОЗ).
Пациенту была рекомендована отмена ИПП, назначена диета с умеренным ограничением белка и поваренной соли, нефропротективная терапия с использованием блокаторов ренин-ангиотензин-альдостероновой системы, прием антацидных препаратов ситуационно, при эпизодах изжоги.
В течение полугода отмечена стабильная положительная динамика, проявляющаяся в нормализации анализа мочи, снижении сывороточного креатинина до 0,1 ммоль/л (СКФ по CKD-EPI=71,2 мл/мин).
УЗИ почек от 20.09.2011: левая почка размером 112×60 мм, форма обычная, контуры четкие, ровные, паренхима 19 мм, однородная, кортикомедулярная дифференциация сохранена, ЧЛС не расширена; правая почка размером 109×57 мм формы обычной, контуры четкие, ровные, паренхима 18 мм, однородная, кортикомедулярная диффернциация сохранена, в нижней трети кальцинат 3×2 мм, ЧЛС не расширена.
Однако в течение последнего месяца наблюдения (01.2012) у пациента участились эпизоды изжоги, кислого вкуса во рту, появились боли и чувство жжения в эпигастрии, возникающие практически после каждого приема пищи, а также в ночное время, снижение аппетита, работоспособности. Эффект от приема антацидов был непостоянным и кратковременным.
Объективно: состояние удовлетворительное, язык влажный, обложен белым налетом, кожные покровы чистые. При пальпации живота определяется локальная болезненность в эпигастральной области.
Для подтверждения диагноза была выполнена эзофагогастродуоденоскопия (ЭФГДС). Результат ЭФГДС от 18.01.2012: пищевод свободно проходим, просвет пищевода нормальный, стенки эластичные. Слизистая оболочка пищевода светло-розовая в верхней и среднй третях, в дистальном сегменте умеренный отек и линейная гиперемия. Перистальтика нормальная. В просвете слюна и незначительное количество прозрачного секрета. Z-линия не смещена, конуры размытые. Кардия смыкается неполностью. Проба Вальсальвы положительная. При рвотных движениях отмечается транскардиальный пролапс слизистой оболочки кардиального отдела желудка и желудочного содержимого в дистальный отдел пищевода. Слизистая оболочка свода и тела желудка бледно-розовая с мелкими пятнами застойной «гребенчатой» гиперемии. Слизистая оболочка антрального отдела умеренно гиперемирована, отечна преимущественно в препилорическом отделе. Продольные складки ровные, эластичные, расправляются полностью. В желудке повышенное количество прозрачного секрета.
Биопсия из слизистой оболочки антрального отдела (Helicobacter pylori urea test). Результат отрицательный.
Привратник правильной формы, смыкается, свободно проходим. Слизистая луковицы двенадцатиперстной кишки бледно-розовая, бархатистая. Просвет луковицы двенадцатиперстной кишки не деформирован.
Слизистая оболочки постбульбарно-го отдела розовая, бархатистая. Цирку-лярные складки ровные, эластичные. Область большого дуоденального сосочка не изменена. Интрадуоденально небольшое количество прозрачной желчи.
Заключение: недостаточность кардиальной розетки. Гастроэзофагеальный рефлюкс. Минимально выраженный катаральный дистальный эзофагит. Очаговый поверхностный гастрит тела и антрального отдела.
Итак, у пациента с диагнозом «основной: эндоскопически негативная гастроэзофагеальная рефлюксная болезнь; сопуствующий: хронический антральный неатрофический (поверхностный) гастрит, неассоциированный с H pylori, обострение; мезангиопролиферативный гломерулонефрит (IgA-нефропатия), мочевой синдром, ремиссия; хроническая болезнь почек 2-й стадии; синдром артериальной гипертензии; состояние после перенесенного острого тубулоинтрестициального нефрита лекарственного генеза вследствие приема ИПП (омепразол) стал вопрос о возобновлении лечения ИПП».
При анализе литературных данных обнаружено 4 случая повторного снижения функции почек при возобновлении приема ИПП, 3 из них описаны при возобновлении приема омепразола и один – пантопразола [25]. В результате было принято решение о назначении наиболее безопасного препарата рабепразола в дозе 20 мг утром за 30 минут до еды на 4 недели. При достижении положительного клинического эффекта был рекомендован режим поддерживающей терапии рабепразолом 10 мг «по требованию». Проводился динамический мониторинг лабораторных показателей в течение первых трех месяцев терапии.
На 3-й день приема рабепразола купировалась изжога и жжение в эпигастральной области. К моменту завершения 4-недельного курса терапии 20 мг рабепразолом полностью купировалась изжога, отрыжка воздухом и кислым содержимым, жжение в эпигастрии, улучшился аппетит и общее самочувствие. При лабораторном мониторинге в течение 3 месяцев показатель креатинина крови колебался от 0,089 до 0,11 ммоль/л (СКФ по CKD-EPI=81,9 до 63,4 мл/мин), изменения в анализах мочи выявлено не было (рис. 5)
Пациент продолжает ипользовать рабепразовал в режиме «по требованию» с частотой приема 1–2 раза в 10–14 дней. Учащение эпизодов изжоги и желудочной диспепсии не наблюдается.
Значение наблюдения и полученный опыт
Таким образом, ОТИН лекарственного генеза подтверждается положительной клинической динамикой и динамикой данных инструментальных исследований после отмены ИПП (омепразола). Кроме того, необходимо отметить безопасность применения в данном случае рабепразола у пациента с IgA-нефропатией, перенесшего ОТИН лекарственного генеза, индуцированный приемом омепразола в плане как повторного возникновения ОТИН, так и снижения почечной функции в целом.
При написании данной работы источники информационной и финансовой поддержки отсутствуют.



