Синдром раздраженного кишечника (СРК) – функциональное расстройство, при котором боль или дискомфорт в животе уменьшаются после дефекации, связаны с изменением частоты и консистенции стула, возникают не менее 3 дней в месяц на протяжении последних 3 месяцев при общей продолжительности жалоб не менее 6 месяцев [1, 3]. На сегодняшний день СРК страдают около 15–20 % населения земного шара [2, 4–6].
Наиболее часто СРК диагностируют у лиц молодого трудоспособного возраста. Поэтому заболевание наносит большой экономический ущерб обществу как в плане прямых затрат на медицинское обслуживание и лечение, так и по непрямым показателям, включающим компенсацию временной нетрудоспособности [7].
В течение длительного времени диагноз СРК расценивался как сугубо функциональное заболевание, устанавливался на основании Римских критериев-III. Однако многие исследователи не теряют надежды выявить какое-либо органическое изменение или патофизиологический механизм, способный выявить субстрат заболевания [8, 9] и объяснить причину возникновение симптомов СРК.
Многие исследования патогенеза СРК в последние десятилетия были сосредоточены на моторике толстой кишки, висцеральной гиперчувствительности и взаимодействии мозга и кишки («brain-gut axis»). На сегодняшний день особое внимание уделяется таким процессам, как воспаление, в особенности постинфекционное [10], иммунологические факторы [11] и изменения кишечной микрофлоры [12]. Доказательства их роли в развитии СРК в настоящее время изучаются.
Одной из возможных причин развития СРК может быть измененная кишечная микрофлора [12]. Важная функция микрофлоры – защитная, т.к. бактерии – симбионты человека, обладают выраженной антагонистической активностью по отношению к патогенным и условно-патогенным микроорганизмам. Любое количественное или качественное изменение в толстокишечной микрофлоре может приводить к нарушению просветной экосистемы. Это облегчает патогенным микроорганизмам возможность подойти вплотную к эпителиальным клеткам выстилки. При дегрануляции тучных клеток выделяются вещества, которые увеличивают проницаемость слизистой оболочки, что приводит к нарушению целостности белковых контактов. Просветные микроорганизмы или продукты их жизнедеятельности, такие как пептидогликаны или липополисахариды, взаимодействуют с Toll-подобными рецепторами (TLR – Toll-like receptor) на дендритных клетках и макрофагах. Антигены, представленные на этих клетках, взаимодействуют с Т-клетками, что приводит к образованию цитокинов и хемокинов, провоцирующих развитие воспаления в желудочно-кишечном тракте. Таким образом, изменение состава кишечной микрофлоры может приводить к изменениям иммунного статуса пациентов с СРК.
Существует не так много работ, оценивавших состояние цитокинового профиля при СРК. T.G. Dinan, G. Clarke и соавт. исследовали 88 пациентов, из них 37 – с СРК: 18 – с СРК-Д (СРК с преобладанием диареи), 14 – смешанная форма, 5 – с СРК-З (СРК с пребладанием запоров), 14 – с выявленной депрессией и 37 – группа здоровых пациентов. В данных группах исследовался уровень интерлейкина-6 (ИЛ-6), -8 и -10. Выявлено, что уровень ИЛ-6 (р=0,003) и -8 (р=0,001) значительно выше у пациентов с СРК, чем в контрольной группе [13].
Дополнительным свидетельством измененной кишечной иммунной активации является повышение экспрессии TLR при СРК [14], причем степень экспрессии TLR2 и TLR4 значительно отличается среди подтипов СРК. Повышенная экспрессия TLR при смешанном типе СРК спровоцировала усиление внутриклеточной передачи сигнала, что привело к повышенной экспрессии в слизистой оболочке провоспалительных цитокинов ИЛ-1 и -8 [15]. A.C. Villani и соавт. [16] предположили наличие генетических факторов риска развития постинфекционного СРК на основе исследования когорты из 2300 пациентов. Они обнаружили, что TLR9 и ИЛ-6 сохранялись в качестве независимых факторов риска при постинфекционном СРК. В нескольких исследованиях были определены конкретные генетические полиморфизмы провоспалительных цитокинов, которые оказывают влияние на моторику, эпителиальную проницаемость и висцеральную чувствительность [17–19]. Фактор некрза опухоли α (ФНО-α) производится моноцитарными активированными макрофагами, и этот цитокин играет важную роль в поддержании хронического воспаления, например при воспалительных заболеваниях кишечника [20]. По данным исследования, в Нидерландах увеличение ФНО-α было достоверно выявлено у пациентов с СРК по сравнению с контрольной группой, в то же время не было найдено связи с полиморфизмом в гене, контролирующем выработку ИЛ-10 [11], противовоспалительного цитокина, участвующего в регуляции иммунного и воспалительного ответов.
Таким образом, клиническая картина пациентов с СРК может быть обусловлена нарушением состава микрофлоры и как следствие – изменением количественного и качественного состава цитокинов.
Существуют различные методы коррекции микрофлоры. На микрофлору влияют проб- и, пребиотики, симбиотики и фекальные клизмы. В нашей стране самое широкое распространение получили пробиотики.
В литературе описано множество исследований, доказывающих, что пробиотики оказывают лечебное действие при СРК. Однако механизм их действия не до конца ясен. S.G. Jeon и соавт. изучали влияние Lactobacillus casei, Bifidobacterium breve на выделение антител в толстой кишке. Было выявлено, что B. breve в большей степени увеличивают продукцию ИЛ-10 и -27, способствующие стиханию воспалительного процесса в слизистой оболочке [26].
При исследовании эффективности пробиотиков в коррекции симптомов СРК также оценивалось качество жизни. S. Michail и соавт. исследовали эффективность пробиотического комплекса VSL#3 для пациентов с СРК с преобладанием диареи. На основании двойного слепого плацебо-контролируемого исследования было доказано, что прием пробиотиков достоверно улучшает качество жизни пациентов (по данным опросников GSRS-IBS – Gastrointestinal Symptom Rating Scale-IrritableBowel Syndrome и IBSQoL – Irritable Bowel Syndrome – Quality of Life), однако не оказывает влияния на состав микрофлоры (данные получены с помощью реакции полимеразной цепной реакции) [27]. Общие рекомендации Американского колледжа гастроэнтерологии, экспертов из Европы и США, а также Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России сводятся к следующему: применение пробиотиков в качестве средства для лечения СРК является обоснованно [3, 21–23].
В большинстве опубликованных в последнее время систематических обзоров и мета-анализов говорится о достаточно высокой эффективности использования этих препаратов [24, 32]. Пробиотики разделяются на монокомпонентные, поликомпонентные и комплексные. Монокомпонентные препараты содержат 1 штамм бактерий определенного вида. В состав поликомпонентных пробиотиков входит несколько симбиотических штаммов бактерий одного или разных видов с взаимоусиливающим действием. Комплексные пробиотики содержат несколько штаммов пробиотиков различных видов (Lactobacillus acidophilus, Bifidobacterium bifidum, Enterococcus faecium). Наиболее сбалансированным действием характеризуются комбинированные пробиотики (многоштаммовые и многовидовые). Именно поэтому им отдают предпочтение.
В настоящее время в России зарегистрировано несколько многоштаммовых пробиотических препаратов. Доказана эффективность препаратов в увеличении адаптационных возможностей в стрессовых ситуациях и при погрешностях в питании [25].
Целью нашего исследования стало определение особенностей состава кишечной микрофлоры и иммунного статуса пациентов с различными формами СРК на фоне терапии многоштаммовыми пробиотическими комплексами.
Материал и методы
В исследование были включены 86 пациентов, проходивших обследование в ФГБУ ГНЦК им. А.Н. Рыжих Минздрава России в 2013–2014 гг. У всех пациентов диагноз СРК был установлен с помощью Римских критериев-III. Согласно этим диагностическим критериям, характерный болевой синдром, усиливающийся после дефекации, должен быть связан с двумя и более из следующих симптомов:
- улучшение состояния после дефекации;
- начало связано с изменением частоты стула;
- начало связано с изменением формы кала.
К дополнительным симптомам относятся:
- патологическая частота стула:
- меньше 3 раз в неделю,
- чаще трех раз в сутки;
- патологическая форма стула:
- комковатый или твердый,
- жидкий или водянистый;
- натуживание при дефекации;
- императивный позыв или чувство неполного опорожнения, выделение слизи и вздутие.
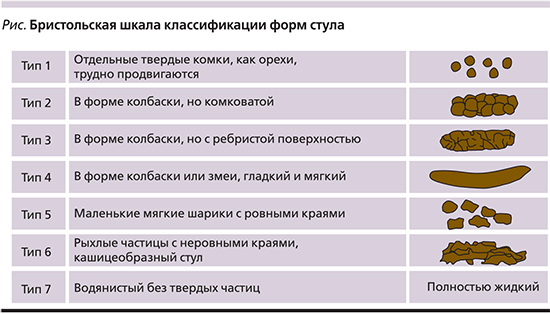
Патологическая форма стула определялась с помощью Бристольской шкалы классификации форм кала (см. рисунок)
Все пациенты, включенные в исследование, были рандомизированы и распределены в 2 группы.
В первой группе пациенты получали терапию мультиштаммовым пробиотическим комплексом (с содержанием Bifidobacterium lactis W51, Bifidobacterium lactis W52, Lactobacillus acidophilus, Lactobacillus plantarum, Lactococcus lactis, Bifidobacterium longum, Lactobacillus paracasei, Lactobacillus salivarius, Streptococcus thermophilus) в стандартной дозировке (1–2 капсулы в сутки) в течение месяца.
Во второй группе пациенты получали терапию тем же пробиотическим комплексом в увеличенной дизировке (3–4 капсулы в сутки) в течение месяца.
Все пациенты были обследованы до и после терапии. Был определен состав толстокишечной микрофлоры методом бактериальных посевов. При этом помимо просветной флоры (анализ кала) также определялась пристеночная флора (после забора колонобиоптатов слизистой оболочки прямой кишки производилась тщательная обработка фрагментов: отмывание на центрифуге-Vortox, затем производился посев на питательные среды, позволяющие определить анаэробные и аэробные микроорганизмы, бактериоды, кокки и грибы).
Также оценивали уровни провоспалительных (ИЛ-1B, ИЛ-6, ИЛ-8) и противовоспалительных (ИЛ-10 и интерферон γ – ИФН-γ) цитокинов с помощью иммуноферментного анализа.
С помощью различных опросников оценивалиь качество жизни пациентов с СРК, уровень тревожности и депрессии.
Качество жизни оценивали с помощью опросника IBS-QoL.
Для оценки уровня депрессии использовалась Госпитальная шкала тревоги и депрессии (HADS – Hospital Anxiety and Depression Scale).
Для неспецифической оценки качества жизни использовался опросник SF-36 (Short Form-36).
Для определения уровня тревожности использовался тест Спилбергера.
Для оценки уровня тревоги и депрессии использовалась шкала депрессии Бека (BDI – Beck Depression Inventory).
До начала, а также в процессе лечения пациенту было предложено заполнить дневник (заполнение 1 раз в неделю). Дневник включал 7 вопросов:
- Принимали ли Вы препарат ежедневно? (Да/Нет).
- Отмечали ли Вы боль в животе в течение этой недели (да/нет):
- если да, то в течение скольких дней (от 1 до 7);
- насколько интенсивной была боль (оценить в баллах от 0 до 10 при условии, что 0 – боль отсутствует, 10 – невыносимая боль).
- Отмечали ли Вы вздутие в течение этой недели? (Да/Нет):
- если да, то в течение скольких дней? (от 1 до 7);
- насколько интенсивным было вздутие? (оценить в баллах от 0 до 10 при условии, что 0 – вздутие отсутствовало, 10 – очень сильное вздутие).
- Сколько раз за прошедшую неделю Вы отмечали стул?
- Отмечали ли Вы чувство неполного опорожнения прямой кишки (Да/Нет).
- Чувствуете ли Вы улучшение самочувствия по сравнению с периодом до начала терапии препаратом? (Да/Нет).
- Довольны ли Вы эффектом от проводимой терапии? (оценить в баллах от 0 до 10, где 0 – очень довольны, 10 – категорически недовольны).
Статистическая обработка результатов производилась с помощью программы SPSS Statistics 18.0.
Результаты исследования
В процессе обследования 5 пациентов были исключены из программы. Из оставшихся 81 человека 9 (11%) пациентов – мужчины, 72 (89%) – женщины. Средний возраст составил 48,19±15,69 года.
При оценке преобладающей кишечной симптоматики пациенты распределились следующим образом: 51 (63%) – с СРК-З, 21 (26%)– с СРК-Д, 3 (4%)– со смешанной формой СРК, 6 (7%) – с неклассифицируемой формой СРК.
Пациенты были рандомизированы и распределены по группам в зависимости от получаемого препарата и дозы следующим образом:
Пробиотический комплекс в стандартной дизировке получали 48 (59%) пациентов, из них 39 с запорами, 6 – с диареей, 3 – с неклассифицируемой формой.
РиоФлора Баланс Нео 6 капсул получали 33 (41%) пациента, из них 12 – с запором, 15 – с диареей, 3 – со смешанной формой и 3 – с неклассифицируемой формой.
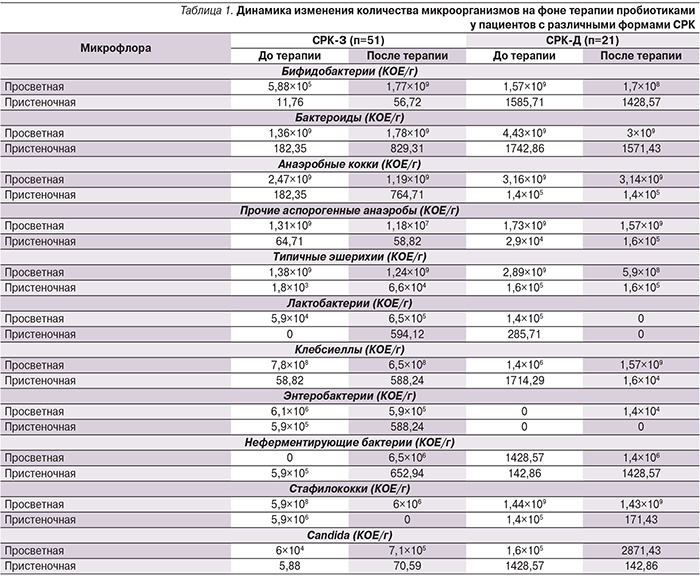
Методом посева на питательные среды был определен состав микрофлоры до и после проведенной терапии (анализ произведен только у пациентов с СРК-З и СРК-Д с учетом недостаточного для анализа число пациентов с другими формами СРК). Оценивали состояние кишечной микрофлоры в зависимости от преобладающей кишечной симптоматики.
Видовой состав просветной и пристеночной микрофлоры был однородным. При этом отмечены значительные отклонения состава микрофлоры от принятых норм. Так, резидентными микроорганизмами в исследуемых группах оказались бактериоды, анаэробные кокки, анаэробные (Гр+) бактерии, Candida, эшерихии с типичными свойствами. Транзиторная микрофлора, напротив, была представлена бифидобактериями, лактобактериями, энтерококками. Из клинически значимых условно-патогенных микроорганизмов определены клебсиеллы, энтеробактерии, неферментирующие бактерии (типа Actinobacter), стафилококки (Staphylococcus sciuri и Staphylococcus aureus).
При исследовании состава микрофлоры в группах по преобладанию кишечной симптоматики также были выявлены отличия. Так, при запорах и диарее обращало на себя внимание выраженное снижение уровня бифидобактерий. При этом после проведения терапии количество бифидобактерий увеличилось у пациентов с СРК-З.
При оценке уровня бактероидов определена масса микроорганизмов при запорах. После проведения терапии выраженных изменений отмечено не было.
Число анаэробных кокков соответствовало норме, однако на фоне терапии их количество уменьшилось при СРК-З, оставаясь нормальным у остальных пациентов. Количество прочих аспорогенных анаэробов уменьшилось на фоне терапии при СРК-З и СРК-Д.
Исходно уровень лактобактерий был снижен у всех пациентов. Однако после проведенной терапии их количество увеличилось у пациентов с СРК-З.
Уровень типичных эшерихий исходно был нормальным и на фоне терапии картина значимо не изменилась. При этом следует обратить внимание на то, что большое количество эшерихий определено не только в кале, но и в смывах со слизистой оболочки и непосредственно на самой слизистой оболочке.
Исходно определен высокий титр клебсиеллы (в частности, Klebsiella рneumoniae) у пациентов с различными типами СРК. На фоне терапии их количество уменьшилось, причем если в случае СРК-З более показательными были изменения в просветной флоре, то при СРК-Д более выраженные изменения отмечены в составе пристеночной флоры.
Повышенное количество энтеробактерий было отмечено исходно у пациентов с СРК-Д, на фоне терапии их количество было значительно снижено.
Количество неферментирующих бактерий исходно было низким, на фоне терапии увеличилось у пациентов с СРК-З и СРК-Д.
Уровни стафилококков (S. aureus, S. sciuri) были повышены у пациентов с СРК-З и СРК-Д, на фоне терапии более выраженное снижение их уровней отмечено у пациентов с СРК-З.
Грибки рода Candida были выявлены практически у всех пациентов с СРК, и на фоне терапии их количество значительно не изменилось.
Схематически все полученные результаты представлены в табл. 1.
Следует обратить внимание на то, что при исследовании пристеночной флоры у одной из пациенток с СРК-З была выявлена Iersinia pseudotuberculosis 102 КОЕ/г. Еще у одной пациентки с СРК-Д была выявлена Shigella spp. Также у 1 пациентки с диареей была выявлена Iersinia enterocolitica 2×103КОЕ/г. При повторном обследовании данные микроорганизмы выявлены не были.
При сравнении влияния различных препаратов обращало на себя внимание увеличение количества бифидобактерий на фоне терапии увеличенной дозой пробиотиков, отмечено их угнетающее влияние на число K. рneumoniae. Также выявлен рост количества лактобактерий.
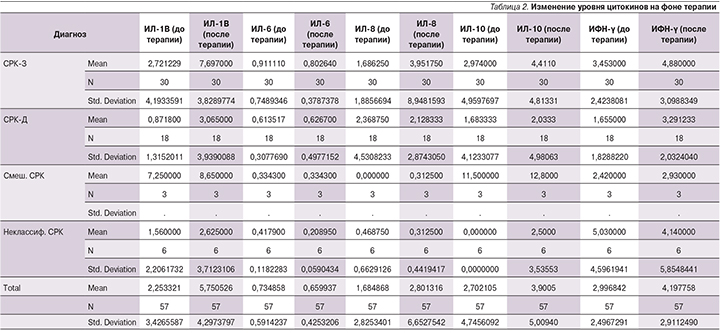
У 57 пациентов определены про- и противовоспалительные цитокины до и после терапии (табл. 2).
По данным проведенного обследования отмечено увеличение концентрации как про-, так и противовоспалительных цитокинов в пределах нормальных значений на фоне терапии, статистически достоверным это увеличение было у ИЛ-1В (р=0,005) и ИФН-γ (р=0,012).
При оценке связи между уровнем цитокинов и преобладающей кишечной симптоматикой было выявлено, что уровень ИЛ-6 при СРК-З выше, чем при СРК-Д (р=0,043).
На фоне терапии отмечалась тенденция к увеличению уровня ИЛ-1В, а также стимуляция противовоспалительных цитокинов (ИФН-γ).
У всех пациентов производилась оценка качества жизни, уровня тревожности и депрессии. Согласно шкале депрессии Бека, у 81 пациента до терапии уровень депрессии составил 11,7±7,62, что соответствует легкой депрессии, однако колебания возможны от отсутствия депрессивных проявлений до умеренной депрессии. После терапии данный показатель незначительно снизился (10,32±6,82; n=19).
При оценке уровня тревожности по шкале STAI (State-Trait Anxiety Inventory) уровень реактивной (42±9,93) тревожности соответствовал умеренным значениям, а уровень личностной тревожности – высоким показателям (46,42±12,13), однако разброс показателей был довольно выраженным. После проведенной терапии значения практически не претерпели изменений (42±9,01 и 46,47±9,47 соответственно). Следует отметить, что уровень реактивной тревожности до терапии имел обратную взаимосвязь с уровнем ИЛ-1B после терапии (чем выше был исходный уровень реактивной тревожности, тем более значительным было снижение уровня ИЛ-1B после проведенной терапии; р=0,006).
С помощью шкалы HADS оценивали уровень тревоги и депрессии. Так, до терапии уровень тревоги составил 7,33±4,14, что может соответствовать субклинически выраженной тревоге; после терапии показатель незначительно снизился (6,33±4,8). Уровень депрессии до и после терапии колебался в пределах нормальных значений (4,85±3,39 и 4,56±2,99 соответственно).
Согласно результатам, полученным с использованием опросника SF-36, обращало на себя внимание увеличение показателей VT (Vitality), SF (Social Functioning) и психического здоровья (MH – Mental Health) на фоне проведенной терапии (p=0,021). При оценке взаимосвязи различных показателей SF-36 c уровнем интерлейкинов была выявлена корреляция между показателем МН и уровнем ИФН-γ после терапии (р=0,039). ИЛ-1B был связан с общим состоянием здоровья после терапии (GH – General Health; р=0,024) и SF до терапии () (p=0,014).
При оценке уровня качества жизни по опроснику IBSQoL был выявлен довольно высокий показатель (90,78±10,18), который незначительно увеличился после проведенной терапии (93,00±11,36).
В процессе исследования все пациенты заполняли опросник, отражающий динамику кишечных показателей на фоне терапии. При оценке результатов лечения было выявлено достоверное сокращение длительности (р=0,02) и интенсивности (р=0,003) вздутия. На основании полученных данных можно сделать вывод о том, что терапия мультиштаммовыми пробиотическими препаратами значительно уменьшает длительность и интенсивность болей и вздутия.
Обсуждение
Полученные в ходе нашей работы данные представляются полезными и позволяют углубиться в природу возникновения и клинических проявлений СРК.
Так, были выявлены изменения состава микрофлоры у пациентов с различными типами СРК. В основном данные изменения проявлялись угнетением роста облигатных микроорганизмов. Это приводило к нарушению колонизационной резистентности слизистой оболочки толстой кишки и как следствие – увеличению числа патогенных микроорганизмов. При этом обращал на себя внимание следующий факт: на фоне терапии при оценке количества просветных микроорганизмов увеличение количества облигатной микрофлоры было более выражено у пациентов с СРК-З. Однако при сравнении числа бифидо- и лактобактерий на слизистой оболочке толстой кишки до и после терапии эта разница была не столь ощутимой. Этот факт может указывать на то, что обогащение просветной флоры «полезными» микроорганизмами происходит за счет их банальной задержки в просвете кишечника при замедленной перистальтической активности. Таким образом, оценка пристеночной флоры является более высокоточной методикой определения истинного состава микробиома толстой кишки, т.к. ее состояние не зависит от множества сопутствующих факторов. Также подобное исследование позволяет выявить скрытое носительство некоторых патогенных бактерий.
В последнее время уделяется внимание исследованию интерлейкинов при функциональных расстройствах кишечника. Теория о роли иммунных нарушений в развитии СРК в последние годы стала находить все больше своих сторонников. Так, в некоторых работах СРК стал рассматриваться как фактор риска развития воспалительных заболеваний кишечника [30]. Таким образом, оценка уровня иммунной системы является важной в изучении СРК как патологического состояния. В нашей работе было отмечено повышение уровней ИЛ-1, -6, -10, ИФН-γ пациентов с СРК-З по сравнению с пациентами с СРК-Д, однако эти различия находились в пределах нормальных значений. После лечения отмечался рост уровня как про-, так и противовоспалительных цитокинов. Данные изменения могут свидетельствовать о том, что при появлении в просвете кишечника большого количества микроорганизмов активизируется местная иммунная система. Это может быть связано с тем, что в состав используемого мультиштаммового пробиотического комплекса входит Streptococcus thermophilus, который относится к группе условно патогенных микроорганизмов и может стимулировать иммунный ответ. Активация противовоспалительного звена иммунитета происходит, по-видимому, за счет восстановления естественного барьера слизистой оболочки кишечника. Следует отметить, что при обследовании нами не было выявлено отклонений от средних значений по показателям цитокинов. Таким образом, выявленные изменения можно расценивать как проявления «физиологического воспаления».
Роль психоэмоционального статуса у пациентов с СРК также не вызывает никаких сомнений. Известно, что изменения в психоэмоциональной сфере выражены как при функциональных, так и при воспалительных заболеваниях кишечника [31]. В нашем исследовании были выявлены изменения психо-эмоционального статуса у пациентов с различными типами СРК: при СРК-Д выраженность тревоги и депрессии была более отчетливой, чем при СРК-З, однако эти различия статистически не были значимыми. Также отмечалась общая тенденция к преобладанию в большей степени тревожного, нежели депрессивного состояния.
Одним из возможных методов коррекции симптомов СРК является прием пробиотиков. При оценке клинической симптоматики до и после терапии в нашем исследовании достоверной нормализации стула не было, однако с большей частотой о нормализации дефекации сообщали пациенты с СРК-З. При оценке клинической картины обращало на себя внимание уменьшение длительности и интенсивности таких симптомов, как боль в животе и вздутие. В связи с этим представляется целесообразным рекомендовать мультиштаммовые пробиотические комплексы в сочетанной терапии с препаратами, нормализующими перистальтическую активность кишечника.



