Наиболее частой причиной развития дисбиоза кишечника при хеликобактериозе служит применение антибиотиков, прямо подавляющих жизнедеятельность кишечных микроорганизмов и существенно меняющих «микробный пейзаж» желудочно-кишечного тракта (ЖКТ). Дисбиоз кишечника, не являясь заболеванием (следовательно, он не может быть диагнозом), представляет собой важный патологический процесс, способный приводить к тяжелому поражению ЖКТ, который следует учитывать при определении тактики лечения больного. Действительно, нарушение состава кишечной микрофлоры может способствовать повреждению энтероцитов и нарушению физиологических процессов в кишечнике, приводить к повышению кишечной проницаемости для макромолекул, менять моторику, снижать защитные свойства слизистого барьера, создавая условия для развития патогенных микроорганизмов. Подходы к профилактике антибиотико-ассоциированных диспепсий (ААД), возникающих во время лечения хеликобактерной инфекции, далеки от своего совершенства, к сожалению, до настоящего времени отсутствуют единые согласованные подходы, имеются лишь единичные сообщения об успешном применении для этих целей пробиотиков [1–5]. Полученные к настоящему моменту данные свидетельствуют: после антихеликобактерной терапии у всех больных наблюдается нарушение баланса нормальной микрофлоры кишечника, клинически очерченные признаки дисбактериоза кишечника выявляются у 45,5% больных [6]. Проведено довольно много исследований по изучению влияния пробиотиоков на эрадикацию Helicobacter pylori, и данные их весьма противоречивы: в ряде работ показано, что пробиотики могут угнетать рост H. рylori, хотя по эффективности разные штаммы значительно различаются. За рубежом пробиотики не рекомендуются в качестве основного терапевтического средства для полного уничтожения H. рylori. Исследователи полагают, что для объективной оценки отдаленного влияния пробиотиков, включенных в схемы эрадикационной терапии, на течение заболеваний, ассоциированных с инфекцией H. рylori, необходимы дополнительные исследования. Вместе с тем общепризнанно, что приверженность и переносимость эрадикационной терапии при использовании пробиотиков, несомненно, повышаются [4, 7, 8]. Профилактика и коррекция антибиотико-ассоциированного дисбиоза кишечника достаточно – трудная задача, особенно в отношении детей. Задача становится особенно сложной в случае неэффективности антибиотикотерапии. Основой профилактики нарушения биоценоза кишечника служит рациональная антибиотикотерапия и исключение необоснованных случаев назначения антибактериальных средств. Кроме того, в любом возрасте клинически обосновано сочетанное назначение антибиотиков с биопрепаратами (пробиотиками), устойчивыми к последним. Важнейший элемент терапии – применение препаратов, содержащих пробиотики, живые микроорганизмы, положительно влияющие на состав кишечной микрофлоры. Третьим компонентом терапии могут быть энтеросоробенты [9].
Пробиотики могут использоваться при ААД в виде пищевых пробиотических продуктов (в первую очередь кисломолочных), лекарственных препаратов или биологически активных добавок. Находясь некоторое время в кишечнике, пробиотики различными путями способствуют восстановлению собственного нормального кишечного микробиоценоза (в т.ч. продуцируя свои метаболиты и взаимодействуя с иммунной системой макроор-ганизма) [4].
Среди лекарственных средств для профилактики и лечения ААД в нашей стране и за рубежом используют Нормобакт®, Линекс, Энтерол, Бифиформ, Хилак-форте.
Нормобакт®. За последние годы в практической медицине стали широко применяться препараты-синбиотики (сочетание про- и пребиотиков), которые оказывают комплексное воздействие на состояние ЖКТ, пребиотики в составе средств повышают эффективность вводимых микроорганизмов-пробиотиков и активируют собственную микрофлору. В многочисленных исследованиях подтвердили многогранные позитивные эффекты синбиотических биокомплексов на кишечный биоценоз, структуру кишечного эпителия, активность кишечных ферментов, а также на иммунную систему организма при некоторых заболеваниях органов пищеварения. В настоящее время продолжается детальное изучение влияния синбиотических препаратов на организм детей разного возраста [10–13].
Синбиотик Нормобакт® предназначен для комплексной профилактики и лечения АДД, коррекции дисбиоза при острых и хронических инфекциях, аллергических заболеваниях и иммунодефицитных состояниях, острых и хронических заболеваниях ЖКТ, воспалительных заболеваниях полости рта и носоглотки и др., у детей с 6 месяцев и старше. Важным преимуществом препарата является то, что в состав входят живые штаммы Lactobacillus acidophilus (La-5) и Bifidobacterium lactis (Bb-12) в высокой концентрации – 3×108 – и современный пребиотик – короткоцепочечный фруктоолигосахарид рафтилоза, полученный из цикория. Выпускается в виде порошка-саше, который имеет нейтральный слегка сладковатый вкус и который можно употреблять в первоначальном виде (сухое саше) либо добавлять в напитки (молоко, иогурт, воду и др.) или еду.
Изучение Нормобакта® было выполнено в ряде исследований, в которых была продемонстрирована высокая эффективность препарата [10, 11, 14–17]. Л.А. Балыкова и др. [14] в сравнительном исследовании показали, что Нормобакт® благодаря наличию в составе пребиотика и более высокой концентрации бифидо- и лактобактерий более эффективен в комплексной профилактике ААД для детей раннего возраста по сравнению с препаратом Линекс. И.В. Дармов и др. [18] в сравнительном исследовании выявили существенно более высокую выживаемость пробиотических микроорганизмов препарата Нормобакта® по сравнению с другими 23 коммерческими средствами в условиях, имитирующих процесс пищеварения человека. Это можно объяснить комплексным составом, высокой концентрацией живых бифидо- и лактобактерий и уникальной технологией производства Нормобакта® на заводе Chr Hansen.
Для практической медицины интересны будут новые препараты серии Нормобакт®: Нормобакт® L и Нормобакт® Джуниор (Junior), недавно появившиеся на фармрынке. Нормобакт® Джуниор (Junior) – синбиотик для комплексной терапии и профилактики острых вирусных заболеваний у детей 3 лет и старше и для обогащения ежедневного рациона для спортсменов, часто болеющих детей и детей «малоежек». Содержит штаммы B. lactis, L. acidophilus и пребиотик. Имеет уникальную форму выпуска – таблетки в виде мишек со вкусом белого шоколада без консервантов и красителей. Нормобакт® L – синбиотик для комплексной терапии и профилактики инфекционных диарей, аллергических заболеваний и атопического дерматита у детей с 1 месяца и старше. В состав входит штамм Lactobacillus ramnosus GG с доказанной многолетними испытаниями эффективностью, безопасностью и пребиотик фруктоолигосахарид. Выпускается в форме порошка-саше.
Материал и методы
Для оценки эффективности пробиотической терапии ААД кишечника, развившегося на фоне антихеликобактерной терапии, было проведено открытое контролируемое рандомизированное исследование, в которое были включены 59 детей в возрасте от 6 до 17 лет (средний возраст – 11,8 года), получавших антихеликобактерную терапию. Критерии исключения и прекращения участия в исследовании: непереносимость препарата, отказ от его приема, необходимость дополнения лечения другими препаратами, влияющими на состав кишечной микрофлоры.
Обследуемые дети, получавшие антихеликобактерные препараты, случайным образом были разделены на две группы – основную (n=38) и контрольную (n=21). Всем детям перед началом исследования были проведены клинический осмотр и лабораторная диагностика. В дальнейшем дети основной группы получали препарат Нормобакт® в возрастной дозировке в течение 3 недель. Через неделю после окончания курса антихеликобактерной терапии дети обеих групп были обследованы повторно, спустя месяц обследованы в третий раз. Дети обеих групп были сопоставимыми по основным параметрам состояния здоровья.
В ходе исследования анализированы клинические данные, а также состав кишечной микрофлоры и летучих жирных кислот. Обсемененность слизистой оболочки желудка хеликобактериями определена по методу Л.И. Аруина и В.А. Исакова [19].
Исследование профиля короткоцепочечных жирных кислот (КЖК) в кале проведено методом газожидкостной хроматографии. Под профилем КЖК подразумевается присущий набор частот (относительных концентраций) отдельных кислот. Нормальная концентрация КЖК в кале составляет от 8,01 до 13,01 мг/г и характеризуется содержанием уксусной кислоты (от 0,630 до 0,638 ЕД), пропионовой кислоты (от 0,187 до 0,192 ЕД), масляной кислоты (от 0,172 до 0,180 ЕД), значениями относительного суммарного содержания изокислот к кислотам с неразветвленной цепью (от 0,424 до 0,434), отношением изоС5/С5 (от 1,341 до 1,601 ЕД).
Изучение состояния микрофлоры толстой кишки проведено по традиционной методике Р.Б. Эпштейн-Литвак, Ф.Л. Вильшанской. С учетом характера изменений в составе кишечной микрофлоры выделено три типа дисбиоза: I типу соответствовали умеренные нарушения облигатной флоры (снижение бифидо- и лактобактерий не более чем на 1–2 порядка, количественные и качественные изменения кишечной палочки); II типу – изолированный избыточный рост условно-патогенной флоры (УПФ); III типу – сочетанные изменения со стороны облигатной и УПФ.
Статистическая обработка материалов проведена с использованием пакета программ Statistica 6.0 for Windows. Для сравнения групп рассчитана средняя арифметическая (М), стандартная ошибка средней (m) с определением t-критерия Стьюдента. За уровень статистической достоверности приняли p<0,05.
Результаты исследования
В ходе исследования были отмечены следующие изменения стула у большинства обследуемых детей: в контрольной группе примерно у половины детей стул оставался оформленным в течение всех трех осмотров (52,3%, 42,8, 47,1%). Иная ситуация наблюдалась в основной группе, где первоначально оформленный стул был у 63,2% детей, а затем происходило постепенное увеличение доли таких больных до 74,4% и 84,4%, через 1 неделю и 1 месяц после окончания лечения соответственно. Цвет стула у детей обеих групп практически всегда был нормальным, однако в контрольной группе через месяц у 5,9% детей (p<0,05) стул был с зеленью, тогда как в основной группе в тот срок наблюдения все дети имели стул без патологических примесей.

При оценке численности бифидо- и лактобактерий до начала антихеликобактерной терапии было отмечено, что как в основной, так и в контрольной группах средний уровень этих микроорганизмов у обследуемых детей был ниже минимального значения нормальных показателей.
В контрольной группе первоначально низкое среднее значение их содержания еще больше снижалось через неделю, затем к третьему осмотру происходило некоторое увеличение среднего значения до нижней границы нормы. В основной группе отмечено увеличение числа бифидобактерий ко второму осмотру (спустя неделю после окончания лечения) и некоторое их снижение через месяц. Аналогичная закономерность прослеживалась и в отношении лакто-бактерий.
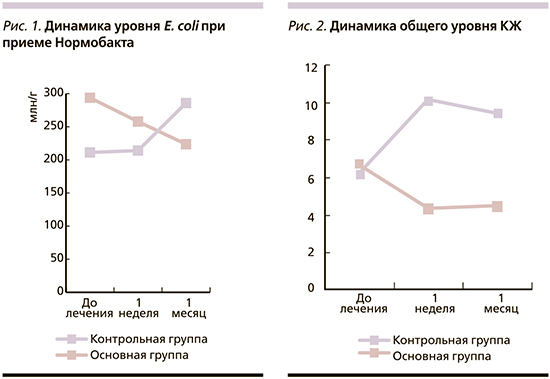
Среднее значение Escherichia coli всех детей в ходе проведения исследования колебалось от 211,2 до 293,8 млн/г, динамика показателя представлена на рис. 1. У детей контрольной группы количество ее повышалось, в основной – снижалось, при 1-м осмотре (до лечения) среднее значение E. coli в контрольной группе составляло 211,2 (млн/г), через неделю после приема Нормобакта® практически не изменилось, составив 214,1. Спустя месяц уровень этого показателя повысился до 285,9 млн/г у детей контрольной группы. В то же время у детей основной группы была выявлена обратная динамика – уровень E. coli снизился с 293,8 до лечения и до 237,9 млн/г спустя неделю после курса терапии. Через месяц после окончания терапии у детей этой группы было выявлено дальнейшее снижение показателя, который составил в этот срок наблюдения 223,7 млн/г.
Из патогенной микрофлоры высевали различные микроорганизмы: E. coli лактозонегатиная, эшерихии с гемолизирующими свойствами, E. coli со слабо выраженными ферментирующими свойствами; Bacillus spp., Staphylococcus spp. негемолитический, Staphylococcus коагулазонегативный, энтерококки, протей, цитробактер, энтеробактер, псевдомонады, Pseudomonas aeromonas, клебсиелла, Arizona, другие неферментирующие грамотрицательные микроорганизмы, дрожжеподобные грибы. Следует отметить, что в контрольной группе чаще (p<0,05) высевали эшерихии с гемолизирующими свойствами (в 23,8%, 14,3, 33,3% соответственно до лечения, через неделю и через месяц).
Динамика общего уровня КЖК; у обследуемых детей представлена на рис. 2. В контрольной группе значение данного показателя снизилось с 6,83 до лечения до 4,3 через неделю, затем оставалось примерно на том же уровне спустя месяц после окончания приема Нормобакта® (при норме 10,63).
В то же время в основной группе детей наблюдалась противоположная ситуация: при первом осмотре общий уровень КЖК был ниже нормы и составлял 6,3, ко второму осмотру он достиг нормального значения, составив 10,1 (p<0,05), а через месяц незначительно снизился до 9,4. Значение этого показателя было достоверно (p<0,05) выше такового в контрольной группе.
Результаты анализа динамики купирования основных клинических симпотомов заболеваний верхних отделов ЖКТ хеликобактерной этиологии у обследуемых детей приведены в таблице. У детей, получавших Нормобакт®, была отмечена тенденция к уменьшению длительности проявлений большинства проявлений заболевания.
Следует отметить, что болевой синдром (боли в эпигастральной области) в контрольной группе был выражен до лечения у 95,2% детей, но спустя неделю после окончания курса лечения на боли в животе жаловались лишь 15% (p<0,05) детей, а к третьему осмотру таких жалоб не предъявлял ни один ребенок в этой группе. В основной группе частота проявлений болевого синдрома также имела выраженную тенденцию к уменьшению через месяц после курса терапии пробиотиками. Однако характер и динамика болевого синдрома у наблюдаемых детей определялась скорее всего не ААД, а основным заболеванием, поэтому положительная динамика была связана с проводимой комплексной терапией.
Несмотря на то что не было выявлено достоверных различий в продолжительности выявления таких симптомов, как снижение аппетита и тошнота, тем не менее у детей основной группы средняя длительность болей в животе составила 4,2±1,1 суток, что было достоверно (p<0,05) меньше, чем в контрольной группе – 8,2±1,3 суток. Длительно сохранялся у детей контрольной группы неустойчивый стул – в течение 7,8±1,2 дня, в то время как в группе, получавшей Нормобакт®, значение этого показателя было достоверно (p<0,05) меньше – 3,2±1,0 сутки.
Средняя длительность неустойчивого стула и болей в животе достоверно не различались между пациентами основных групп, получавшими разные препараты для профилактики ААД.
Таким образом, проведенное исследование показало, что стандартная эрадикационная антихеликобактерная терапия усугубляет микроэкологический дисбаланс микрофлоры толстой кишки у большинства детей. При этом клинически эффективным и безопасным методом профилактики ААД у детей, получающих такое лечение, является применение синбиотического препарата Нормобакт®.



