Актуальность
Современные достижения в области экспериментальной и клинической медицины на клеточно-молекулярном уровне позволили критически переосмыслить ранее считавшиеся основополагающими позиции в вопросах патофизиологии развития различных заболеваний внутренних органов и их взаимосвязи (полиморбидность).
Метаболический синдром (МС) – клиническая модель полиморбидности, «визитной карточкой» которого является абдоминально-висцеральный тип ожирения с индексом массы тела (ИМТ)≥25кг/м2, по определению экспертов Всемирной организации здравоохранения (ВОЗ), – «…неинфекционная пандемия XXI века». По прогнозу экспертов ВОЗ, МС по интенсивности распространения к 2025 г. «…охватит 300 млн человек всего населения Земного шара».
МС – комплекс метаболических нарушений и сердечно-сосудистых заболеваний, ключевым связующим звеном которых является инсулинорезистентность (ИР) – нарушение чувствительности инсулиновых рецепторов инсулинзависимых тканей: мышечной, жировой, печеночной. Висцерально-абдоминальный тип ожирения при МС сочетается с нарушением толерантности к глюкозе, атерогенной дислипидемией (повышение уровней триглицеридов – ТГ, липопротеидов низкой плотности – ЛПНП, снижение уровня липопротеидов высокой плотности – ЛПВП), развитием компенсаторной гиперинсулинемии и сахарного диабета 2 типа, являющихся факторами риска формирования артериальной гипертензии, ишемической болезни сердца и хронической сердечной недостаточности. В настоящее время, по данным различных авторов, МС в 70–90% наблюдений сочетается с нарушениями состава аутохтонной (резидентной) микробной флоры (дисбиозом) пищеварительного тракта [1, 2, 6, 7, 12, 19].
Пищеварительный тракт – открытая экосистема человека, входными воротами которой служит полость рта. В течение последних 25 лет, включающих конец ХХ и начало ХХI вв., исследователи-клиницисты по-новому рассматривают взаимосвязь воспалительных заболеваний различных отделов пищеварительного тракта (пародонтит, дисбиоз кишечника) в качестве факторов риска формирования атеросклероза и сердечно-сосудистых осложнений – ишемической болезни сердца (острый коронарный синдром, инфаркт миокарда), мозговых инсультов [1, 7, 11, 14, 16–18, 20].
В свою очередь, по данным эпидемиологических исследований, распространенность воспалительных заболеваний полости рта, в частности тканей пародонта у взрослого населения РФ, составляет 81–100% [2, 5, 8, 12]. Патология пародонта редко бывает изолированной и не связанной с другими сопутствующими заболеваниями, что также определяет понятие полиморбидности. В настоящее время на одного пациента моложе 20 лет, страдающего хроническим пародонтозом, приходится 2,8, в возрасте 21–40 лет – 2,9; 41–60 лет – 4,5 одновременно протекающих заболеваний [5, 8, 12, 16].
В основе полиморбидности нередко лежит общность повреждающих факторов риска и патофизиологических механизмов развития патологии. Как показывает современный клинический опыт, наличие сопутствующих хронических заболеваний различных отделов пищеварительного тракта (гингивит, пародонтоз, дисбиоз желудочно-кишечного тракта – ЖКТ) способствует их хронизации и устойчивости к лечению. Накоплено достаточно сведений об этиологических факторах риска и патогенезе воспалительных заболеваний пищеварительного тракта, к основным из которых относятся нарушения микробного статуса (микробиоза) начиная с полости рта и заканчивая нижними отделами ЖКТ, что сопровождается интенсификацией системного и регионарного перекисного воспаления («оксидативный стресс»), истощением антиоксидантной системы, нарушением общего и местного иммунитета.
В свою очередь облигатная взаимосвязь атерогенной дислипидемии, нарушений углеводного обмена у пациентов с висцерально-абдоминальным типом ожирения, сочетающегося с дисбиозом пищеварительного тракта, обусловлена последовательным развитием стеатоза, стеатогепатита, неалкогольной жировой болезни печени вследствие повышенной секреции провоспалительных цитокинов (фактора некроза опухоли α, С-пептидов, интерлейкинов-1–9) адипоцитами и патогенной флорой кишечника [3, 4, 9, 10, 12, 13, 15, 16, 18].

Материал и методы
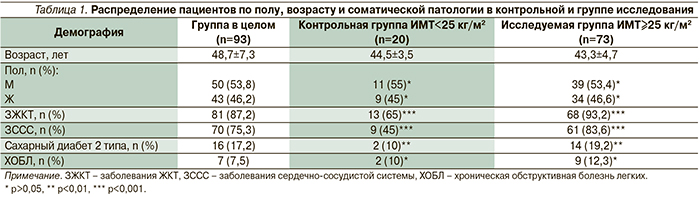
Для достижения поставленной цели и решения сформулированных задач, объективизации роли воспаления тканей пародонта и состояния микрофлоры пищеварительного тракта как факторов риска в сердечно-сосудистом континууме нами были отобраны 93 пациента с пародонтитом различной степени тяжести для обследования и лечения. Из них в качестве контрольной группы были отобраны 20 пациентов с ИМТ<25 кг/м2, 73 пациента с ИМТ≥25 кг/м2 составили исследуемую группу. В группу исследования вошли 39 мужчин и 34 женщины в возрасте от 30 до 55 лет, средний возраст – 43,3±4,7 года; группу контроля составили 11 мужчин и 9 женщин в возрасте от 30 до 50 лет (средний возраст по группе – 44,5±3,5 года).
Отобранных при обследовании пациентов обучали правилам гигиенического ухода за полостью рта, проведению стандартной профессиональной гигиены с устранением местных факторов, способствующих скоплению и активации микробного статуса полости рта.
Для объективной оценки клинического состояния пародонта определены гигиенические индексы: индекс Green–Vermillion (1964), индекс SilnessLoe (1962); индекс кровоточивости Muhlemann в модификации Cowell – ИК (1975); одновременно зарегистрирована степень подвижности по Miller в модификации Flezar и глубина пародонтальных карманов [4]. Микробные статусы полости рта и нижних отделов толстого кишечника оценены с помощью полимеразной цепной реакции (ПЦР) в реальном времени.
Результаты исследования
Клинико-морфологические результаты исследования. В табл. 1 представлены результаты демографического и клинического исследований среди отобранных для лечения пациентов. Как видно из табл. 1, при демографической идентичности (разница по полу и возрасту статистически недостоверна – р>0,05) имеется статистически достоверная разница по распределению соматической патологии в зависимости от ИМТ. В исследуемой группе (ИМТ≥25 кг/м2) пародонтит в 93,2% случаев сочетался с заболеваниями ЖКТ, в 83,6% наблюдений – с заболеваниями сердечно-сосудистой системы, в то время как в контрольной группе (ИМТ<25 кг/м2) аналогичные показатели были значительно ниже и составили 65 и 45% соответственно (разница статистически достоверна по третьему порогу вероятности безошибочности прогноза – р<0,001; рис. 1).
Выраженный процент сочетания патологии полости рта и ЖКТ (в целом по группе 87,2%) косвенно свидетельствовал о тесной взаимосвязи состояния микробиоты полости рта с микробиотой нижних отделов пищеварительного тракта, что объективно подтверждается высоким коэффициентом корреляции (rКОЕк–КОЕр) между массами микрофлоры кишечника и полости рта: rКОЕк–КОЕр=0,82 (при р<0,001 третий порог вероятности безошибочности прогноза), полученного при многофакторном математическом анализе.
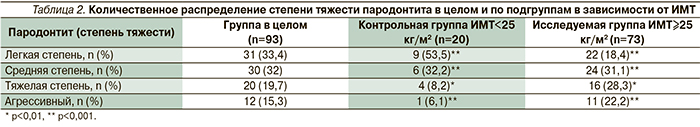
В табл. 2 представлено распределение тяжести воспаления тканей пародонта в зависимости от ИМТ.
Как видно из табл. 2, имеется тесная статистически достоверная взаимосвязь тяжести хронического генерализованного пародонтита (ХГП) с величиной ИМТ. В исследуемой группе (ИМТ≥25 кг/м2) тяжелая степень и агрессивный характер ХГП имели место в 28,3 и 22,2% случаев, аналогичные показатели в контрольной группе (ИМТ<25 кг/м2) были статистически достоверно ниже (р<0,001) – 8,2 и 6,1% соответственно, что также косвенно указывает на опосредующую роль ИМТ («визитная карточка» МС) в формировании тяжести воспаления тканей пародонта (рис. 2).

Одним из ранних признаков воспаления тканей пародонта является кровоточивость десен, степень которой оценивается с помощью индекса кровоточивости Mühlemann – ИК (1971). Этот индекс имеет диагностическую ценность не только для выявления начальных стадий поражения тканей пародонта, но и для определения выраженности клинической картины, поскольку отражает интенсивность и глубину воспаления тканей пародонта.
На первом этапе исследования для объективизации тяжести воспаления тканей пародонта нами был проведен корреляционный анализ взаимосвязи ИК со степенью тяжести пародонтита. В нашем исследовании с использованием многофакторного математического анализа при оценке интенсивности кровоточивости десен с помощью ИК было выявлено, что степень кровоточивости десен находится в тесной статистически достоверной корреляционной связи (rИК–СтХГП=0,89, при р<0,001) с тяжестью заболевания пародонта.
Средние значения ИК в зависимости от тяжести пародонтита в целом по группе исследования (ИМТ≥25 кг/м2) составили: для ХГП легкой степени – 1,75±0,09, для ХГП средней степени – 2,4±0,15, для ХГП тяжелой степени – 2,75±0,15 балла (табл. 3.).
В свою очередь выраженность воспаления тканей пародонта находилась в прямой корреляционной зависимости от уровня ИМТ, что было задокументировано высоким коэффициентом корреляции: rИМТ–ИК=0,79 (р<0,001).
Распределение степени тяжести пародонтита в зависимости от массы тела в исследуемой группе представлено в табл. 4, из которой видно, что выраженность воспалительных изменений тканей пародонта находится в прямо пропорциональной зависимости от ИМТ и документально подтверждается наличием статистически достоверным по третьему порогу вероятности безошибочности прогноза коэффициентом корреляции – rИМТ–ИК=0,79 (р<0,001; рис. 3).

Таким образом, результаты проведенного исследования свидетельствуют о реверсивной взаимосвязи состояния микробного статуса полости рта и кишечника, количественный состав которых определяет тяжесть воспалительных повреждений тканей пародонта. В свою очередь степень тяжести пародонтита находится в тесной корреляционной связи с ИМТ, являющимся фактором риска в сердечно-сосудистом континууме, что позволяет предполагать непосредственное соучастие воспалительного статуса полости рта в патогенезе сердечно-сосудистых заболеваний.
Результаты исследования биохимического провоспалительного и бактериального статусов до и после лечения. Всем пациентам в динамике (до и после лечения – 12 недель) помимо исследования гликемического, липидного спектров крови, состояния активности оксидативного статуса одновременно проведена оценка микрофлоры полости рта (биоптаты) и кишечника (кал) с помощью ПЦР в реальном времени.
В стандартную программу лечения пародонтита и сердечно-сосудистых заболеваний (β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, фенофибраты) у пациентов с ИМТ≥25 кг/м2 для компенсации дисбиоза, восстановления антиоксидантной системы и купирования оксидативного стресса (системного воспаления) были добавлены пробиотики – Про-Симбиофлор (10 капель 3 раза в сутки), Симбиолакт Композитум (1 пакетик в сутки) и Убихинон Композитум (2 мл внутримышечно 2 раза в неделю).
Результаты исследования до и после лечения представлены в табл. 5.
Конечные данные обследования 4 пациентов группы исследования были исключены в связи с несоблюдением режима лечения.
Как видно из табл. 5, до лечения имелись статистически достоверные специфические межгрупповые различия в параметрах углеводного, липидного обменов и биоценозе (видовая и бактериальная масса) полости рта и нижних отделах кишечника. Выраженность изменений со стороны углеводно-липидного обмена, статуса системного воспаления (С-реактивный белок – СРБ), активности оксидативного стресса (МДА – малоновый диальдегид) и биоциноза полости рта и кишечника находятся в прямой зависимости от уровня ИМТ.
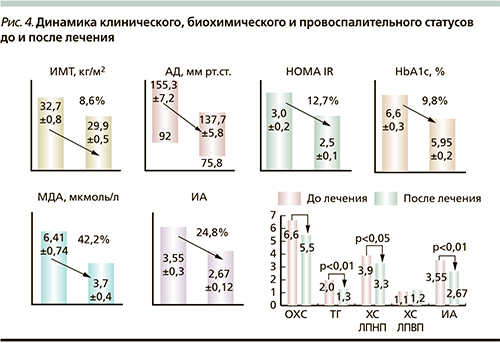
В исследуемой группе (ИМТ≥25 кг/м2) наблюдался относительно низкий уровень тощаковой гликемии – 5,2±0,1 ммоль/л на фоне ИР (HOMA IR в группе исследования превышал аналогичный показатель группы контроля без признаков МС – ИМТ<25 кг/м2 в 5,8 раза; p<0,001), который поддерживался за счет компенсаторной гиперинсулинемии: тощаковый иммунореактивный инсулин (ИРИ) в группе исследования превышал аналогичный показатель в группе контроля в 5,2 раза (p<0,001).
Как видно из табл. 5, до лечения также имелись статистически достоверные специфические межгрупповые различия в биоценозе (видовая и бактериальная масса) полости рта и нижних отделов кишечника. Состояние и качественный состав микрофлоры полости рта в исследуемой группе находились в прямой корреляционной зависимости от выраженности воспалительных изменений пародонта (rИК–КОЕ р=0,86 при р<0,001) с появлением уреазопродуцирующих бактерий (Klebsiella) и грибов (Candida sрp.) до 2×102, локализация которых характерна для нижних отделов кишечника.
Бактериальная флора пищеварительного тракта пациентов группы исследования (ИМТ≥25 кг/м2) суммарно составила по бактериальной массе в полости рта 108,4 КОЕ, в прямой кишке – 1017,4, статистически достоверно (р<0,01) отличалась от контрольной группы (ИМТ<25 кг/м2): в полости рта – 104,5 КОЕ, в прямой кишке – 1014,9.
Среди изучаемых микроорганизмов лидером роста по мере развития тяжести пародонтита стали Parphiromonas gingivalis, количественное содержание которых при ХГП достигало 4×106 КОЕ.
В свою очередь выраженность изменений со стороны углеводно-липидного обмена, статуса системного воспаления (СРБ) и активности оксидативного стресса (МДА) находится в прямой зависимости от уровня ИМТ и выраженности (агрессивная форма) воспалительных изменений пародонта, что документируется высокими коэффициентами корреляции: rИМТ-ИК=0,79 (р<0,001), rИМТ-МДА=0,87 (р<0,001, rИК-ИА = 0,72 (р<0,001).
Интегральный показатель липидного спектра крови – ИА в группе пациентов с признаками МС (ИА=3,55±0,3) превышал аналогичный показатель в группе контроля (ИА=2,1±0,15) в 1,7 раза (p<0,01), что свидетельствует о более выраженных нарушениях холестеринового обмена в сторону атерогенности плазмы крови у больных с ИМТ≥25 кг/м2.
После проведенного лечения отмечена положительная динамика в количественных показателях бактериальной массы пищеварительного тракта: в полости рта бактериальная биомасса в исследуемой группе (ИМТ≥25 кг/м2) статистически достоверно снизилась от 108,4 до 104,5 КОЕ/мл (р<0,01), в нижних отделах кишечника – от 1017,4 до 1015,1 КОЕ/мл (р<0,001).
На фоне нормализации биоценоза пищеварительного тракта в исследуемой группе (ИМТ≥25 кг/м2) отмечено уменьшение провоспалительного статуса и оксидативного стресса: уровни СРБ и МДА уменьшились соответственно на 24,3 и на 42,2% (р<0,001).
На фоне нормализации провоспалительного статуса произошло восстановление чувствительности инсулиновых рецепторов – HOMA IR статистически достоверно снизился на 33,4% (р<0,01) – с нормализацией углеводного и липидного спектров крови: ИА – интегральный показатель атерогенности плазмы снизился на 24,8% (р<0,01).
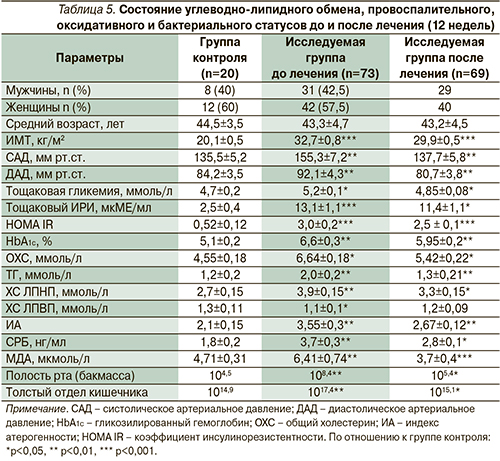
Динамика клинического, биохимического и провоспалительного статусов до и после лечения представлена на рис. 4.
После проведенного лечения с добавлением симбиотиков и антиоксидантов (24 недели – контрольная точка) у пациентов с МС на фоне статистически достоверного снижения ИМТ от 32,7±0,8 до 29,9±0,6 кг/м2 отмечены статистически достоверные изменения со стороны показателей системного воспаления и оксидативного стресса. Концентрация СРБ снизилась с 3,7±0,3 до 2,8±0,1 нг/мл, МДА уменьшилась с 6,41±0,74 до 3,7±0,4 мкмоль/л (р<0,01).
Отмечена положительная динамика со стороны системного воспаления (снижение концентрации СРБ на 18,7%), активности оксидативного статуса (уменьшение МДА на 42,3%), сопровождались статистически достоверной положительной динамикой показателей углеводно-липидного обмена (HOMA IR, HbA1c%, ИА). В группе пациентов с МС HOMA IR (показатель ИР) снизился от 3,0±0,2 до 2,5±0,1 с одновременным уменьшением концентрации тощакового ИРИ от 13,1±1,1 до 11,4±0,9 мкМЕ/мл (р<0,01), что свидетельствует о восстановлении чувствительности инсулиновых рецепторов. Стабилизация гликемического профиля у больных МС на фоне проведенного лечения с включением симбиотиков и антиоксидантов документируется статистически достоверным снижением уровня HbA1c на 9,8% (р<0,05).
На фоне гиполипидемической терапии (фенофибрат) добавление симбиотиков и антиоксидантов способствовало более выраженной антиатерогенной нормализации липидного спектра крови: ОХС, ТГ, ЛПНП снизились соответственно на 18,4%, 35, 13,2%, с одновременным ростом концентрации ЛПВП на 9,1% (разница статистически достоверна; р<0,05–0,01). Подобная положительная динамика со стороны липидного спектра крови суммарно способствовала уменьшению ИА – интегрального показателя атерогенности плазмы крови на 24,8% (р<0,05).
В целом по группе больных МС снижение ИМТ на 8,6%, HOMA IR (показатель ИР) на 18%, компенсаторной гиперинсулинемии (тощаковый ИРИ) на 13% суммарно через уменьшение активности симпатической нервной системы способствовало восстановлению АД до целевого уровня: до лечения – САД/ДАД=155,3±7,2/92,1±4,3 мм рт.ст., после лечения – 137±6,8/80,7±3,2 мм рт.ст. (разница статистически достоверна; р<0,001).
Заключение
Таким образом, наличие высокодостоверных корреляционных коэффициентов связей между ИМТ, выраженностью дисбиотических изменений со стороны пищеварительного тракта, тяжестью воспаления тканей пародонта и выраженностью нарушений углеводно-липидного метаболизма свидетельствует о статусе пародонтита как независимого фактора риска для сердечно-сосудистых заболеваний в сердечно-сосудистом континууме.
Состояние углеводно-липидного обмена при МС на ранних этапах его развития следует рассматривать как следствие общебиологической реакции на хроническое воспалительное состояние, индуцированное и поддерживаемое нарушениями биоциноза пищеварительного тракта
С учетом вышеизложенного влияния дисбиоза на прогредиентное течение МС нам представляется целесообразным включение пробиотиков (Симбиолакт Композитум) в комплексное лечение МС, а в качестве антиоксиданта (в условиях поликлиники) – использование Убихинона Композитум или Коэнзима ком-позитум.



