Введение
В основе сосудистой патологии при врожденных пороках сердца (ВПС) лежит сочетание выраженных структурных нарушений с широким спектром сопутствующих гемодинамических расстройств, больше половины которых сопровождаются гиперволемией малого круга кровообращения (МКК) с формированием легочной гипертензии (ЛГ), встречающейся более чем в 50% случаев. Самым проблемным аспектом в раннем послеоперационном периоде остается резидуальная высокая ЛГ, при которой остается риск развития легочно-гипертензионных кризов (ЛГК) вследствие тотального вазоспазма МКК [2, 3]. Резкое снижение легочного кровотока в сочетании с уменьшением преднагрузки левого желудочка ведет к снижению сердечного выброса, коронарной перфузии и часто приводит к летальному исходу. Летальность после операций остается высокой даже в ведущих клиниках мира.
Современные теории патогенеза ЛГ фокусируются на дисфункции или повреждении эндотелия, приводящем к нарушению баланса между вазоактивными веществами и развитию прогрессирующей вазоконстрикции. Решение именно этого вопроса является краеугольным камнем в выборе лечебно-диагностической тактики для пациентов с ВПС и ЛГ на этапах периоперационного лечения [2–4].
Целью исследования явилась оценка результатов применения инотропных преператов в сочетании с ингибитором фосфодиэстеразы 5-го типа – иФДЭ-5 – силденафилом (Ревацио, США) и ингибитором ангиотензинпревращающего фермента (иАПФ) в комплексном лечении ЛГ у пациентов с ВПС, осложненными ЛГ на этапах хирургического лечения.
Материал и методы
Проведен анализ исследования 198 пациентов с ВПС и ЛГ II–IVстепеней с артериовенозным сбросом в отделении хирургии врожденных пороков сердца РСЦХ им. акад. В. Вахидова за 2010–2014 гг. Всем пациентам с ЛГ III–IV ст. проведена эхокардиография (ЭхоКГ) и катетеризация полостей сердца с ингаляцией 100%-ного кислорода в рентгеноперационных, оборудованных ангиографическими комплексами. По методу Фика рассчитывались показатели, оценивающие состояние сосудов МКК (Qp/Qs, легочное сопротивление). Обследования проводились до начала лечения, непосредственно перед операцией и перед выпиской (не менее 3 раз) [1]. Полученные данные подвергались статистической обработке при помощи программы Statistica 6.0 for Windows. Количественные показатели представлены в виде Me (Q25%–Q75%), где Me – медианное значение показателя, а (Q25%–Q75%) — интерквартильный разброс. Проверку достоверности различий производили с использованием непараметрических критериев, поскольку распределение пациентов по возрасту и массе тела отличалось от показателей нормы. Различия считали достоверными при p<0,05.
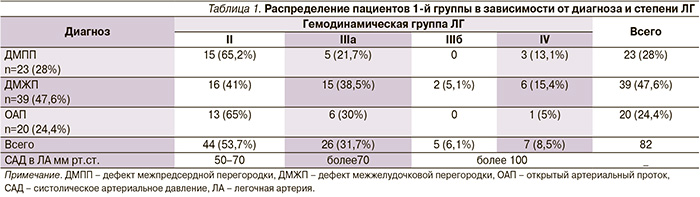
Все пациенты были распределены в 2 группы: 1-я группа (82 пациента), в предоперационном периоде 14–20 дней получала общепринятую терапию (сердечные гликозиды, метаболическую терапию, диуретики по показаниям; табл. 1).
Результаты исследования
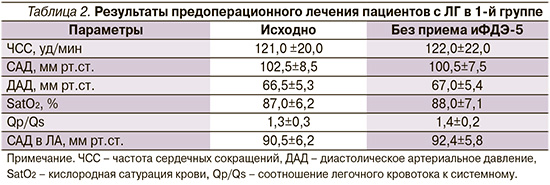
Показатели гемодинамики пациентов с ВПС и ЛГ при стандартном предоперационном лечении существенно не изменились (табл. 2).
Во 2-й (116 пациентов) группе в предоперационном периоде (20 дней) в общепринятую терапию были включены: иФДЭ-5 (Ревацио) 3 мг/кг/сут и иАПФ (каптоприл) 12,5–25 мг/сут в 2 приема. Обоснование: иФДЭ-5 (Ревацио) был включен в схему общепринятой терапии с целью предотвращения деградации цГМФ, повышения уровня мощного эндогенного вазодилататора – оксида азота, селективно действующего на сосуды МКК [5–7, 10, 11, 14, 16]; иАПФ (каптоприл) – с целью вазодилатирующего эффекта (венулярный, артериолярный и капиллярный), увеличения интенсивности капиллярного кровотока, уменьшения агрегации форменных элементов крови, увеличения конечного диастолического объема, ударного объема, снижения общего периферического сопротивления, что способствует уменьшению гипертензии МКК (табл. 3).
При проведении анализа данных 2-й группы выявлено, что исходно у всех пациентов САД было от 84 до 102 мм рт.ст., ДАД – от 52 до 69 мм рт.ст., а после приема иФДЭ-5 САД составило от 85 до 108, ДАД – от 50 до 78 мм рт.ст. Это свидетельствует об отсутствии влияния препарата на сосуды большого круга кровообращения, что подтверждается стабильными показателями системного АД и ЧСС после приема иФДЭ-5 (Ревацио). Сочетание терапии иФДЭ-5 (Ревацио) с препаратами иАПФ позволяет уменьшать периферическое сопротивление сосудов и таким образом предотвращать симптомы, которые могут возникать при увеличении сброса крови через дефекты перегородок (подъем АД, тахикардия; табл. 4).

У пациентов 2-й группы САД в ЛА составило 65—96 мм рт. ст., показатель Qp/Qs – 1,0–2,9; после приема иФДЭ-5 зарегистрировано САД в ЛА 44–95 мм рт.ст. и Qp/Qs – 1,0–5,0 в отличие от пациентов 1-й группы, где после общепринятой терапии достоверного снижения показателей САД в ЛА не отмечено (табл.2, 4).
У всех пациентов 2-й группы, по данным пробы с ингаляцией О2, при катетеризации была отмечена реакция сосудов МКК — увеличение Qp/Qs, снижение легочного сопротивления после ингаляции О2 по сравнению с исходными значениями. Всем пациентам с ЛГ IIIа-ст. с положительной реакцией на О2-пробу после лечения иФДЭ-5 проведено оперативное лечение порока. Отрицательная реакция свидетельствовала о выраженных органических изменениях, необратимой ЛГ и отсутствии ожидаемого эффекта от хирургической коррекции ВПС.
В связи с этим пациенты с ЛГ IIIб- и IV-ст. не были оперированы, несмотря на то что после проведенного комплексного предоперационного лечения иФДЭ-5 и иАПФ давление в ЛА снизилось на 8–10%.
В 1-й группе благоприятное течение раннего послеоперационного периода наблюдалось у 76% пациентов, у 24% отмечались 16 различных осложнений с летальным исходом в 13% случаев. Среди причин летальности ЛГК наблюдался у 8,1% пациентов, у 15% пациентов отмечалась резидуальная ЛГ от 50–60 мм рт.ст. (табл. 5)
Во 2-й группе у 96% пациентов наблюдалось благоприятное течение раннего послеоперационного периода, у 4% пациентов отмечалось 5 различных осложнений с летальным исходом в 4% случаев. Превалировала сердечная недостаточность, ни в одном из случаев не наблюдался ЛГК. У 80% пациентов отмечалась сердечно-сосудистая недостаточность тяжелой степени.

Отличие заключалось в том, что ко всем нижеперечисленным препаратам добавлялись иФДЭ-5 в дозе 3 мг/кг/сут и иАПФ каптоприл в дозе 6–12,5 мг 3 раза в сутки. При наличии сердечной недостаточности проводилась терапия инотропными препаратами (дофамин) в сочетании с иФДЭ-3 (милринон, перфан, эноксимон). В отсутствие значимого эффекта в течение последующих 1–2 суток (ЭхоКГ-контроль) подключался дополнительно добутамин или производилась смена дофамина на добутамин. В отсутствие должной динамики резидуальной ЛГ и по состоянию пациента подключалась терапия простагландинами Е1 (вазапростан). Пациентам с II ст. ЛГ в послеоперационном периоде проводилась 4-компонентная терапия – иФДЭ-5, иАПФ, нитраты, антикоагулянты. Пациентам с ЛГ IIIа-ст. – 6- или 7-компонентная терапия: +дофамин или добутамин, иФДЭ-3, простагландины Е1 [9, 10, 12, 14].
Анализ причин развития ЛГК выявил ряд факторов риска. Исходное давление в МКК более 80 мм рт.ст. и ЛГ IIIа–б-ст. могут быть факторами риска развития ЛГК в раннем послеоперационом периоде (оценка шансов [ОШ]=0,95 и 0,27; доверительный интервал [ДИ] – 0,9–0,98 и 0,09–0,83; р<0,01 и 0,05 соответственно).
Раннее пробуждение пациента и экстубация до 18 часов (ОШ=4,5; ДИ 1,9–10,3; р<0,01), неадекватная терапия в послеоперационном периоде (ОШ=3,8; ДИ – 1,9–7,5; р<0,001) были основными факторами риска развития ЛГК в раннем послеоперационном периоде. Однако отсутствие терапии иФДЭ-5 статистически достоверного влияния на риск развития ЛГК (ОШ=1,0; ДИ – 0,97–1,1; р>0,05) не оказывало, а его применение достоверно снижало степень ЛГ и САД в системе ЛА,в среднем на 8–14%. Во-первых, это переводило пациента в более низкую группу риска, и во-вторых, расширяло показания к хирургическому лечению (табл. 6).
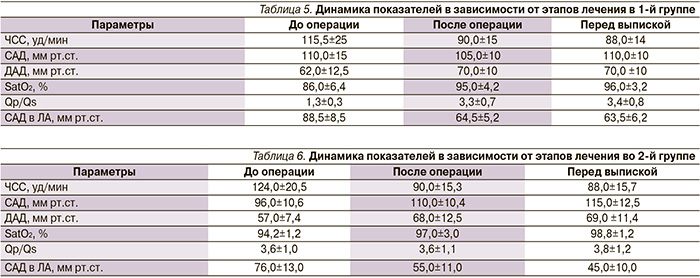
При сравнительном анализе исследуемых показателей в 1-й и 2-й группах (табл. 5, 6) статистически значимые различия обнаружены в показателях SatO2, Qp/Qs, САД в ЛА мм рт.ст. как в предоперационном периоде, так и в показателях раннего послеоперационного периода и перед выпиской. Таким образом, принятая тактика позволяет значительно снижать частоту осложнений и летальность. По результатам многофакторного анализа разработан протокол ведения пациентов ВПС с высокой ЛГ в раннем послеоперационном периоде.
Выводы
- Резидуальная ЛГ, вторичная правожелудочковая недостаточность и ЛГК являются основными осложнениями после радикальной коррекции ВПС, осложненных высокой ЛГ.
- У пациентов после радикальной коррекции ДМПП, ДМЖП, ОАП при наличии SatО2<88% до операции, наличии резидуальной гипертензии (дЛА/АД) более 60%, повышение средних значений центрального венозного давления более 12 мм рт.ст., снижение индекса Мюррея (pa02/fi02)<2, рН<7,30, РаСО>35 мм рт.ст. являются предикторами ЛКГ и неблагоприятного исхода в раннем послеоперационном периоде.
- Применение иФДЭ-5 в сочетании с иАПФ в предоперационном периоде выявило снижение легочного сопротивления и САД в ЛА в среднем на 8–4%, а в сочетании с инфузией иФДЭ-3, инотропными препаратами и простагландинами Е1 в раннем послеоперационном периоде при развитии острой лево- и/или правожелудочковой недостаточности на фоне резидуальной ЛГ сопровождается снижением средних значений ЦВД, ЧСС, повышением АД, темпа диуреза, индекса Мюррея, дальнейшего снижения давления в ЛА, кардиотонической поддержки и стабилизации состояния пациентов.



