Данные исследований пос-ледних лет доказывают необходимость максимально быстрого достижения индивидуальных целей терапии, т.к. длительное пребывание пациента в состоянии декомпенсации пагубно отражается на перспективе развития поздних осложнений, предотвращение которых служит целью лечения пациентов с сахарным диабетом 2 типа (СД2).
В связи с этим пересмотрены подходы к интенсификации сахароснижающей терапии. Согласно Алгоритмам специализированной медицинской помощи больным СД2, интенсификация требуется при недостижении целей лечения в течение 6 месяцев, а при уровне гликозилированного гемоглобина (HbA1c)>9% при впервые выявленном СД2 сахароснижающую терапию целесообразно начинать с инсулинотерапии [1]. Американская диабетическая ассоциация (ADA – American Diabetes Association) и Европейская ассоциация по изучению диабета (EASD – European Association for the Study of Diabetes) в январе 2015 г. обновили клинические рекомендации (рис. 1) и четко обозначили свою позицию в отношении интенсификации сахароснижающей терапии при СД2, основа которой – лечение, ориентированное на пациента [2]. Эти рекомендации призывают клиницистов при выборе того или иного терапевтического средства принимать во внимание индивидуальное течение СД2 у пациента, приверженность его терапии, цели терапии, что в совокупности и представляет собой персональный подход к управлению заболеванием.
Продолжение базового в эндокринологии исследования UKPDS (United Kingdom Prospective Diabetes Study follow up) [3] через 10 лет после окончания оригинального показало, что период хорошего гликемического контроля на ранних стадиях заболевания имеет долгосрочную пользу независимо от уровня гликемического контроля впоследствии. Относительные риски нефатального инфаркта миокарда (ИМ), смертельных исходов, связанных с диабетом, и смерти от всех причин были соответственно на 15% (р=0,01), 17% (р=0,01) и 13% (р=0,007) ниже у пациентов, получавших интенсивную терапию, по сравнению с традиционной. Кроме того, наблюдалось достоверное снижение риска микрососудистых осложнений в группе интенсивной терапии (на 24%; р=0,001). Эти преимущества были достигнуты, несмотря на то что разница в уровнях HbA1c, наблюдаемая в конце UKPDS, была сглажена в течение первого года после окончания исследования, а уровни HbA1c были сопоставимыми в последующий десятилетний период наблюдения в сравниваемых группах [3].
Результаты UKPDS установили, что лечение СД2 должно включать усилия по достижению значений гликемии, максимально приближенных к физиологическим, как можно раньше – на начальных стадиях заболевания. Продление положительного влияния нормогликемии на ранних стадиях СД может быть частично обусловлено эффектом метаболической памяти, которая объясняет снижение выраженности эндотелиальной дисфункции, несмотря на ухудшение гликемического контроля. Считается, что механизмы метаболической памяти связаны с повышенным образованием конечных продуктов избыточного гликозилирования, что ведет к активации процессов оксидативного стресса, действие которого не прекращается даже после наступления периода нормогликемии. Инсулинотерапия связана со значительно более низкими уровнями гликозилирования по сравнению с традиционным лечением, поддерживая долгосрочные положительные эффекты нормогликемии [4].

Тем не менее в настоящее время у пациентов с СД2 инсулинотерапия почти всегда отсрочена и чаще всего инициируется длительной невозможностью достижения компенсации гликемии на фоне приема двух-трех пероральных сахароснижающих препаратов (ПССП). Мета-анализ V. Fonseca, J. Gill освещает результаты 11 исследований с участием более 2000 пациентов, имевших декомпенсацию СД2 на фоне диетотерапии, терапии одним или двумя ПССП (HbA1c – 8,7–9,1%) [5]. Пациентам в качестве интенсификации сахароснижающей терапии был назначен инсулин гларгин. Через 24 недели после добавления всем пациентам базального инсулина значения HbA1c<7% достигли 68,1%, 50,4 и 56,4% пациентов, получавших до начала исследования соответственно метформин, препараты сульфонилмочевины и их комбинацию (р=0,0006). Пациенты на диетотерапии или одном ПССП после добавления гларгина имели значительно меньшую частоту симптоматической гипогликемии по сравнению с группами, где базальный инсулин был добавлен к терапии двумя ПССП (424 – 41,6% против 713 – 62,9%; р=0,0007). Несмотря на более высокие дозы инсулина, в группе пациентов, находившихся до исследования на монотерапии метформином, после добавления базального инсулина частота гипогликемии в этой группе была ниже, чем у пациентов, получавших препараты сульфонилмочевины в монотерапии или комбинацию метформина и сульфонилмочевины (51 – 27,6%, 352 – 44,4%, 687 – 63,4% соответственно; р<0,0001). Таким образом, применение инсулина гларгин в течение 24 недель привело к снижению уровня HbA1c≤7% примерно у 55% пациентов каждой группы. Максимальное число пациентов, достигших целей лечения к 24-й неделе, оказалось в группе монотерапии метформином. В этой группе отмечена также самая низкая частота гипогликемий и наименьшая прибавка массы тела.
В исследование INSIGHT были вовлечены более 400 пациентов на фоне диетотерапии, терапии одним-двумя ПССП, имевшие HbA1c=7,5–11,0%. Сравнивали эффективность применения инсулина гларгин и стандартного подхода (увеличение дозы или присоединение дополнительного ПССП) в улучшении гликемического контроля и влиянии на частоту возникновения гипогликемий. За 24 недели пациенты группы гларгина продемонстрировали снижение уровня HbA1c на 1,55% против 1,25% у пациентов группы стандартной терапии (р=0,005), уровень HbA1с при этом достиг 7,0% против 7,2% (р=0,0007), было отмечено также более значительное снижение гликемии натощак – ГН (р=0,0001). Группы не различались по частоте эпизодов гипогликемии: 100 (48,5%) у пациентов на инсулине гларгин и 84 (42,2 %) – в группе контроля (р=0,23). Эпизоды тяжелой гипогликемии наблюдались однократно (0,5%) в каждой группе [6].
Представленные данные четко подтверждают необходимость своевременной инициации и интенсификации инсулинотерапии пациентам с СД2. Идеальная программа лечения инсулином должна быть индивидуально подобранной для пациента с учетом плана питания и физических нагрузок и основана на результатах измерений уровня гликемии по дневнику самоконтроля. Ожидаемый сахароснижающий эффект должен быть пропорционален комфортному режиму инсулинотерапии и индивидуальным целям терапии [7]. В идеале главным принципом инсулинотерапии является создание нормального профиля глюкозы, по возможности – без набора массы тела и/или гипогликемий.
В качестве инициации инсулинотерапии вариантом выбора служит включение в комплексную пероральную терапию базального инулина. Последний обеспечивает относительно одинаковый профиль глюкозы днем и ночью, подавляя гиперпродукцию глюкозы в печени и таким образом контролируя уровни глюкозы между приемами пищи и ночью [8].
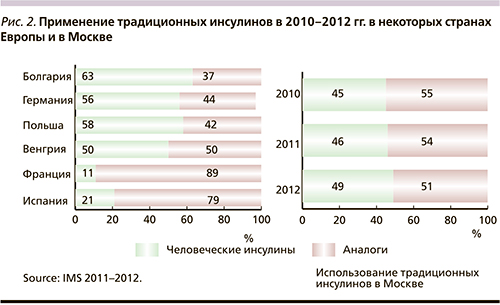
Несмотря на эру аналогов человеческих инсулинов, в реальной клинической практике по-прежнему актуально использование традиционных инсулинов. Так, на рис. 2 представлены данные о распространенности использования традиционных человеческих инсулинов в некоторых странах Европы и в Москве.
 Таким образом, изучение эффективности и безопасности традиционных человеческих инсулинов по-прежнему представляет большой клинический интерес для врачей-эндокринологов.
Таким образом, изучение эффективности и безопасности традиционных человеческих инсулинов по-прежнему представляет большой клинический интерес для врачей-эндокринологов.
В России не так давно завершилось исследование HUBIN, которое изучало эффективность инсулинов НПХ (нейтральный протамин Хагедорна) в достижении уровня HbA1c≤7% у пациентов с СД2, декомпенсированных на фоне терапии одним или двумя ПССП.
Целью исследования стало изучение числа пациентов, достигших HbA1c<7% через 6 месяцев после назначения инсулина НПХ. Задачи исследования включали оценку эффективности терапии по уровню HbA1с, оценку изменения массы тела и суточной дозы инсулина через 3 и 6 месяцев. Помимо этого исследовали безопасность проводимой терапии по частоте возникновения и тяжести гипогликемий через 3 и 6 месяцев от начала приема инсулина НПХ.
Материал и методы
Дизайн исследования предполагал включение 1500 пациентов со средним уровнем HbA1c 9,24% и длительностью заболевания СД2 6,4±5,1 года. На фоне лечения пациенты, из которых 17,1% находились на монотерапии препаратами сульфонилмочевины, 6,5% – препаратами метформина, 76,5% – их комбинацией, имели неудовлетворительные показатели гликемии и нуждались в интенсификации терапии. Так, 1380 пациентам был назначен Инсуман Базал (инсулин-изофан [человеческий генно-инженерный]), 59 – Хумулин НПХ (инсулин-изофан [человеческий генно-инженерный]), 48 – Протафан (инсулин-изофан [человеческий генно-инженерный]), 10 – Биосулин (инсулин растворимый [человеческий генно-инженерный]), 2 – Ринсулин (инсулин растворимый [человеческий генно-инженерный]), 1 – Росинсулин С (инсулин-изофан [человеческий генно-инженерный]). Исследователям было рекомендовано титровать базальный инсулин по уровню ГН до достижения значения 5,5 ммоль/л, однако приоритетным оставалось применение индивидуальной тактики относительно особенностей течения СД2 у каждого пациента.
Результаты исследования
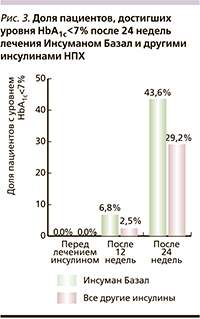
Результаты оценили через 3 и 6 месяцев. Через 12 недель уровень HbA1c<7% был достигнут 6,5% пациентов, через 24 недели – 42,4 %. На рис. 3 показано распределение пациентов, достигших уровня HbA1c<7% на терапии Инсуманом Базал и другими инсулинами НПХ. Среднее значение HbA1c через 12 недель составило 8,03±1,03% в группе пациентов, получавших Инсуман Базал, и 8,01±0,84% среди пациентов, получавших другие инсулины. Через 24 недели снижение HbA1c продолжилось и составило соответственно 7,18±0,73 и 7,17±0,73% (p<0,001) в группе Инсуман Базал и других инсулинов. Итоговое за 24 недели снижение уровня HbA1c составило 2,06% (p<0,001).
Кроме того, было зафиксировано выраженное снижение ГН: через 12 недель уровень ГН составил у исследуемых пациентов 7,4±1,3 ммоль/л при исходном значении 10,0±2,1 ммоль/л (p<0,001). Еще через 12 недель, к концу исследования, среднее значение ГН составило 6,4±1,03 ммоль/л (p<0,001), что на 3,6±2,1 ммоль/л (p<0,001) ниже по сравнению с исходной гликемией.
Влияние проведенной инсулинотерапии не вызывало прибавки массы тела. При исходном индексе массы тела (ИМТ)=31,97±5,03 кг/м2, к 24-й неделе он составил 31,77±4,94 кг/м2, а окружность талии пациентов варьировалась с исходного значения 99,17±13,10 см до 98,07±12,96 к 24-й неделе (p<0,0001), что доказывает отсутствие прибавки массы тела у пациентов на фоне 24 недель применения базального инсулина.
Важным исходом исследования стала оценка числа и тяжести гипогликемий. За 24 недели у 914 (61%) пациентов не было зафиксировано ни одного эпизода гипогликемии, 440 (29%) имели от 1 до 3 эпизодов гипогликемических состояний, 138 (9%) – от 4 до 14 эпизодов гипогликемии, 6 (0,004%) – 15 или более гипогликемических эпизодов, а у 2 (0,0013%) пациентов были зафиксированы эпизоды тяжелой гипогликемии. Среднее число эпизодов гипогликемий представлено в таблице.
Выводы
Проведенное обсервационное исследование показало, что инициация инсулинотерапии пациентов, не имевших целевого уровня гликемического контроля на фоне приема ПССП, привела к статистически значимому снижению уровня HbA1c и ГН. При этом целевого уровня HbA1c добились 42,3% пациентов на терапии Инсуманом Базал и 29,2% – на других инсулинах НПХ. К тому же частота гипогликемий была минимальной: из 1500 пациентов – 2 случая тяжелой гипогликемии.
Существует множество свидетельств того, что своевременное начало инсулинотерапии необходимо для пациентов с СД2. Однако большинство пациентов и врачей не настроены начинать инсулинотерапию в связи с возможностью возникновения гипогликемии и прибавки массы тела. Своевременной инициации инсулинотерапии мешают низкая мотивация пациентов и врачей, обусловленная недостаточной осведомленностью, отсутствием знаний или опыта. В то же время инерция в отношении интенсификации сахароснижающей терапии приводит к тому, что больные, получающие ПССП, находятся под воздействием хронической глюкозотоксичности в течение длительного периода времени до начала инсулинотерапии.

В проспективном популяционном исследовании с использованием ретроспективных данных Brown и соавт. было продемонстрировано, что пациенты на ПССП (монотерапии метформином, монотерапии препаратами сульфонилмочевины или их комбинацией) находились в состоянии декомпенсации с HbA1c>8,0% в течение 5 лет, с HbA1c>7,0% – в течение 10 лет от постановки диагноза до момента начала инсулинотерапии [8].
Пациенты, находящиеся на диетотерапии, преимущественно переходят на терапию ПССП (73,6%), а впоследствии – на комбинированную терапию (примерно 91%). Тем не менее уровень HbA1c до начала комбинированной терапии составляет в среднем ≥9,6%, что значительно выше, чем уровень HbA1c, рекомендованный международными диабетологическими ассоциациями для интенсификации терапии. Впоследствии почти 90% пациентов, получавших комбинированную терапию, была показана инсулинотерапия [9]. Это прослеживается в наблюдательных клинических исследованиях во всем мире, которые сообщают, что инсулинотерапия стартует в отношении пациентов с длительностью СД2 около 10 лет и средним уровнем HbA1c>9% [10], что неизбежно влечет за собой увеличение частоты осложнений, связанных с СД.
Таким образом, на сегодняшний день мы имеем данные о патогенезе развития поздних осложнений СД2, свидетельствующих о необходимости достижения целевого контроля гликемии на самых ранних стадиях заболевания с постепенной интенсификацией терапии и рациональным подходом к инициации инсулинотерапии. Данные многочисленных исследований доказывают наличие явного преимущества применения активной тактики в достижении целевых показателей гликемии в реальной клинической практике. Своевременное и безопасное достижение индивидуальных целей терапии остается приоритетным направлением, по мнению экспертов Американской диабетической ассоциации (ADA)[2] и российских экспертов (Алгоритмы специализированной медицинской помощи больным СД) [1].



