Введение
В настоящее время среди патологических изменений органов и систем, развившихся на фоне нарушения обмена веществ (углеводного, жирового), существенную роль играют метаболические поражения печени, которые могут носить первичный или вторичный генез. Проблема первичных метаболических нарушений печени на фоне инсулинорезистентности, сахарного диабета 2 типа (СД2), гиперлипидемии (с преобладанием триглициридемии), ожирения особенно актуальна, т.к. в отсутствие своевременной диагностики и корректирующего лечения их можно отнести к категории прогрессирующих заболеваний печени. К наиболее значимым из них относится неалкогольный стеатогепатит (НАСГ).
Впервые поражение печени у больных СД изучал F.T. Frerichs в 1970-х гг. [1], но лишь в 1980 г. J. Ludwig et al. [2] сформулировал понятие НАСГ, наблюдая изменения в печени у больных ожирением и СД, не употреблявших алкоголь в гепатотоксических дозах. В настоящее время термином НАСГ принято называть хроническое заболевание печени, развивающееся у пациентов, не употребляющих алкоголь в гепатотоксических дозах и характеризующееся развитием крупнокапельного стеатоза и долькового воспаления печени [3, 4].
В последние годы НАСГ рассматривается как поражение печени в рамках метаболического синдрома. Так, абдоминальное ожирение в 65–80 % случаев ассоциировано с развитием НАСГ, СД2 обнаруживается у 25–75 % пациентов с НАСГ, гиперлипидемия выявляется примерно у 20–80 % больных [5, 6]. С учетом стремительного роста заболеваемости СД2 во всех популяциях прогнозируется увеличение числа больных НАСГ, однако проблема данной патологии печени остается недостаточно изученной.
Долгое время считалось, что НАСГ протекает как доброкачественный процесс, однако в ходе последних исследований установлено, что данное заболевание характеризуется прогрессирующим течением, приводящим к развитию цирроза печени (ЦП) и гепатоцеллюлярной карциномы [7, 8]. В США 2–6 % от общего числа трансплантаций печени выполняется больным НАСГ c декомпенсированным ЦП [9, 10]. У 20–37 % больных неалкогольный стеатогепатит прогрессирует с развитием фиброза печени, а в 2–26 % случаев приводит к развитию ЦП [11–13]. Исследования последних лет позволяют предположить, что именно НАСГ лежит в основе развития 60–80 % криптогенных ЦП [2, 14, 15]. По данным ряда авторов, криптогенный ЦП в 81 % ассоциируется с СД2. Более того, сочетание СД2 и НАСГ в 2,0–2,5 раза увеличивает риск развития ЦП и гепатоцеллюлярной карциномы [16–18].
Разработка стандартных схем лечения НАСГ представляет большие трудности, а предложенные в настоящее время схемы не учитывают многообразия патофизиологических механизмов развития заболевания. Современные подходы к лечению направлены главным образом на устранение или ослабление факторов, ведущих к развитию НАСГ, предотвращение прогрессирования заболевания и развития ЦП. Главные принципы терапии – снижение массы тела, коррекция гиперлипидемии и гипергликемии, назначение гепатопротективных препаратов [19–21].
Одними из наиболее часто применяемых гепатопротекторов являются препараты, содержащие эссенциальные фосфолипиды (ЭФЛ), однако недостаточный эффект монотерапии ЭФЛ в больших исследованиях, выполненных в последнее время с позиций доказательной медицины, потребовал совершенствования данной лекарственной формы посредством предложения инновационных технологических решений, модифицирующих широко известные формы существующих лекарств. В соответствии с этим положением в настоящее время был создан ряд новых препаратов на основе ЭФЛ с использованием новых технологий или комбинаций ЭФЛ с другими лекарственными средствами. Так, в настоящее время появился новый отечественный препарат, представляющий собой комбинацию ЭФЛ и глицирризиновой кислоты [22]. Для повышения биодоступности фосфолипидов впервые в производстве препаратов подобной группы использованы, по сути, нанотехнологии [22]. Глицирризиновая кислота обладает широким спектром биологической активности. Основными ее биологическими свойствами являются иммуномодуляторный, прововоспалительный, антиоксидантный, гепатопротекторный, противовирусный эффекты [23]. Однако недостаточно изученными остаются вопросы применения данного препарата в медикаментозной терапии НАСГ у больных СД 2 типа, включающими дозы препарата, длительность его применения с инсулиносенситайзерами.
Соответственно, целью исследования явилось определение эффективности использования у больных НАСГ и СД2 комбинации ЭФЛ, произведенных по нанотехнологиям, и глицирризиновой кислоты в сочетании с бигуанидом (метформин).
Материал и методы исследования
Было проведено отрытое рандомизированное клиническое исследование в котором больные НАСГ и СД2 (n = 75) были рандомизированы на 3 группы, сравнимые по половому составу, возрасту, клинической картине, данным лабораторных и инструментальных методов исследований, гистологическому исследованию биоптата печени. Все пациенты получали гипокалорийную диету с ограничением легкоусвояемых углеводов. Больные группы 1 (n = 27) получали метформин в дозе 500 мг 3 раза в день, больные группы 2 (n = 23) принимали комплексный гепатопротекторный препарат (КГП) с содержанием эссенциальных фосфолипидов, произведенных по нанотехнологиям, и глицирризиновой кислоты по 2 капсулы 3 раза в день, пациенты группы 3 (n = 25) принимали метформин и КГП в указанных дозировках. Контрольными точками стали 90-й и 180-й дни. Биохимические исследование крови и определение гликированного гемоглобина проводились на анализаторе Cobas Integra 800 с использованием реактивов фирмы «Хоффман Ла Рош». Исследование уровня инсулина проводили на иммунохемолюминесцентном анализаторе «Immulite» (США). Для оценки чувствительности тканей к инсулину использовали индекс HOMA–IR. Ультразвуковое исследование гепатобилиарной системы выполнялось строго натощак на ультразвуковом сканере «SSD-5500» конвексным датчиком частотой 3,5 МГц. Для гистологического исследования больным НАСГ с СД2 была выполнена пункционная биопсия печени по методу Менгини. Использовались одноразовые наборы инструментов для биопсии печени фирмы «Brown» (Германия) с иглой конструкции Менгини диаметром 16 G. Степень жирового гепатоза и стеатогепатита оценивалась по шкале Metavir (1999, 2001). С целью диагностики воспалительно-некротических изменений, стеатоза и фиброза печени применялся ФиброМаксТест, включающий пять наборов маркеров: ФиброТест, АктиТест, СтеатоТест, НэшТест [24]. Определение стадии фиброза печени проводилось с помощью ультразвуковой эластографии на аппарате FibroScan (EchoSens, Франция) по стандартной методике. Полученный результат выражался в килопаскалях и позволял четко распределять больных по стадиям заболевания от F0 до F4 по системе Metavir [25, 26].
Результаты исследования
Во всех трех группах на фоне лечения отмечено уменьшение степени выраженности астеновегетативного синдрома. Наиболее выраженная положительная динамика выявлена в группе 3. Так, в группе 1 общая слабость исходно выявлена в 51,9 % случаев, к 90-му дню – в 29,6 %, к 180-му – в 18,5 % случаев (р < 0,05; р < 0,05 по сравнению с исходным уровнем); в группе 2 – в 47,8; 39,1 и 21,7 % случаев (р > 0,05 и р > 0,05), в группе 3 – 52,0; 12,0 и 4,0 % случаев (р < 0,05; р < 0,05). Снижение работоспособности в группе 1 – в 66,6; 33,3 и 18,5 % случаев (р < 0,05; р < 0,05); в группе 2 – 56,5; 34,8 и 21,7 % случаев (р < 0,05 и р > 0,05). К окончанию лечения в группе 3 было отмечено достоверное снижение частоты нарушения сна (с 24 до 4 %, р < 0,05) и исчезновение раздражительности, исходно выявленное в 32 % случаев; в группе 2 также отмечено достоверное снижение показателя с 26,0 до 4,3 % (р < 0,05).

Проявления диспепсического синдрома также испытывали тенденцию к регрессу с полным исчезновением синдрома запора и тошноты к 180-му дню лечения. Пациенты группы 3 отличались более быстрым регрессом таких симптомов, как горечь во рту и метеоризм, достоверное снижение частоты которых произошло уже к 90-му дню лечения, только в данной группе исчез к 180-му дню лечения такой симптом, как неустойчивый стул, который исходно регистрировался в 16 % случаев. Частота тяжести и боли в правом подреберье уменьшилась во всех 3 группах к 90-му дню, однако статистически достоверным данное снижение было только у пациентов группы 3.
К 180-му дню лечения данная тен-денция стала достоверной во всех 3 группах. Для группы 1 динамика частоты данного симптома составила 37,0; 29,6 и 11,1 % соответственно (р < 0,05 и р > 0,05); для группы 2 – 34,8; 21,7 и 8,7 % соответственно (р < 0,05 и р > 0,05); для группы 3 – 40,0; 8,0 и 4,0 % соответственно (р < 0,05; р < 0,05).
Анализ динамики показателей, характеризующих углеводный обмен, закономерно выявил отчетливую положительную динамику у больных, получавших метформин. Некоторая положительная динамика, выявленная у больных 2-й группы, а также более выраженное улучшение у больных группы 3 по сравнению с группой 1, по всей видимости, объясняются улучшением функционального состояния печени, в т.ч. и ее белково-синтетической функцией, на фоне применения КГП.
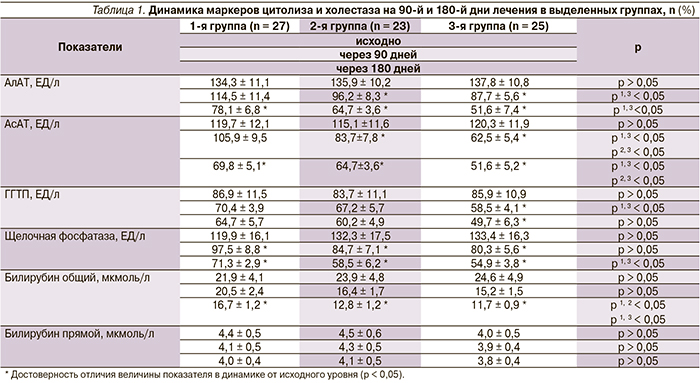
Нарушения липидного спектра на фоне проводимого лечения несколько уменьшились во всех трех группах, уровень общего холестерина снизился в группе 1 на 6,9 %, в группе 2 – на 7,2, в группе 3 – на 7,5 %; уровень триглицеридов – на 13,0; 14,3 и 20,0 % соответственно. Однако данная тенденция во всех группах была статистически не достоверной. На фоне всех трех анализируемых схем лечения нами была отмечена отчетливая положительная динамика синдромов цитолиза и холестаза (табл. 1).
Снижение активности АлАТ и АсАТ было достоверным (p < 0,05) уже к 90-му дню в группах 2 и 3, в группe 1 степень снижения стала достоверной (p < 0,05) к 180-му дню. В то же время необходимо отметить, что снижение данных показателей до референтных значений не регистрировалось у всех больных, причем наибольшая частота нормализации показателей была выявлена в группе 3, наименьшая – в группе 1. Уровень ГГТП также снижался на фоне лечения, однако достоверной (p < 0,05) уже с 90-го дня данная динамика была только в группе 3.
Соответственно, снижение данного показателя до референтных значений наименее часто регистрировалось в группе 1 и наиболее часто – в группе 3.
Повторное гистологическое исследование биоптата печени было проведено 53 пациентам основной группы. Соответственно, сравнение исходных морфологических данных и результатов гистологического исследования после окончания лечения проведено только данным 53 пациентам. Анализ результатов гистологического исследования печени в динамике подтвердил наше предположение, основанное на клинико-биохимическом ответе на фоне различных схем лечения, об улучшении морфофункционального состояния печени и подтвердил большую эффективность комбинированной схемы по сравнению с монотерапией метформином или КГП (табл. 2).
Выраженность стеатоза существенно снизилась во всех выделенных группах. Так, если исходно минимальная степень стеатоза выявлена в 11,8–15,8 % случаев, то к 180-му дню наблюдения она регистрировалась примерно у 50 % больных групп 1–2 и в 3/4 случаев в группе 3, что было обусловлено трансформацией умеренного и выраженного стеатоза в минимальный, причем в группе 3 выраженный стеатоз не регистрировался вовсе. Некровоспалительная активность значительно уменьшилась во всех трех группах. До начала лечения минимальная степень отмечена примерно в трети случаев, к окончанию наблюдения она выявлена примерно у 60 % больных 1-й и 2-й групп и в 82,4 % случаев в группе 3 (p < 0,05). Частота умеренной и выраженной степени активности снизилась во всех группах, а в группе 3 перестала выявляться.

К окончанию лечения не было отмечено полной редукции фиброза во всех наблюдаемых группах, причем у пациентов группы 1 на фоне монотерапии метформином никакой динамики стадии фиброза выявлено не было.
В группе 2 с монотерапией КГП выявлена тенденция к снижению выраженности фиброза, однако она была статистически не достоверной. В группе 3 степень фиброза значительно уменьшилась, при этом частота минимальной степени статистически достоверно увеличилась (p < 0,05).
По данным ФиброМаксТеста, степень стеатоза также испытывала существенную тенденцию к снижению с достоверным увеличением (p < 0,05) представленности минимального стеатоза во всех трех группах (табл. 3). При этом редукция стеатоза была значительно более значимой у больных группы 3 с полным исчезновением данных за наличие выраженного стеатоза к окончанию лечения.
Динамика некровоспалительных изменений, по данным ФиброМакс Теста, также коррелировала с результатами гистологического исследования, причем неинвазивный тест к окончанию лечения выявил наличие минимальной степени активности в группе 3 в 80 % случаев, в то время как в группах 1 и 2 данная степень активности выявлена в половине случаев. В группе 3 выраженная активность не регистрировалась, в то время как в группе 1 и 2 ее частота снизилась менее чем в 2 раза. Оценка степени фиброза тремя методами (табл. 3 и 4) выявила однонаправленные результаты, свидетельствующие об отсутствии регресса фиброзных изменений в печени на фоне монотерапии метформином и незначительном ответе на монотерапию КГП.
У больных, получавших комбинированную терапию, отмечено достоверное (p < 0,05) снижение числа больных с умеренным фиброзом, тенденция к меньшей представленности случаев с выраженным фиброзом. Закономерно в данной группе достоверно (p < 0,05) выросло число лиц с минимальными проявлениями фиброза.
При проведении корреляционного анализа между степенью стеатоза, стадией фиброза печени и некровоспалительной активностью, установленной при гистологическом исследовании биоптата печени, и степенью подобных изменений, выявленных с помощью набора тестов ФиброМакс, была установлена сильная прямая корреляционная связь между данными методами (табл. 5). Нами также была отмечена сильная корреляционная связь между степенью фиброза печени, выявленного при гистологическом исследовании биоптата печени и определенного по данным эластографии печени (r = 0,88, р = 0,0046).
Заключение
Результаты полученных данных свидетельствуют, что комбинированная схема лечения больных НАСГ и СД2, включающая гипокалорийную диету с ограничением легкоусвояемых углеводов, бигуанид метформин и гепатопротектор – комбинированный препарат, содержащий ЭФЛ, произведенный на основе нанотехнологий, и глицирризиновую кислоту, приводит к купированию болевого абдоминального, диспепсического и астеновегетативного синдромов, нормализации биохимических показателей синдромов цитолиза и холестаза, уменьшению дислипидемии, уменьшению степени стеатоза, активности гепатита и стадии фиброзных изменений в печени на фоне улучшения показателей компенсации СД. Монотерапия метформином или гепатопротектором менее эффективна для данных больных.
Полученные данные также подтверждают высокую информативность ФиброМаксТеста и эластографии в качестве диагностического метода оценки морфофункционального состояния печени у больных НАСГ, а также позволяют использовать данные неинвазивные методы для оценки степени поражения печени и эффективности лечения в динамике при невозможности проведения пункционной биопсии печени по медицинским, техническим и психологическим причинам. Преимуществами ФиброМаксТеста и эластографии служат простота, информативность, безопасность, быстрота исследования, возможность проследить за динамикой процесса, удобство применения в качестве скрининг-метода для пациентов групп риска, возможность регулярного мониторинга во время лечения для оценки эффективности проводимой терапии.



