На сегодняшний день дисбиоз кишечника представляет собой не только общемедицинскую, но и социальную проблему. Не вызывает сомнений тот факт, что кишечная микрофлора является важнейшей составляющей защитного кишечного барьера, который осуществляет контроль над взаимодействием организма хозяина и внешней среды. Нарушение состава микрофлоры человека сопровождается не только развитием кишечных расстройств (диарея, запор, синдромы мальдигестии и мальабсорбции), но и негативным влиянием на общесоматические регуляторные процессы. Полученные на сегодняшний день многочисленные клинические и экспериментальные данные позволяют расценивать причину многих заболеваний внутренних органов как следствие нарушения равновесия между доминирующим макроорганизмом и эндоэкосистемой. Более того, относительно недавно кишечная микрофлора, в частности бактерии толстой кишки, стали расцениваться как «основная детерминанта здоровья и заболеваний у людей» [1, 2].
В настоящее время установлена роль микробиоты в регуляции всех основных жизненных функций параллельно с основными регуляторными системами человека. Раскрыты иммунологическая, метаболическая функции, морфокинетическое действие кишечной микрофлоры. Все эти функции могут осуществляться с помощью микробных биологически активных веществ, в т.ч. гормонов и нейромедиаторов. Например, многие микробные активные вещества оказывают значимое влияние на процесс морфогенеза и функции желудочно-кишечного тракта: серотонин, ГАМК, окись азота, гистамин; выступая как нейропередатчики, регулируют моторную активность, ритмическую перистальтику и тонус гладкой мускулатуры кишечника; масляная кислота, бутират, эстрогенподобные субстанции влияют на процессы пролиферации и дифференцировки эпителия [3–5].
Важное значение имеет метаболическая активность нормальной микрофлоры, ассоциированная с образованием в толстой кишке короткоцепочечных жирных кислот (КЖК) при гидролизе углеводов и растительной клетчатки (уксусная, пропионовая, масляная), а также белков (изомасляная, изовалериановая, капроновая). Короткоцепочечные жирные кислоты обеспечивают дополнительную регуляцию состава микрофлоры, поддержание водно-электролитного баланса в просвете кишки, питание и рост кишечного эпителия, повышение барьерно-механической функции колоноцитов, регулирование моторной активности кишечника, иммуносупрессивное действие, антиканцерогенное и противовирусное действия [6].
Дисбиозы кишечника различной локализации могут определять развитие или влиять на течение гиперхолестеринемии, коагулопатий, поражений суставов и системных заболеваний соединительной ткани, злокачественных новообразований желудка, толстой кишки, грудной железы, нарушений водно-солевого, углеводного и пуринового обменов, острой мезентериальной ишемии, спонтанного бактериального перитонита, печеночной энцефалопатии, синдрома «трансплантат против хозяина».
Гипотеза, будто кишечная микрофлора участвует в холестериновом обмене, существует с начала XX в. Микроорганизмы, обитающие в кишке, метаболизируют холестерин, поступивший в толстую кишку, в копростанол и далее – в копростанон. Образующиеся в результате брожения ацетат и пропионат, всосавшись в кровь и достигнув печени, могут влиять на синтез холестерина. В частности, показано, что ацетат стимулирует его синтез, а пропионат тормозит. Третий путь влияния микрофлоры на обмен липидов в макроорганизме связан со способностью бактерий метаболизировать желчные кислоты, прежде всего холевую [7].
Наличие дисбиотических нарушений может способствовать появлению нарушений менструального цикла и бесплодия, снижению эффективности гормональных противозачаточных средств, приводить к преждевременным родам, неонатальной анемии и кахексии, а также прогрессированию кариеса [8, 9].
Нормальный состав кишечной микрофлоры и ее функциональная активность могут быть только при нормальном физиологическом состоянии организма.
К наиболее значимым причинам, приводящим к нарушению микробиоценоза, можно отнести [10, 11]:
Ятрогенные воздействия (антибактериальная и гормонотерапия, применение цитостатиков, лучевая терапия, оперативные вмешательства).
Фактор питания (дефицит пищевых волокон; потребление пищи, содержащей антибактериальные компоненты, консерванты, красители и др. ксенобиотики; несбалансированное по составу нутриентов и минорных компонентов питание; нерегулярное питание; резкая смена рациона и режима питания).
Стрессы различного генеза.
Острые инфекционные заболевания желудочно-кишечного тракта.
Снижение иммунного статуса различного генеза.
Ксенобиотики различного происхождения.
Нарушение биоритмов, дальние поездки.
Заболевания внутренних органов, прежде всего желудочно-кишечного тракта.
Функциональные нарушения моторики кишечника.
Клиническая симптоматика при нарушении состава микрофлоры во многом определяется локализацией дисбиотических изменений. Выделяют синдром избыточного бактериального роста в тонкой кишке или синдром тонкокишечного дисбиоза, характеризующийся повышенным заселением тонкой кишки фекальной микрофлорой (кишечной палочкой, бактероидами, клостридиями, в норме присутствующими лишь в толстом кишечнике) в концентрации более 105 КОЕ/мл аспирата из тощей кишки. Частота выявления избыточного бактериального роста в тонкой кишке при разных заболеваниях желудочно-кишечного тракта колеблется от 70 до 97 % [12].
Важное значение в генезе синдрома избыточного бактериального роста имеет преждевременная деконъюгация желчных кислот в тощей кишке, сопровождающаяся изменениями метаболизма холестерина и стероидных гормонов, снижением содержания летучих жирных кислот. Высвобождаются микробные протеазы и другие тканевые ферменты, образуются гидроокиси жирных и желчных кислот, повышается продукция аминов, фенолов, органических кислот. В результате этих обменных нарушений развивается воспалительный процесс, снижается синтез вторичных желчных кислот и страдает их метаболизм, наблюдается эндотоксемия, нарушаются пищеварение и всасывание в тонкой кишке [13]. Данные микробиологические изменения сопровождаются появлением хронической диареи (полифекалия, метеоризм, абдоминальные боли) и признаков мальабсорбции (снижение массы тела, стеаторея, образование оксалатных камней в почках, макроцитарная анемия).
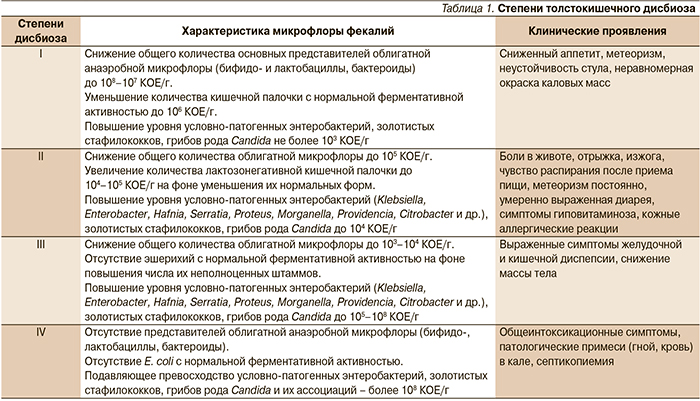
Синдром толстокишечного дисбиоза характеризуется количественными и качественными нарушениями состава микрофлоры толстой кишки с формированием дефицита бифидо- и лактобацилл при нарастании содержания условно-патогенных микроорганизмов, что сопровождается появлением разнообразных клинических проявлений (хронический запор, неустойчивость стула, метеоризм, спастические боли), а также метаболических, трофических, иммунологических нарушений (табл. 1). Длительное время синдром толстокишечного дисбиоза может протекать латентно.
Методы диагностики дисбиоза кишечника
На сегодняшний день для качественной и количественной оценки состояния кишечного микробиоценоза используется несколько методов: бактериологическое (микробиологическое), молекулярно-генетическое исследование кала (диагностика с помощью полимеразной цепной реакции), исследование крови с помощью хромато-масс-спектрометрии и исследование микробных метаболитов.
«Классический» бактериологический анализ фекалий по-прежнему сохраняет свое значение. Результаты исследования испражнений коррелируют с видовым и количественным составом микрофлоры толстой кишки при строгом соблюдении правил сбора, хранения и бактериологического исследования кала (специальная стерильная пластиковая или стеклянная посуда с крышкой; немедленное направление в баклабораторию и безотлагательный посев кала на бактериальные среды) [14, 15]. Недостаток бактериологического метода: при проведении данного анализа возможно определение содержания лишь ограниченного числа микроорганизмов в кишечнике. Наиболее информативным методом диагностики является микробиологическое исследование микроорганизмов с применением анаэробного культивирования в биоптатах, полученных из различных отде-лов кишечника. Однако в силу технических сложностей в практике данный метод не может быть использован [16].
Диагностика с помощью полимеразной цепной реакции позволяет определять некоторых представителей микрофлоры с внутриклеточной или мембранной локализацией. Метод информативен только в отношении ограниченного круга условно-патогенных и патогенных микроорганизмов и вирусов, применяется в основном для верификации инфекционной патологии.
Метод хромато-масс-спектрометрии универсален (сопоставим с методом ДНК-ДНК-гибридизации и амплификации гена) и специфичен для диагностики анаэробных инфекций, дает возможность оценки живых и мертвых микроорганизмов, определение малых концентраций клеток микроорганизмов на преобладающем фоне биологической жидкости [17]. Однако метод требует многократных исследований для анализа широкого диапазона микроорганизмов, особенностей компьютерной обработки, имеет большую стоимость.

Один из новых способов диагностики состояния микробиоценоза различных биотопов основан на определении КЖК, являющихся метаболитами анаэробных родов микроорганизмов, которые не определяются при рутинном бактериологическом исследовании, требующем специальных условий культивирования анаэробов методом газожидкостной хроматографии [18].
Коррекция дисбиотических нарушений
Современное понимание закономерностей функционирования организма человека и его микробиоты как единой системы позволяет сформулировать основные направления комплекса мероприятий для коррекции дисбиотических нарушений:
- лечение основного заболевания;
- создание условий для нормальной жизнедеятельности микробиоты (нивелирование секреторных, моторно-эвакуаторных и морфологических нарушений органов желудочно-кишечного тракта, коррекция питания);
- применение средств с направленным позитивным влиянием на микробиоту;
- симптоматическое лечение.
Одним из наиболее распространенных направлений коррекции кишечных дисбиозов различной локализации является использование препаратов, имеющих различный состав и механизмы действия, к которым относятся пробиотики – препараты отдельных представителей кишечной микрофлоры в живом виде; пребиотики, содержащие бактериальные компоненты, такие как ДНК, биологически активные метаболиты бактериального происхождения, пищевые компоненты; синбиотики – комбинация пре- и пробиотиков.
В качестве пробиотиков наиболее часто используют некоторые виды молочнокислых бактерий (Lactobacillus), бифидобактерий (Bifidobacterium), сахаромицетов (Saccharomycers cerevisiae), кишечной палочки (E. coli), а также отдельные разновидности бацилл (Bacillus). Предпочтение, отдаваемое пробиотикам, содержащим молочнокислые бактерии Lactobacillus spp. и Bifidobacterium spp., обусловлено их резистентностью к действию желудочного сока, желчи и ферментам поджелудочной железы, а также легкостью, с которой они колонизируют слизистую оболочку кишечника.
Положительные влияния пробиотиков на состояние микрофлоры кишечника заключаются в изменении уровня локального рН, создавая неблагоприятные условия для развития патогенных микроорганизмов; продукции бактериоцинов, ингибирующих рост патогенной микрофлоры и удаляющих свободные радикалы, оказывающие повреждающее действие на клеточные структуры; стимуляции продукции муцина слизистой оболочкой кишечника; улучшении функционирования интестинального барьера; конкуренции с патогенами в отношении адгезии к эпителиоцитам кишечника; обеспечении ряда иммунообусловленных эффектов (активация локальных макрофагов, презентирующих антигены В-лимфоцитам, увеличение синтеза секреторного IgА; модуляция содержания цитокинов; индукция гипореактивности к пищевым аллергенам и др.) [19].
К типичным представителям пребиотиков относятся препараты или биологически активные добавки немикробного происхождения, неперевариваемые в кишечнике, способные оказывать позитивный эффект на организм через стимуляцию роста и/или метаболической активности нормальной микрофлоры кишечника: олигосахариды (соевый олигосахарид, фруктоолигосахариды), моноса-хариды (ксилит, раффиноза, сорбит и др.); дисахариды (лактулоза), полисахариды (пектины, декстрин, инулин и пр.); а также пептиды (соевые, молочные и т.д.); ферменты (протеазы сахаромицетов, β-галактозидазы микробного происхождения и т.п.); аминокислоты (валин, аргинин, глутаминовая кислота); антиоксиданты (вита-мины А, С, Е, каротиноиды, глута-тион, Q10, соли селена и др.); ненасыщенные жирные кислоты (эйкозапентаеновая кислота и т.п.); органические кислоты (уксусная, пропионовая, лимонная и пр.); растительные и микробные экстракты (морковный, картофельный, кукурузный, рисовый, тыквенный, чесночный, дрожжевой и др.).
Кроме того, пребиотики относятся к одной из основных категорий функционального питания. Использование пищи с массой балластных веществ составляет оновную часть профилактических мероприятий для предупреждения развития нарушений микробиоценоза кишечника.
Пребиотики обладают выраженными бифидо- и лактогенными свойствами. Так, фруктоолигосахариды вызывают более чем 10-кратное повышение уровней бифидо- и лактобактерий в кале и значительное уменьшение количеств клостридий и энтеробактерий. В свою очередь повышение уровней бифидо- и лактобактерий приводит к подавлению роста и размножения сальмонелл, листерий, кампилобактеров, шигелл и вибрионов [20]. Метаболические эффекты пребиотиков достигаются и благодаря увеличению продукции КЖК. Добавление в рацион пребиотиков повышает всасывание в толстой кишке ионов кальция, железа, магния, положительно влияет на метаболизм липидов. Замена в рационе легкоусвояемых сахаридов пребиотическими компонентами с низким гликемическим индексом снижает риск развития сахарного диабета. Кроме того, пребиотики проявляют антиканцерогенное действие.
Международными экспертами разработаны показания к назначению пробиотиков при дисбиозах кишечника различного генеза с учетом уровня доказательности (табл. 2) [21].
Между тем на сегодняшний день список показаний к применению средств коррекции дисбиоза кишечника имеет тенденцию к увеличению, что связано с ростом доказательной базы эффективности этих препаратов. Назначение пробиотиков оправданно как для взрослых, так и для детей при снижении функции желудка, диффузных заболеваниях печени, дисфункции билиарного тракта, аномалиях развития тонкой и толстой кишки (в т.ч. дивертикулярной болезни), энтеропатиях (лактазная недостаточность, целиакия, спру), внешнесекреторной недостаточности поджелудочной железы, иммунодефицитных состояниях (СПИД, гемобластозы, онкозаболевания, состояние после химио- и лучевой терапии), системных заболеваниях соединительной ткани, сахарном диабете, сердечно-сосудистой патологии, дислипидемии, кожных и аллергических заболеваниях. Таким образом, средства коррекции дисбиоза кишечника составляют неотъемлемую часть лечебных мероприятий при всех заболеваниях внутренних органов.



