Дегенеративно-дистрофические поражения суставов являются одними из наиболее распространенных заболеваний и встречаются среди 10–12 % населения земного шара. Данная группа заболеваний объединена в 10-й Международной классификации болезней под общим термином «остеоартроз» (ОА) [1]. Установлено, что одним из основных факторов риска развития ОА является возраст. Так, в возрасте 50 лет этому заболеванию подвержены около 50 % населения, 60 лет – 80 % населения, 70 лет – около 90 %, причем более 25 % пациентов не могут справляться с основными ежедневными двигательными функциями, остальные предъявляют жалобы на затруднение выполнения функциональных обязанностей, особенно вне дома [2]. Среди больных ОА в молодом возрасте преобладают мужчины, в пожилом – женщины. По тяжести нарушения функции опорно-двигательного аппарата первое место занимают тазобедренный, коленный и голеностопный, а также плечевой суставы [3].
Экономический ущерб, связанный с патологией костно-мышечной системы (КМС), достаточно значим и сопоставим с затратами на лечение онкологических больных [4].
Одно из ведущих мест среди заболеваний КМС занимает ОА. На него приходится до 80 % всей суставной патологии и более 50 % всех ревматических болезней. Распространенность ОА в разных регионах мира колеблется от 13,6 до 41,7 % и значительно увеличивается по мере старения [5]. Различают первичный и вторичный ОА (табл. 1).

Истинная причина ОА до настоящего времени остается невыясненной. По современным представлениям, ОА – это мультифакториальное заболевание. В развитии дегенеративных изменений суставного хряща принимают участие сразу несколько факторов, среди которых можно выделить два основных: чрезмерную механическую и функциональную перегрузку хряща и снижение его резистентности к обычной физиологической нагрузке. Таким образом, основной предполагаемой причиной развития ОА остается несоответствие между механической нагрузкой, падающей на суставную поверхность хряща, и его возможностями выдерживать эту нагрузку, в результате чего развивается дегенерация и деструкция хряща.
Факторы риска развития ОА:
- наследственная предрасположенность;
- избыточная масса тела;
- профессиональные, спортивные или бытовые перегрузки;
- травмы;
- возраст больных старше 50 лет;
- другие заболевания суставов.
Известно, что разрушение хряща и потеря его биомеханических функций зависят от разрушения и потери внеклеточного матрикса. Это связано с катаболическим дисбалансом между распадом и ресинтезом компонентов матрикса как на молекулярном, так и на надмолекулярном уровне. Сложная сеть взаимодействий цитокинов, ферментов, свободных радикалов и продуктов распада матрикса приводит к уменьшению содержания протеогликанов в хряще (молекулярный уровень), нарушению архитектоники матрикса (макромолекулярный уровень), появлению микротрещин (микроскопический уровень) и надрывам хряща (макроскопический уровень). С распадом хряща фрагменты коллагена и протеогликана, а возможно, и другие компоненты матрикса попадают в синовиальную жидкость и стимулируют воспалительную реакцию в синовиальной ткани. Патологические процессы замыкаются в порочный круг: разрушение хрящевого матрикса сопровождается освобождением множества фрагментов хряща в полость сустава, что стимулирует воспаление синовиальной оболочки. Участвующие в развитии воспаления цитокины стимулируют синтез металлопротеиназ в хондроцитах с дальнейшей деградацией хряща, продукты которой в свою очередь провоцируют дальнейшее развитие воспаления [6–8].
Причина воспаления при ОА остается неясной: роль макромолекул – детритов хряща и кальцийсодержащих кристаллов остается спорной. Механизмом, посредством которого воспаление может участвовать в деградации хряща, служит выработка провоспалительных цитокинов – интерлейкинов (ИЛ): ИЛ-1β, ИЛ-6; фактора некроза опухоли и др., которые в свою очередь высвобождают ферменты, повреждающие коллаген (коллагеназу, эластазу, пептидазу), и протеогликаны (металлопротеиназу, стромелизин, катепсин), а также выработка простагландинов и активаторов плазминогена. Это играет важную роль в моделировании воспаления и восприятии боли. Некоторые продукты воспаления, такие как брадикинин и гистамин, способны сами стимулировать первичные афферентные нервные волокна, в то время как простагландины, лейкотриены, ИЛ-1β и ИЛ-6 могут повышать чувствительность этих волокон к различным экзогенным раздражителям. Провоспалительные цитокины, прежде всего ИЛ-1, под действием которого хондроциты продуцируют протеолитические ферменты (матриксные металлопротеиназы), вызывающие дегенерацию коллагена и протеогликанов. Однажды начавшееся высвобождение биологически активных веществ способствует поддержанию воспаления в тканях сустава при ОА, в результате происходит последующее повреждение синовиальной оболочки сустава с развитием реактивного синовита и повышением продукции провоспалительных цитокинов. Освобождающиеся протеогликаны, продукты распада хондроцитов и коллагена, являясь антигенами, могут индуцировать образование аутоантител с формированием локального воспалительного процесса. В норме в суставном хряще уравновешены процессы его синтеза (анаболизм) и деградации (катаболизм). При формировании ОА обычно наблюдается недостаточное образование или усиленный катаболизм компонентов хрящевой ткани.
Характерным признаком деструкции хряща при ОА является потеря матриксом глюкозамингликанов (хондроитинсульфата, кератансульфата, гиалуроновой кислоты). Кроме того, отмечается уменьшение молекул протеогликанов, которые становятся способными к выходу из матрикса хряща. В ранней стадии ОА мелкие измененные протеогликаны способны поглощать воду, но не способны прочно ее удерживать. Избыточная вода поглощается коллагеном, который набухает и разволокняется, что ведет к снижению резистентности хряща. В дальнейшем происходят дегидратация хряща, дезорганизация и разрыв коллагеновых волокон.
Для ОА характерны постепенное начало боли, возникновение и усиление боли при нагрузке и уменьшение в покое, «стартовые» боли, утренняя скованность менее 30 минут, «хруст» в суставе при движении, ограничение движений в суставе, деформация сустава. При объективном осмотре выявляются припухлость и сглаженность контуров сустава, деформация сустава, патологическая установка и укорочение конечности, мышечная атрофия, ограничение активных и пассивных движений, крепитация при активном движении в суставе, нестабильность связочного аппарата.
Для постановки диагноза требуется проведение дифференциальной диагностики с артритами иного генеза. В связи с чем проводятся дополнительные методы обследования (общеклинический анализ крови, общий анализ мочи, биохимический анализ крови: креатинин, АЛТ, АСТ, мочевая кислота; иммунологическое исследование крови: С-реактивный белок, ревматоидный фактор, определение антител к циклическому цитруллиновому пептиду; исследование синовиальной жидкости; рентгенография суставов). При наличии сомнительных результатов выполняются УЗИ и МРТ суставов, а также артроскопия.
Механический характер боли наиболее характерен для ОА. Боль возникает во второй половине дня и обусловлена снижением амортизационных способностей хряща и костных подхрящевых структур к механическим нагрузкам. Тупая ноющая ночная боль связана с венозным стазом в субхондральной кости и повышением внутрикостного давления. «Стартовая» боль связана с трением суставных поверхностей, на которые оседает детрит, состоящий в основном из организованного фибрина и фрагментов деструкции хряща. При первых движениях в суставе детрит выталкивается в суставную полость, и боль значительно уменьшается или проходит полностью. Болевая реакция в определенном положении сустава или при некоторых движениях обусловлена чаще всего прогрессирующим фиброзом суставной капсулы. «Блокада сустава» сопровождается резко выраженной болью, развивается вследствие ущемления между суставными поверхностями «суставной мыши» – хрящевого или костного фрагмента или воспаленной и отечной синовиальной оболочки. При этом острая интенсивная боль лишает больного возможности активных движений в пораженном суставе.
Метеолабильные боли беспокоят больного в период влияния неблагоприятных метеорологических условий.
Постоянные боли при ОА обусловлены множеством причин, однако рефлекторный спазм региональных мышц, хроническое раздражение окружающих мягких тканей остеофитом и реактивный синовит с отеком параартикулярных тканей встречаются как на ранней стадии, так и при далеко зашедшем суставном процессе и усугубляют клиническую картину.

Основные цели лечения ОА: уменьшение боли, коррекция функциональной недостаточности суставов, ограничение прогрессирования заболевания, улучшение качества жизни больных. В связи с этим лекарственная терапия направлена на уменьшение боли, воспалительных и структурных изменений в суставе и околосуставных тканях.
Лекарственные средства, применяемые при ОА:
- Обезболивающая и противовоспалительная терапия:
-
- анальгетики;
- нестероидные противовоспалительные препараты (НПВП);
- опиоидные анальгетики.
- Базисные (структуромодифицирующие препараты):
- хондроитина сульфат;
- глюкозамина сульфат, гидрохлорид;
- неомыляющиеся соединения сои/авокадо;
- диацереин (ингибитор ИЛ-1).
- Локальная терапия:
- поверхностное применение противовоспалительных, обезболивающих, отвлекающих, хондропротективных препаратов;
- околосуставное введение глюкокортикоидов, анальгетиков;
- внутрисуставное введение глюкокортикоидов, анальгетиков, производных гиалуроновой кислоты, противовоспалительных и хондропротективных препаратов;
- физиотерапевтические методы лечения.
Одним из наиболее эффективных базисных (структуромодифицирующих) препаратов является хондроитина сульфат. Препарат традиционно выпускается в формах для перорального приема. При приеме per os хондроитина сульфат быстро адсорбируется из желудочно-кишечного тракта, а его биодоступность составляет от 10 до 20 %. При этом в системный кровоток попадают преимущественно низкомолекулярные дериваты, обладающие меньшей фармакологической активностью по сравнению с нативными молекулами. Применение препаратов в инъекционных формах повышает биодоступность и клиническую эффективность. При внутримышечном введении хондроитина сульфат хорошо всасывается и через 30 минут обнаруживается в значительных концентрациях в крови, а спустя 15 минут – в синовиальной жидкости. Препарат накапливается главным образом в хрящевой ткани, при этом максимальная концентрация в суставном хряще достигается через 48 часов. Использование хондроитина сульфата в инъекционных формах потенциально может быть более эффективно при ведении пациентов с ОА.
Необходимость длительной терапии и наличие множества сопутствующих заболеваний у лиц с ОА определяют особые требования к безопасности применяемых лекарственных средств. Традиционное консервативное лечение НПВП и анальгетиками может сопровождаться побочными явлениями со стороны желудочно-кишечного тракта и сердечно-сосудистой системы, что ограничивает их широкое применение, особенно в старших возрастных группах. Хондроитина сульфат отличается высоким профилем безопасности и рассматривается в качестве одного из самых безопасных лекарственных средств лечения ОА. В клинических исследованиях хондроитина сульфата не было зарегистрировано серьезных нежелательных явлений. Считается, что использование инъекционных форм также будет отличаться высокой безопасностью и хорошей переносимостью.
Артрадол представляет собой белый или белый с желтоватым оттенком порошок. Активное вещество: хондроитина сульфат в пересчете на 100 %-ное сухое вещество – 100 мг. Препарат применяют внутримышечно по 100 мг через день. Перед применением содержимое ампулы растворяют в 1 мл воды для инъекций. При хорошей переносимости дозу увеличивают до 0,2 г начиная с 4-й инъекции. Курс лечения – 25–35 инъекций.
На базе кафедры терапии и ревматологии им. Э.Э. Эйхвальда Северо-Западного государственного медицинского университета им. И.И. Мечникова проведено исследование эффективности, переносимости и безопасности препарата Артрадол для пациентов с ОА коленных суставов.
Длительность исследования составила 4 месяца: 2 месяца – период лечения и 2 месяца – период наблюдения. В исследование были включены 30 больных с достоверным диагнозом (в соответствии с критериями Американской ревматологической ассоциации) ОА коленных суставов. Препарат вводился внутримышечно в дозе 1 мл (100 мг) через день (первые 3 инъекции), четвертая и последующие инъекции – 2 мл (200 мг). Всего было выполнено 30 инъекций на протяжении двух месяцев. Первые инъекции пациентам сделаны в условиях стационара. Пациентам проведена рентгенография коленных суставов, выполнены анализы крови: клинический (гемоглобин, лейкоциты, СОЭ) и биохимический (АЛТ, АСТ), анализ мочи.
На момент включения в исследование большинство пациентов принимали НПВП, доза которых была снижена всем больным. Во время исследования пациентам не назначались внутрисуставные инъекции глюкокортикоидов, препараты гиалуроновой кислоты и любые другие препараты, препараты, обладающие хондропротективными свойствами, а также антикоагулянты, антиагриганты, фибринолитики, физиопроцедуры.
Критерии включения:
- мужчины и женщины в возрасте 45–75 лет;
- установленный диагноз тибиофеморального ОА, согласно критериям Американской ревматологической ассоциации;
- боль при ходьбе ≥ 40 мм по визуальной аналоговой шкале;
- II или III стадия ОА по Kellgren–Lawrence;
- потребность в приеме НПВП (в течение 30 дней за последние 3 месяца);
- подписанное информированное согласие.
Критерии исключения:
- вторичный гонартроз: инфекционный артрит, системные воспалительные заболевания суставов, подагра, псевдоподагра, болезнь Педжета, внутрисуставные переломы, охроноз; акромегалия, гемохроматоз, болезнь Вилсона, первичный хондроматоз;
- индекс массы тела не более 40 кг/м2;
- внутрисуставное введение любых препаратов в течение 6 недель до начала исследования;
- хондрокальциноз;
- асептический некроз мыщелков бедренной и большеберцовой костей;
- оперативные вмешательства на коленном суставе;
- известная повышенная чувствительность к хондроитина сульфату;
- сопутствующие тяжелые заболевания (неконтролируемая артериальная гипертензия, нестабильная стенокардия, сердечно-сосудистая недостаточность, сахарный диабет 1 типа, тяжелые заболевания почек и печени);
- язва желудка или двенадцатиперстной кишки в течение последнего месяца;
- кровотечения и склонность к кровоточивости;
- тромбофлебиты в анамнезе;
- беременность;
- период лактации.
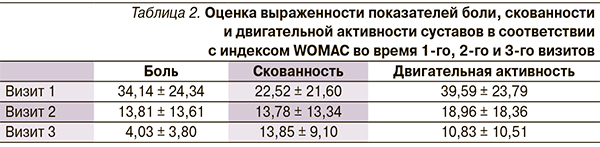
Анализ эффективности проведен в соответствии с оценкой по индексу WOMAC (Western Ontario and McMaster Universities osteoarthritis Index), который представляет собой анкету для самостоятельного заполнения больным. Анкета состоит из 24 вопросов, характеризующих выраженность боли (5 вопросов), скованность (2 вопроса) и функциональную способность (17 вопросов) больных гонартрозом и коксартрозом.
Для заполнения анкеты WOMAC обычно требуется 5–7 минут. Индекс WOMAC – высокоинформативный показатель, который можно использовать для оценки эффективности медикаментозного и немедикаментозного (хирургического, физиотерапевтического) лечения.
Исследование проведено в соответствии с принципами Хельсинкской декларации Международной медицинской ассоциации и рекомендациями по этике биомедицинских исследований. Статистическая обработка полученных результатов была проведена на персональном компьютере с использованием программного пакета STATISTICA.
Для анализа безопасности оценивались частота и характер нежелательных явлений, развившихся за период наблюдения, интенсивность, связь с приемом исследуемого препарата (связи нет, маловероятна, возможна, вероятна, определенна, неизвестна). Нежелательное явление: любой медицинский случай, происходящий с пациентом во время участия в исследо-вании вне зависимости от связи с проводимой терапией. Во время проведения исследования не наблюдалось серьезных нежелательных явлений. Показатели анализов крови: клинический (гемоглобин, лейкоциты, СОЭ) и биохимический (АЛТ, АСТ), анализ мочи; на фоне проводимого лечения не показали значимых отклонений от нормы. Ни один из включенных пациентов не был исключен из исследования.
Результаты исследования и их обсуждение
В исследование были включены 30 человек (5 мужчин, 25 женщин) в возрасте 54,0 ± 6,3 года с ОА коленных суставов. Среди пациентов преобладали пациенты (18 человек) со II стадией гонартроза, у 12 человек была выявлена III стадия гонартроза, длительность заболевания составляла 7,5 ± 3,2 года. Все 100 % пациентов принимали в анамнезе различные группы хондропротекторов, которые по причине неэффективности не используют более 6 месяцев. На момент включения в исследование все пациенты нуждались в приеме НПВП, 15 пациентов принимали Найз в суточной дозе 100–200 мг, 9 человек – диклофенак 75 мг, 3 чело-века – Мовалис 15 мг, 2 человека – Аркоксию 90 мг. Длительность приема составила более 30 дней за последние 3 месяца, у всех пациентов наблюдался достаточный эффект от проведенной терапии. Из числа обследованных 10 человек курили более 10 сигарет в день на протяжении более чем 5 лет, в связи с чем у всех выявлен хронический бронхит, кроме этого у 24 пациентов наблюдалась гипертоническая болезнь, у 4 – сахарный диабет 2 типа, все заболевания были компенсированы приемом соответствующих медикаментов.

При анализе опросников было выявлено значимое снижение показателей боли, скованности и функциональности суставов (табл. 2).
При сравнении опросников были выявлены значимые различия по боли. Показатели скованности отличались между первым и вторым визитами больных, а показатели двигательной активности – между первым, вторым и третьим визитами; различий у показателей скованности между вторым и третьим визитами не было (табл. 3).
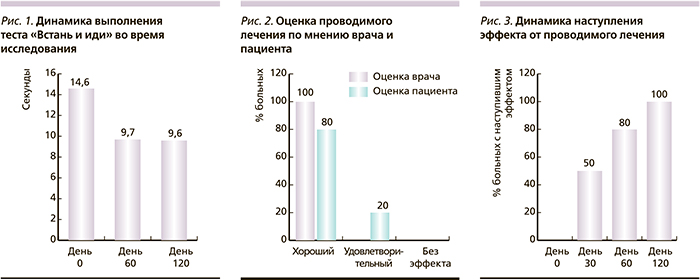
Каждый пациент выполнял функциональный тест «Встань и иди». Как видно из рис. 1, на фоне проводимого лечения Артрадолом уменьшалось время, требуемое для выполнения теста, что является показателем улучшения функционального состояния больных.
Через четыре месяца лечения произведена оценка наступления эффекта по мнению врача и пациента; как видно из рис. 2, большинство больных оценили эффект от проводимого лечения как «хороший». С 30-го дня от начала заболевания у половины испытуемых отмечено наступление эффекта, а к 120-му дню лечения у 100 % был отмечен эффект (рис. 3).
Во время исследования у пациентов снижалась потребность в постоянном приеме НПВП (табл. 4), а 5 (16 %) человек к четвертому месяцу лечения полностью отказались от приема НПВП.
Таким образом, можно сделать вывод о существенном влиянии препарата на показатели боли и функциональной активности при меньшем влиянии на скованность.
Анализ переносимости лекарственного средства выявил хорошую общую переносимость – у 1 пациента наблюдалась местная реакция в виде эритемы по передней поверхности бедер, возникшей после последнего (тридцатого) введения препарата, прошедшей самостоятельно в течение двух дней.
Заключение
- Артрадол обладает хорошими профилями переносимости, безопасности и выраженной обезболивающей активностью.
- На фоне терапии Артрадолом отмечается улучшение показателей болевого синдрома, функционального состояния суставов (при оценке в соответствии с индексом WOMAC).
- Артрадол позволяет пациентам с дегенеративно-дистрофическими заболеваниями суставов снижать потребность в НПВП.



