Особенности развития современного общества неизбежно приводят к изменению социальных приоритетов граждан, т. к. эти процессы взаимосвязаны. Меняется отношение к образу жизни, институту семьи, окружению, здоровью, репродуктивному поведению. Особое внимание в связи с этим должно уделяться программам сохранения здоровья современной женщины исходя из сегодняшних реалий.
Согласно статистическим данным МЗ РФ, наиболее частыми причинами обращаемости в профильные акушерско-гинекологические лечебно-профилактические учреждения являются воспалительные заболевания органов малого таза, нарушения менструальной функции, эндометриоз, бесплодие. По-прежнему актуальна проблема невынашивания беременности. Крайне высокой, несмотря на тенденцию к снижению, остается частота искусственных абортов, которые по-прежнему доминируют в структуре материнской смертности (не менее 20–25 %), способствуют росту гинекологической заболеваемости, усугубляя состояние здоровья женщин, снижая репродуктивный потенциал семьи и оказывая отрицательное влияние на течение последующих беременностей и родов. Очевидно, что снижение гинекологической заболеваемости и акушерских осложнений невозможно без внедрения профилактических мер, в т. ч. за счет предотвращения абортов, а значит, и связанных с ними осложнений.
Однако нужно хорошо понимать, что профилактика аборта прежде всего означает предотвращение нежеланной беременности, в то время как сам факт такой беременности – это уже в большей степени социальный, а не медицинский аспект проблемы, игнорирование или недоучет которого в большинстве случаев приводит женщину в абортарий. Вероятность наступления нежеланной беременности у современной женщины весьма высока, поскольку по своим физиологическим и социальным критериям она принципиально отличается от своей сверстницы последних десятилетий прошлого века. Наиболее значимы следующие особенности: более ранние менархе, с одной стороны, и более позднее наступление менопаузы, с другой; раннее начало добрачной половой жизни, очевидная тенденция к либеризации сексуальных отношений и как следствие – частой смене половых партнеров, отсроченное замужество, а значит, и более позднее рождение ребенка; уменьшение продолжительности грудного вскармливания в связи с занятостью женщины и как следствие – увеличение вероятности непланируемой беременности в очень ответственные для женщины первые месяцы после родов. Как минимум каждая десятая женщина обращается в медицинские учреждения для прерывания беременности в течение года после родов.
Профилактика аборта должна включать постоянную работу по формированию позитивного отношения к контрацепции среди населения и, что не менее важно, – у государственных структур. Речь должна идти о внедрении обязательных врачебных рекомендаций по целесообразности индивидуального подбора оптимального метода контрацепции для каждой женщины репродуктивного возраста, учитывая соотношение «польза/риск» каждого метода. Именно контрацепция способна сохранить репродуктивный потенциал женщины и ее здоровье до принятия ею решения о рождении желанного ребенка. Альтернативы такому подходу к решению проблемы нежеланной беременности на сегодняшний день не существует.
Печальный опыт введения запрета на проведение аборта как в России, так и за рубежом неизменно приводил к одному и тому же результату: росту криминальных абортов (несмотря на очень жесткие законодательные меры), росту гинекологических заболеваний (вследствие осложнений внебольничных абортов), инвалидизации женщины, резкому повышению уровня материнской смертности, снижению качества жизни, крушению института семьи. Попытки юридического закрепления за мужем права согласия на проведение аборта или введение т. н. недель тишины для отсрочки окончательного принятия решения беременной женщиной являются, по сути, полумерами, поскольку больше половины беременных женщин принимают решение о прерывании беременности самостоятельно, а каждая четвертая женщина репродуктивного возраста не состоит в браке. К тому же хорошо известно, что искусственные аборты, проведенные на более поздних сроках, ведут к росту числа осложнений. Экономическое решение вопроса (быстрое и достаточное материальное обеспечение незамужней женщины после рождения ребенка) также сомнительно – на здравоохранение в России выделяется чуть более 4 % ВВП, а медицинская и социальная помощь населению подразумевает не только нуждающихся в ней матерей, но и ряд других категорий граждан. Парадоксальным сдерживающим фактором решения проблемы аборта и более широкого внедрения контрацепции является то обстоятельство, что поиск оптимальных путей выхода из создавшейся ситуации происходит в условиях стойкого дефицита прироста населения.
 С точки зрения демографов и социологов, для решения проблемы необходимо укреплять семью с обязательным соблюдением минимум двух принципиально важных положений: обеспеченности жильем (в т. ч. доступным социальным) и изменением принципа оплаты труда (минимальный семейный душевой доход не должен опускаться ниже установленного условно приемлемого уровня независимо от числа детей).
С точки зрения демографов и социологов, для решения проблемы необходимо укреплять семью с обязательным соблюдением минимум двух принципиально важных положений: обеспеченности жильем (в т. ч. доступным социальным) и изменением принципа оплаты труда (минимальный семейный душевой доход не должен опускаться ниже установленного условно приемлемого уровня независимо от числа детей).
Интересно, что похожая концепция предложена американским демографом и экономистом Р. Истерлином еще в 1960-х гг. Согласно его выводам, на демографическое поведение влияет не столько абсолютный, сколько относительный уровень достатка: каждое поколение молодежи хочет достичь по крайней мере того же уровня достатка, какой был у родителей. Кроме того, доказано, что вступающее в жизнь поколение с недостаточными перспективами дохода и карьерного роста не торопится заводить семью и постоянное жилище, тем самым отдаляя время вступления в брак, соответственно, откладывается время рождения первого ребенка, а общее число детей оказывается меньшим, чем у молодых людей с более благополучными экономическими перспективами. Известно также, что наиболее сильно коррелирующий с рождаемостью фактор – это высшее образование у женщин. Поскольку высшее образование дает серьезное конкурентное преимущество в социуме, а на его получение требуется соответствующее время, рождение ребенка нередко также переносится на более поздние сроки. Подобная связь существует между миграцией и рождением ребенка. Типичные мигранты (молодой человек/девушка) вынуждены конкурировать с местными работниками того же возраста. Период адаптации может занять достаточно продолжительное время. Соответственно, для таких людей более типичны непродолжительные сексуальные взаимоотношения, которые не несут свойственных брачному союзу обязательств. Парадоксально, но миграция как мера, используемая для смягчения последствий снижения рождаемости, способствует еще большему ее подавлению и росту абортов [4].
В стране отмечается четкая тенденция к росту числа людей, предпочитающих одинокий образ жизни, 21 % граждан репродуктивного возраста никогда не состояли в браке. Если десятилетия назад семья воспринималась как основа правильного образа жизни, а поведение молодежи в конечном итоге было ориентировано на вступление в брак, сегодня доминирует приоритет индивидуалистических ценностей, который становится причиной одинокого образа жизни в ущерб долгосрочным семейным отношениям.
Не может не влиять на демографическую ситуацию и насилие в семье. По данным официальной статистики, насилие совершается в каждой четвертой российской семье, где происходит не менее 30–40 % всех тяжких преступлений, а жертвами становятся женщины, дети, инвалиды. Очевидно, что наблюдаемые в детстве сцены насилия могут воспроизвести агрессивное поведение и во взрослом состоянии, воспитать страх перед семьей как таковой, привести к нежеланию иметь детей, способствовать уходу молодых людей от ответственности перед близкими.
 Острейшей проблемой нашего общества является социальное сиротство. Согласно данным Федеральной программы «Дети России» (2007–2010), в России проживают 371 тыс. детей, оставшихся без попечения родителей и 676 тыс., находящихся в социально опасном состоянии, в число которых входят беспризорные, безнадзорные и малолетние преступники (в литературе встречаются и другие цифры – около 800 тыс. детей-сирот и до 1,5 млн беспризорных). Ежегодно выявляются до 100 тыс. детей, нуждающихся в опеке. Разумеется, государство оказывает поддержку семьям, взявшим детей под опеку, – в частности, увеличен размер пособий на приемных детей. Но вот парадокс – гуманный закон о попечительстве и опеке оборачивается трагической стороной – бумом возврата. Около 30 тыс. детей были возвращены в детские учреждения в течение 2 лет! Вырастая, дети-сироты нередко не в состоянии преодолеть трудности социализации, профессионального и личного самоопределения и не могут выстроить программу дальнейшей семейной жизни. Только 10 % выпускников сиротских учреждений находят свое место в жизни [5]. Очевидно, что игнорирование проблемы планирования семьи никак не уменьшит проблему социального сиротства и не решит проблему детей-инвалидов, число которых в стране не менее полумиллиона.
Острейшей проблемой нашего общества является социальное сиротство. Согласно данным Федеральной программы «Дети России» (2007–2010), в России проживают 371 тыс. детей, оставшихся без попечения родителей и 676 тыс., находящихся в социально опасном состоянии, в число которых входят беспризорные, безнадзорные и малолетние преступники (в литературе встречаются и другие цифры – около 800 тыс. детей-сирот и до 1,5 млн беспризорных). Ежегодно выявляются до 100 тыс. детей, нуждающихся в опеке. Разумеется, государство оказывает поддержку семьям, взявшим детей под опеку, – в частности, увеличен размер пособий на приемных детей. Но вот парадокс – гуманный закон о попечительстве и опеке оборачивается трагической стороной – бумом возврата. Около 30 тыс. детей были возвращены в детские учреждения в течение 2 лет! Вырастая, дети-сироты нередко не в состоянии преодолеть трудности социализации, профессионального и личного самоопределения и не могут выстроить программу дальнейшей семейной жизни. Только 10 % выпускников сиротских учреждений находят свое место в жизни [5]. Очевидно, что игнорирование проблемы планирования семьи никак не уменьшит проблему социального сиротства и не решит проблему детей-инвалидов, число которых в стране не менее полумиллиона.
Таким образом, имеющаяся в России демографическая ситуация и социальные реалии должны подразумевать поощрение рождаемости с обязательным одновременным проведением работы по социальной поддержке и адаптации населения, экономической и финансовой помощи и внедрению медико-санитарных просветительных мероприятий, включая планирование семьи.
Интересно, что исторически служба охраны здоровья женщины как научно обоснованное направление медицинской науки формировалась в России очень непросто [1]. Только в 1754 г. был принят проект об учреждении в Москве и Петербурге школ для «бабичего дела», первоначально открывшихся как отделения воспитательных домов, имевших по 20 кроватей «для замужних женщин свободного состояния». Прошло еще более 30 лет, когда в стране появились первые российские учебники по акушерству (Амбодик Н.М., 1789; Рихтер В.М., 1801). В 1797 г. появилось третье учреждение, занимавшееся лечением женских болезней, – Повивальный институт в Петербурге. В целом к началу ХХ в. число коек в роддомах составило около 7500, а оказание акушерско-гинекологической помощи было возможно не более 5 % жительниц страны, в то время как от заражения крови, кровотечений, других осложнений ежегодно умирали около 30 тыс. женщин. Значительные изменения в отношении охраны здоровья женщин России произошли в годы Советской власти. Показательно, например, что уже в сентябре 1920 г. в газете «Правда» была опубликована программная статья директивного характера, в которой предлагалось при местных женских отделах образовывать специальные комиссии, которые бы занимались «просветительской и практической работой по охране материнства и детства на заводах, фабриках и учреждениях». В 1922 г. был основан Государственный институт охраны материнства и младенчества, на базе которого в 1945 г. возникли Институт педиатрии и Институт акушерства и гинекологии, долгое время существовавшие при РАМН. С 1930 г. впервые в медицинских институтах страны стали открываться факультеты с двумя отделениями – для подготовки акушеров-гинекологов и педиатров. 1950–1980-е гг. характеризовались в т. ч. внедрением в советское здравоохранение огромного количества законопроектов, направленных на поддержку семьи, охрану здоровья женщин и детей, улучшение их качества жизни. В 1990-е гг. была запушена и успешно реализована Федеральная программа по планированию семьи, когда широкая популяризация контрацепции в стране, прежде всего гормональной, позволила существенно (почти в 3 раза) снизить число абортов.
В 2000-х гг. окончательно сформирована система оказания помощи женщинам и детям на всех ее уровнях: поликлиника–стационар–реабилитационные учреждения. Существенным фактором улучшения оказания медицинской помощи стало появление в стране новых лекарственных препаратов.
Касаясь лекарственного обеспечения и возможности применения современных лекарственных средств (ЛС), следует заметить, что вне зависимости от уровня экономического развития в большинстве стран, включая Россию, затраты на ЛС не компенсируются в полном объеме. Проводится государственная политика сдерживания расходов на лекарственное обеспечение. В нашей стране в основу такой доктрины положены принцип рационального отбора и использования лекарственных препаратов, а также реализация комплекса мер, направленных на обеспечение доступности безопасных эффективных ЛС гарантированного качества. Очень важным здесь является повышение прозрачности в сфере обращения ЛС, в т. ч. усиление контроля и надзора за обращающейся фармацевтической и медицинской продукцией. Значимым фактором, оказывающим влияние на фармацевтический рынок РФ, является задекларированный в соответствии с Федеральным законом «Об обращении лекарственных средств» переход на соответствие правилам GMP (Good Manufacturing Practice – Надлежащая производственная практика) с 01.01.14.
При выборе ЛС необходимо руководствоваться действующими стандартами медицинской помощи, современными клиническими рекомендациями по лечению конкретных заболеваний, достоверными источниками информации о фармакологических препаратах. Следует выбирать ЛС, в отношении которых существуют доказательства их безопасности и эффективности, и избегать их необоснованного дублирования в клинической практике при сходном терапевтическом действии. При этом показатели стоимости курса лечения важны, только когда оценка соотношения «стоимость/эффективность» проводится только в рамках одной и той же терапевтической группы, систематизированной в соответствии с Анатомо-терапевтическо-химической классификацией. В противном случае затраты на проведение лечения не могут быть критерием его выбора. Эффективность ЛС, их безопасность и приемлемость определяются свойствами активных (действующих) веществ, как правило имеющих международные непатентованные названия (МНН), присваиваемые ВОЗ. Торговое название, данное готовому препарату компанией-производителем, в этом отношении имеет прикладное значение [6].
Очевидно, что, говоря о применении контрацептивов (КП) как важнейшей составляющей программы сохранения репродуктивного здоровья женщин, следует руководствоваться теми же принципами подбора ЛС (включая классификацию по МНН), основываясь на характеристиках действующих субстанций контрацептивных препаратов. Следует особо отметить, что только гормональные ЛС для предохранения от нежеланной беременности в отличие от спермицидов, традиционных внутриматочных спиралей, хирургической стерилизации и естественных методов контрацепции оказывают доказанный сопутствующий терапевтический эффект (коррекция менструального цикла, профилактика онкологических процессов яичников и эндометрия, антиандрогенный эффект, противовоспалительное действие и др.) [8].
Реальные попытки применения гормонов для предотвращения нежелательной беременности у женщин известны с 1950-х гг. Первым в экспериментальных работах по предотвращению овуляции стал использоваться женский половой гормон прогестерон. Однако в связи с необходимостью применения больших дозировок (сотни миллиграммов), быстрой инактивацией в желудочно-кишечном тракте и выраженными побочными реакциями – ациклическими маточными кровотечениями – начался поиск других прогестагенов для пероральной контрацепции.
Исследования продолжились по двум основным направлениям.
С одной стороны, появились синтетические, сходные по структуре с прогестероном прогестагены, т. н. ацетилированные прегнановые производные: ципротерона ацетат, хлормадинона ацетат, медроксипрогестерона ацетат, мегестрола ацетат. Другое направление привело к синтезу прогестагенов, по структуре сходных с тестостероном и относящихся к его эстрановым производным: появились норэтиндрон, норэтинодрел, линестенол, норэтиндрона ацетат, этинодиола диацетат. Несмотря на то что прогестагенная активность этих активных субстанций при пероральном приеме была значимо выше, чем у прогестерона, вводимого парентерально, их суточные дозы, необходимые для подавления овуляции также измерялись в миллиграммах. В связи с этим были продолжены усилия по синтезу еще более активных аналогов прогестерона, что привело к получению в 1960-х гг. левоноргестрела, относящегося уже к гонановым производным тестостерона, первого полностью синтетического перорального гестагена, и позволило значительно снизить суточную дозировку до микрограммовых значений.
 Однако повышение прогестагенной активности сопровождалось и усилением андрогенных свойств, что, в частности, в свое время способствовало использованию препаратов, содержащих производные тестостерона, для лечения гиперпластических процессов в эндометрии.
Однако повышение прогестагенной активности сопровождалось и усилением андрогенных свойств, что, в частности, в свое время способствовало использованию препаратов, содержащих производные тестостерона, для лечения гиперпластических процессов в эндометрии.
Прошло еще более 20 лет, прежде чем в клиническую практику были внедрены новые синтетические этинилированные гонановые производные тестостерона – гестагены – со значительно меньшей андрогенной активностью. Клинически самыми важными из них стали дезогестрел, гестоден и норгестимат. Спустя полтора десятилетия появился первый гибридный прогестин – диеногест, сочетающий типичные особенности 19-нортестостерона и производных прогестерона, а через несколько лет в клинической практике с целью контрацепции стал применяться дроспиренон, производное спиронолактона, обладающий еще и антиминералокортикоидным действием. Наконец, несколько лет назад зарегистрирован первый норпрогестерон – номегэстрола ацетат, более активный по сравнению с натуральным прогестероном.
Гормональные КП присутствуют на современном фармацевтическом рынке в самых различных лекарственных формах: таблетки для перорального применения, импланты, накожные пластыри, интравагинальные кольца, внутриматочные системы, растворы для внутримышечных инъекций. Однако в структуре гормональных КП, как и десятилетия назад, по-прежнему доминируют лекарственные формы для перорального применения.
За время использования пероральных КП, а это более 50 лет, синтезировано несколько поколений гестагенов, входящих в их состав. Каждое новое поколение имело меньше побочных эффектов, чем предыдущее, сохраняя или даже усиливая контрацептивные свойства. С целью повышения приверженности к приему гормональных препаратов, к гестагенному компоненту добавлен эстроген, при этом наиболее эффективным эстрогеном при пероральном приеме оказался синтетический 17α-этинил-эстрадиол, который и сегодня входит в состав большинства комбинированных гормональных КП. Практически не влияя на эффективность контрацепции, этинил-эстрадиол (ЕЕ) способствует профилактике ациклических кровотечений, поддерживая адекватную трофику эндометрия. Установлено, что при концентрации ЕЕ в комбинированных пероральных КП (КОК) до 20–30 мкг частота осложнений резко снижается, в то время как приемлемость остается достаточно высокой. Именно по содержанию ЕЕ комбинированные гормональные КП классифицируются как высоко- (больше 35 мкг ЕЕ), низко- (30–35 мкг ЕЕ), микро- (20 мкг ЕЕ) и ультрамикродозированные (15 мкг ЕЕ).
Очевидно, что при практически 100 %ной эффективности всех современных гормональных КП при их правильном применении выбор кроме доступности и стоимости определяется главным образом хорошей переносимостью и безопасностью, что в значительной степени зависит от вида прогестагена и концентрации ЕЕ [7].
Биологические эффекты гестагенов определяются их взаимодействием как с прогестероновыми рецепторами (гестагенный эффект), так и с андрогенными (остаточный андрогенный или, наоборот, антиандрогенный эффект), глюкокортикоидными, минералокортикоидными, иногда эстрогенными и другими рецепторами. В целом все синтетические прогестагены более активны и менее селективны по сравнению с природным прогестероном. Что касается эстрогенов, то кроме значительного уменьшения вероятности ациклических кровянистых выделений они усиливают секрецию апокриновых и парауретральных желез, предотвращая дискомфорт во влагалище; уменьшают секрецию сальных желез, тем самым способствуя позитивному косметическому эффекту, повышают усвоение кальция костной тканью, устраняя остеопороз и активируя функцию остеобразования. Помимо этого эстрогены снижают уровень атерогенных фракций липидов в крови, благотворно влияют на функцию мозга и подкорковых структур, снимая вегетососудистые и психоэмоциональные расстройства.
Становится понятным, почему монофазные препараты помимо целей надежной контрацепции рекомендуются женщинам с нарушениями менструального цикла, гиперпластическими процессами со стороны эндометрия, фиброзно-кистозной мастопатией, а также при различных дизадаптационных и стрессовых ситуациях, способствующих перенапряжению нейроэндокринной системы, в т. ч. после аборта и родов, когда в силу различных обстоятельств женщина не может кормить грудью. В связи с уменьшением дозы эстрогенов (до 5–7 раз) и гестагенов (до 100–120 раз) по сравнению с препаратами 1960–1970-х гг. современные КОК стали более безопасными: их можно использовать как начинающим половую жизнь молодым нерожавшим женщинам, так и женщинам среднего и старшего репродуктивного возраста. Разумеется, в любом случае следует помнить о возможных противопоказаниях к использованию гормональной контрацепции, поэтому выбор метода, продолжительность и режим его применения необходимо предварительно обсудить с врачом-акушером-гинекологом [8].
В качестве примера широких возможностей использования КОК можно остановиться на лекарственном препарате, содержащем хлормадинона ацетат (ХМА) 2 мг и ЕЕ 30 мкг, применяемом в России около 10 лет и известном также под торговым названием «Белара». Длительное (более 21 дня) применение лекарственного препарата приводит к уменьшению секреции фолликулостимулирующего и лютеинизирующего гормонов и, следовательно, к подавлению овуляции, пролиферации эндометрия и его секреторной трансформации. Одновременно изменяются свойства слизи цервикального канала, что сопровождается затруднением прохождения сперматозоидов и нарушением их подвижности. Входящий в состав препарата ХМА представляет собой прогестаген с антиандрогенными свойствами. Суточная доза ХМА, обеспечивающая полное подавление овуляции, составляет 1,7 мг. Необходимая доза на цикл – 25 мг. Механизм антиандрогенного действия связан, в частности, c изменением образования андрогенов и способностью их замещения на специфических рецепторах.
Анализ продолжительного применения этого ЛС и результаты проведенных клинических исследований включают не только изучение его контрацептивного эффекта, переносимости и безопасности, но и оценку сопутствующих позитивных свойств, включая антиандрогенный эффект, уменьшение кровопотери, коррекцию массы тела, косметический эффект и др. Особенности фармакокинетики и фармакодинамики препарата в первую очередь определяются сходством ХМА и естественного прогестерона [13].
После приема препарата внутрь ХМА и ЕЕ быстро и полностью абсорбируются из желудочно-кишечного тракта. Cmax эстрадиола достигается через 1,5 часа, Cmax ХМА – через 1–2 часа. Период полувыведения ХМА составляет примерно 34–39, ЕЕ – 12–14 часов. Метаболиты ХМА выводятся почками и через кишечник в соотношении 2 : 3. Метаболиты ЕЕ – растворимые в воде сульфатные или глюкуроновые конъюгаты – выводятся почками и через кишечник в соотношении 4 : 6 [14].
ХМА быстро всасывается в кровь из кишечника и не подвергается метаболизму при первом прохождении через печень, соответственно, его биодоступность составляет около 100 %. ХМА не взаимодействует в плазме с глобулинами, связывающими половые стероиды (ГСПГ), образуя связь только с альбумином (96,9–99,4 %), поэтому не оказывает влияния на концентрацию других половых гормонов в крови, взаимодействующих с ГСПГ.
Результаты фармакокинетических исследований женщин, принимавших лекарственный препарат Белара в течение 6 циклов, показали, что плазменная концентрация ХМА достигает пика в 2000 пкг/мл (Cmax) через 1–2 часа после приема таблетки [14], при этом уровень ХМА остается стабильным за счет отсутствия его кумуляции. У большинства женщин стабильная плато-
образная концентрация ХМА в 400–500 пкг/мл достигается в первые 8–15 дней после приема препарата [9, 14]. После абсорбции из кишечника ХМА быстро распределяется в тканях организма, преимущественно в жировой ткани, откуда поступает обратно в кровь [9]. Связывание с белками крови, накопление в жировой ткани и стабильный уровень кишечно-печеночного кровообращения – все это вместе объясняет длительный период полувыведения, что обеспечивает устойчивый уровень ХМА в организме женщины. ХМА подвергается интенсивному метаболизму в печени, что приводит к появлению различных метаболитов, большинство из которых фармакологически неактивны и которые выводятся из организма почками и через кишечник [14].
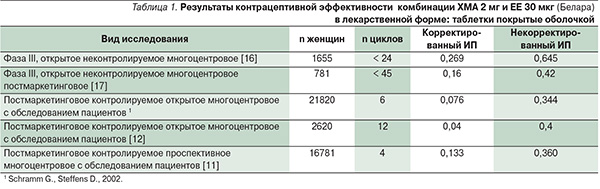
Одним из способов оценки эффективности противозачаточного препарата является определение индекса Перля (ИП), отражающего вероятность наступления беременности у 100 женщин, ведущих регулярную половую жизнь и принимающих контрацептивное средство в течение года. Чем меньше ИП, тем более эффективен используемый метод контрацепции. Противозачаточная эффективность комбинации ХМА 2 мг и ЕЕ 30 мкг изучена в III (предрегистрационной) и IV (постмаркетинговой) фазах клинических исследований [13, 16]. В одном из исследований III фазы наблюдали 1655 женщин, принимавших Белару, в течение 22 337 циклов [16]. Было зарегистрировано 12 случаев беременности, а ИП составил 0,645 % (95 % доверительный интервал: 0,359–1,092). Однако большинство случаев беременности были связаны с неправильным приемом препарата. В частности, в некоторых случаях Белара принималась вместе с антибиотиками, в других – у женщин во время приема ЛС наблюдалась рвота или диарея, что значительно снижало эффективную дозу препарата. Аналогичные результаты, связанные с потерей эффективной дозы, наблюдались и при приеме других контрацептивных препаратов. С учетом этих данных повторно вычисленный корректированный ИП составил всего 0,269 (95 % доверительный интервал: 0,106–0,600).
 В другом контролируемом постмаркетинговом исследовании наблюдали 2620 женщин (29 262 цикла), принимавших Белару в течение 12 месяцев. В целом наблюдалось 10 случаев беременности [12]. Таким образом, некорректируемый ИП составил 0,4 (95 % доверительный интервал: 0,2–0,8; табл. 1). При этом 90 % наступивших беременностей были связаны с ошибками в приеме препарата: 8 из 9 забеременевших женщин забывали принимать ЛС несколько раз. В результате откорректированный ИП составил 0,04 (95 % доверительный интервал: 0,002–0,200).
В другом контролируемом постмаркетинговом исследовании наблюдали 2620 женщин (29 262 цикла), принимавших Белару в течение 12 месяцев. В целом наблюдалось 10 случаев беременности [12]. Таким образом, некорректируемый ИП составил 0,4 (95 % доверительный интервал: 0,2–0,8; табл. 1). При этом 90 % наступивших беременностей были связаны с ошибками в приеме препарата: 8 из 9 забеременевших женщин забывали принимать ЛС несколько раз. В результате откорректированный ИП составил 0,04 (95 % доверительный интервал: 0,002–0,200).
Другие клинические исследования и постмаркетинговые контролируемые исследования комбинации ХМА 2 мг и ЕЕ 30 мкг также продемонстрировали аналогичный низкий индекс Перля (табл. 1).
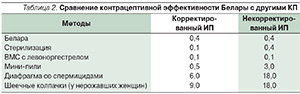
Соответственно, как корректированный, так и некорректированный ИП при использовании КОК Белара находится в тех же пределах или даже ниже, чем ожидаемый ИП для других КОК, – 0,1–0,9 [13, 16]. Более того, контрацептивная эффективность комбинации ХМА 2 мг и ЕЕ 30 мкг сопоставима с таковой при стерилизации и намного выше противозачаточной эффективности других негормональных методов КП (табл. 2).
Как и для большинства других современных КОК при их применении в соответствии с рекомендациями ВОЗ, пероральный прием комбинации ХМА 2 мг и ЕЕ 30 мкг в форме таблеток, покрытых оболочкой, демонстрирует ее хорошую переносимость и высокую степень безопасности.
В частности:
- регистрируются регулярные менструальноподобные кровотечения отмены;
- уменьшаются продолжительность, интенсивность и болевые ощущения при кровотечениях отмены;
- уменьшается степень выраженности и распространения угрей и себореи вплоть до их исчезновения (в первую очередь как следствие антиандрогенного действия ЛС);
- нет значимого влияния на массу тела;
- отсутствует клинически значимое воздействие на функцию печени;
- отсутствует клинически значимое влияние на метаболизм углеводов;
- отмечается благоприятное влияние на липидный профиль, что снижает риск развития атеросклеротических поражений;
- отсутствует клинически значимое влияние на артериальное давление;
- отсутствуют убедительные данные о влиянии на либидо и настроение;
- отсутствуют клинически значимые данные о воздействии на свертывающую систему крови, в т. ч. сведения о значительном увеличении риска развития тромбоэмболических осложнений.
В исследовании, включившем 1655 женщин, принимавших Белару в течение 24 циклов, кровотечения отмены наблюдались регулярно в 92,0 % всех циклов [16]. Кровотечения отмены отсутствовали лишь в 7,4 % всех циклов (в 0,6 % случаев – данные отсутствовали). Аналогичная клиническая картина имела место и при более продолжительном (до 45 циклов) периоде применения ЛС [17].
Продолжительность менструальноподобного кровотечения отмены в первые 3 цикла составляла в среднем 4,5–5,0 дней, после чего наблюдалась тенденция к некоторому уменьшению их продолжительности [16, 17]. Женщины, начавшие прием препарата, указывали, что кровотечения отмены были короче по продолжительности, чем менструации в течение 3 циклов до начала приема Белары.
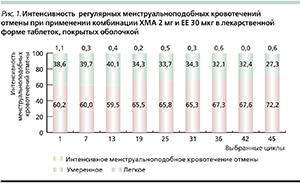
Среди женщин, принимавших Белару продолжительностью до 45 циклов, соотношение женщин с менструальноподобным кровотечением отмены, расцениваемым как легкое, постепенно увеличивалось от 1-го цикла (60,2 %) к 45-му (72,2 %; рис. 1) [16, 17]. В то же время процент женщин с умеренно интенсивным кровотечением отмены снижался с 38,8 % в 1-м цикле, до 27,3 % в 45-м. Частота интенсивных кровотечений отмены была ниже 1,8 % во всех циклах.
В исследовании, включившем 21 820 женщин, число пациенток с кровотечением отмены легкой и умеренной степени интенсивности увеличилось с 84,8 (исходно) до 93,7 % (после приема Белары в течение 6 циклов). В то же время число женщин, страдавших интенсивными кровотечениями отмены, снизилось с 14,0 (исходно) до 1,2 % (в конце исследования). Это означает, что число пациенток с интенсивными кровотечениями отмены снизилось на 91,4 % [12].
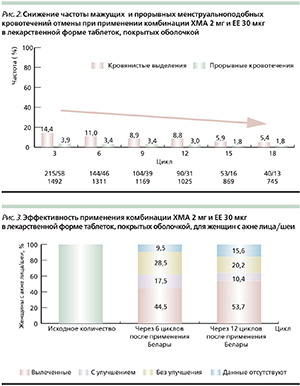
В III фазе клинического исследования на протяжении 22 337 циклов применения ЛС Белара мажущие кровянистые выделения и прорывные кровотечения наблюдались в среднем только в 11,5 и 3,5 % всех циклов соответственно [16]. При этом частота мажущих кровянистых выделений и прорывных кровотечений по мере продолжительности приема Белары снижалась (рис. 2).
В III фазе другого исследования на протяжении 23 033 циклов отмечены ациклические кровянистые выделения/кровотечения, частота которых колебалась в пределах 1,6–6,4 % [17]. В основе своей они не были интенсивными; чаще отмечались скорее мажущие кровянистые выделения, чем прорывные кровотечения. Средняя продолжительность таких кровотечений варьировалась от 2,2 до 6,4 дня.
Эти данные были также подтверждены большим постмаркетинговым контролируемым исследованием, показавшим, что в 90,5 % всех 125 634 циклов приема Белары не наблюдалось каких-либо ациклических кровотечений. При этом мажущие кровянистые выделения и прорывные кровотечения наблюдались только в 7,8 и 1,7 % циклов соответственно [12]. Среди женщин, указывавших на регулярный менструальный цикл до приема Белары, ациклические кровотечения уменьшались с каждым циклом приема препарата.
У 67,6 % всех женщин, страдавших дисменореей в течение последних 2 циклов до приема Белары, после 6 циклов приема препарата боль полностью прекратилась (у 6902 из 10 225) [12].
Белара существенно улучшает общее клиническое состояние кожи женщин, предрасположенных к образованию угревой сыпи. Впервые улучшение состояния кожи, склонной к образованию угревой сыпи, было подтверждено с помощью современных количественных и объективных биофизических методов [10, 11, 16, 17] (рис. 3).
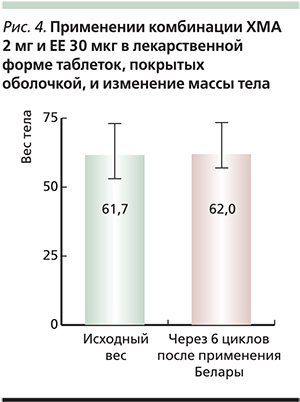
Результаты III фазы исследования, которое включило 1655 женщин, не выявили существенного изменения массы тела на протяжении 22 циклов приема Белары [12, 16] (рис. 4). В другом исследовании III фазы при наблюдении за 781 женщиной в течение 45 циклов отмечены аналогичные результаты (увеличение массы тела менее чем на 1 кг) [17].
В отличие от некоторых других прогестинов ХМА не влияет на активность цитохрома Р450 и монооксидазы в печени. Как было показано в нескольких больших и продолжительных клинических исследованиях III фазы, Белара не оказывает клинически значимого влияния на функцию печени. Не было обнаружено и клинически значимого влияния на метаболизм углеводов [16, 17]. В описанных исследованиях не было отмечено возникновения инсулинорезистентности и нарушения толерантности к глюкозе при приеме препарата.
При изучении влияния приема Белары на показатели липидов крови в течение 6 циклов уровень общего холестерина оставался стабильным. Отмечено достоверное снижение холестерина липопротеинов низкой плотности и увеличение концентрации холестерина липопротеинов высокой плотности по сравнению с исходным уровнем (р = 0,04) [15]. Длительный прием Белары не вызывает клинически значимых изменений систолического, диастолического артериального давления и числа сердечных сокращений [16, 17].
При проведении клинических исследований изучались и другие клинические параметры [16, 17], включая настроение, либидо, функцию почек, гематологические показатели (гемоглобин, эритроциты, лейкоциты, тромбоциты, гематокрит), электролитный баланс, функцию щитовидной железы, функцию печени. Показано, что на фоне приема Белары все перечисленные параметры практически не изменялись или изменялись незначительно, что не имело клинического значения.
За последние годы не было выявлено новых, отличных от ранее зарегистрированных в Инструкции по медицинскому применению КОК нежелательных явлений, что, однако, не означает, что Белара, как и другие КОК, может приниматься без консультации с врачом. Следует помнить, что такие препараты рецептурны и могут быть назначены только врачом после соответствующего стандартного обследования и осмотра пациентки.
Таким образом, своевременное и обоснованное использование методов контрацепции, включая КОК, имеют существенное значение в сохранении репродуктивного здоровья женщины. Целесообразность и условия их применения в настоящее время очевидны.



