Сахарный диабет 2 типа (СД2) является одним из самых распространенных и опасных заболеваний современного человечества. Так, число больных СД2 на Земле в 2011 г. достигло 366 млн, а к 2030 г. эта цифра увеличится до 552 млн. Около 183 млн человек на планете живут с недиагностированным СД2. По мнению экспертов Международной диабетологической федерации (IDF – International Diabetes Federation), в России число больных СД2 в 2011 г. составило 12,6 млн. В том же году это заболевание унесло жизнь 4,6 млн жителей Земли (IDF DIABETES ATLAS, Fifth edition, 2011).
Очень серьезной проблемой современной диабетологии является высокая распространенность больных СД2, которые не достигают индивидуальных целей терапии заболевания, а следовательно, живут в состоянии хронической декомпенсации углеводного обмена. По этой причине у больных СД2 быстро прогрессируют осложнения, они инвалидизируются и в результате наступает преждевременная смерть [1, 2]. Широко распространена абсолютно справедливая точка зрения, будто причина преждевременной инвалидизации и смерти больных СД2 – в хронической декомпенсации углеводного обмена, которая является следствием неадекватной коррекции гликемии и неудовлетворительного самоконтроля заболевания. Однако существует еще одна очень серьезная причина, затрудняющая достижение цели терапии СД2, – позднее выявление этого заболевания [3].
СД2, за редчайшим исключением, никогда не сопровождается клинической симптоматикой, кроме избыточной массы тела, т. е. долгие годы в подавляющем большинстве случаев протекает бессимптомно [4]. Именно по этой причине во всем цивилизованном мире, включая Россию, существует необсуждаемая рекомендация выявлять СД2 активно, а именно путем скрининга. Скрининг СД2 проводится всем без исключения лицам, достигшим 45-летнего возраста, независимо от наличия или отсутствия у них факторов риска развития СД2. Лицам моложе указанного возраста тоже в обязательном порядке проводится скрининг, если у них присутствуют факторы риска развития этого заболевания. Однако в реальной практике этот рутинный диагностический стандарт далеко не всегда выполняется, а распространенный скрининг гипергликемии (кстати, нередко исследуется глюкометром) и гиперхолестеринемии постепенно подменил понятие скрининга СД, что абсолютно не является ни синонимом, ни альтернативой последнего.
Скрининг гипергликемии, являясь несомненно полезным исследованием, позволяет выявлять в основном только поздние стадии болезни. Даже такое выявление СД2 лучше, чем во время уже случившегося острого инфаркта или инсульта. Однако следует осознавать, что подобная диагностическая тактика обнаруживает лишь возвышающуюся над поверхностью верхушку айсберга и исключает возможность выявления предиабета и ранних стадий СД2. Доказано, что в отсутствие правильно проводимого скрининга перечисленные состояния углеводного обмена никогда своевременно не выявляются. В результате нарушение β-клеточной функции прогрессирует, а поздно начатое лечение оказывается малоили неэффективным. Именно поздняя диагностика СД2 во многом определяет дальнейшую судьбу этих больных [5].
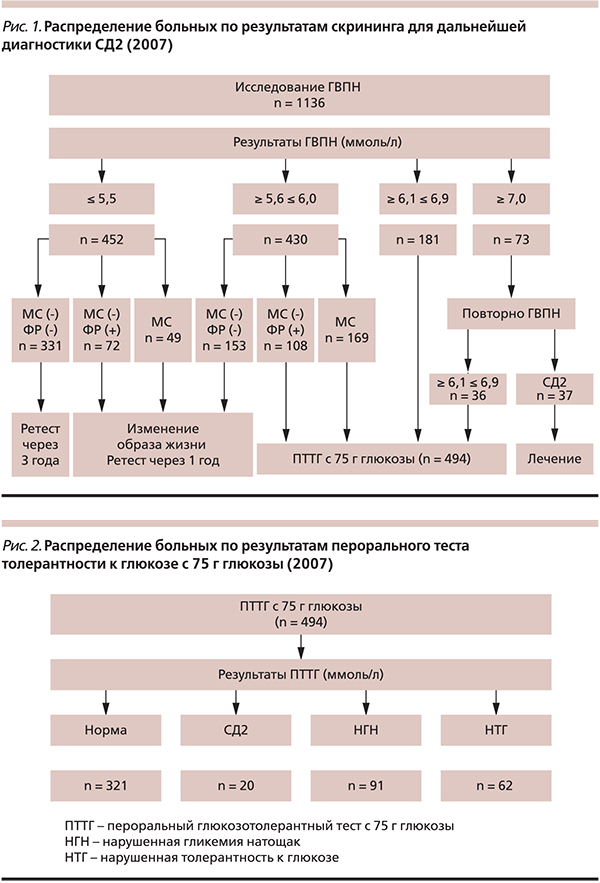
С целью раннего выявления любых нарушений углеводного обмена в 2007 г. среди взрослого населения Тамбовского района был проведен скрининг СД с использованием “золотого” стандарта в виде глюкозы венозной плазмы натощак (ГВПН). В дальнейшем в рамках программы дополнительной диспансеризации в поликлиническом отделении Тамбовской ЦРБ был организован амбулаторный прием всех лиц, скринированных на предмет выявления СД2. Были обследованы 1137 человек (267 мужчин и 869 женщин в возрасте от 22 до 76 лет), считавших себя абсолютно здоровыми. Благодаря скринингу у одной женщины был выявлен СД 1 типа. Немедленное назначение инсулинотерапии позволило ей избежать манифестации заболевания в состоянии кетоацидоза или кетоацидотической комы.
У 73 человек уровень ГВПН составил ≥ 7,0 ммоль/л. Всем им было проведено повторное исследование ГВПН, после которого у 37 пациентов подтвердился диагноз СД2. Для остальных 36 пациентов гликемия оказалась в пределах ≥ 6,1 ≤6,9 ммоль/л. Этим лицам и еще 181 из 1136 обследованных, у которых при скрининге выявилась нарушенная гликемия натощак (НГН), был назначен пероральный тест толерантности к глюкозе (ПТТГ) с 75 г глюкозы.
Для 882 обследуемых ГВПН оказалась ниже 6,1 ммоль/л, что в соответствии с действующими критериями ВОЗ (1999) является нормой и не требует диагностики СД в ближайшее время. Однако после многолетних исследований Американская диабетологическая ассоциация (AДA – American Diabetes Association, 2003) утвердила в США в качестве нормального значение ГВПН < 5,6 ммоль/л. Соответственно, в США диагностические мероприятия в виде проведения ПТТГ рекомендуется проводить уже при ГВПН натощак ≥ 5,6 ммоль/л. IDF, которая не приняла американские стандарты, в 2005 г. в качестве компромисса предложила проводить ПТТГ всем лицам с метаболическим синдромом (МС), у которых гликемия натощак соответствует ≥ 5,6 ммоль/л. Среди обследуемых нами лиц у 430 человек ГВПН оказалась в пределах ≥ 5,6–≤ 6,0 ммоль/л. Признаки МС были выявлены среди 39,3 % человек (169 из 430). Им был назначен ПТТГ в соответствии с рекомендациями IDF. У 261 обследуемого не было полной картины МС, однако у 108 из них присутствовали факторы риска развития СД2, в связи с чем им тоже был назначен ПТТГ (рис. 1).
У 452 человек ГВПН была в абсолютно нормальных значениях (≤ 5,5 ммоль/л) и соответствовала критериям ВОЗ и АДА. Важно подчеркнуть, что именно в этой группе обследуемых МС наблюдался лишь в 10,8 % (49 из 452) по сравнению с 39,3 % среди лиц с более высокой гликемией. Лицам с МС и без него, но с наличием факторов риска СД2 повторное исследование ГВПН было проведено через год. Остальным обследуемым без МС и факторов риска развития СД2 ретест ГВПН назначался через три года.
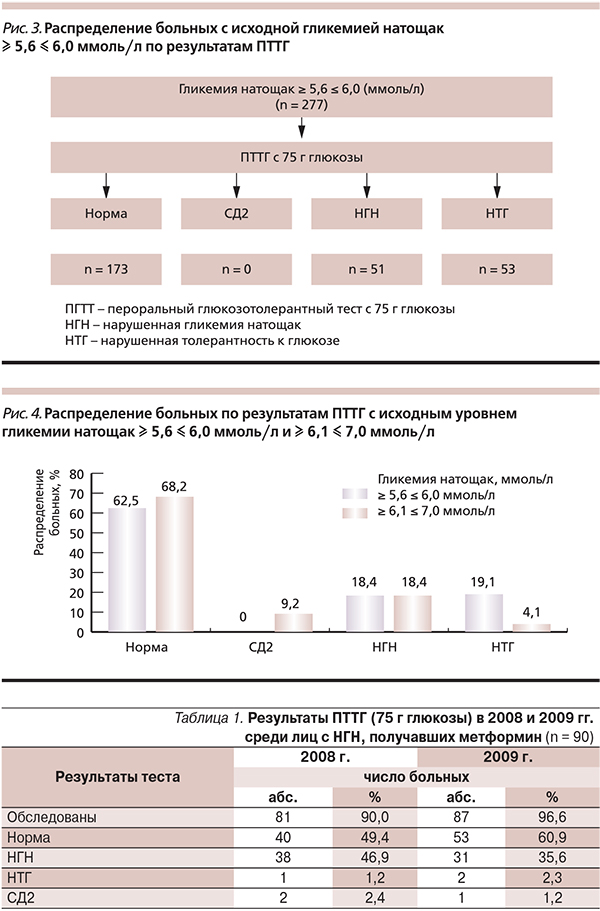
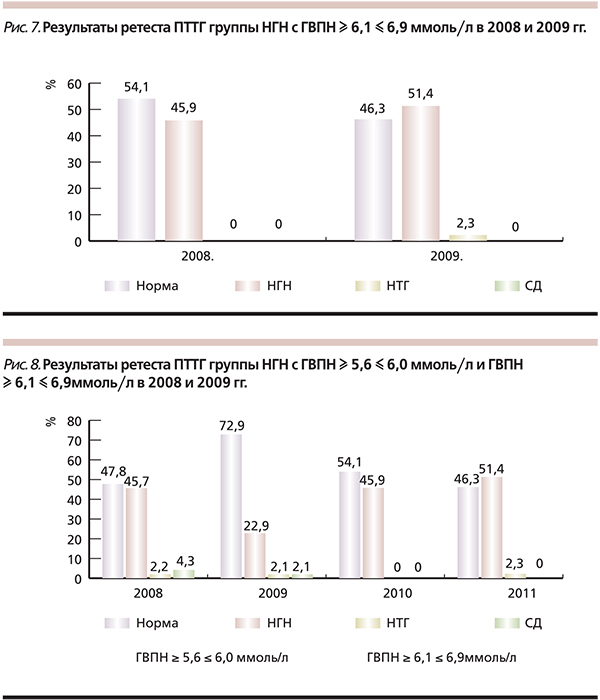
Таким образом, с целью диагностики состояния углеводного обмена 494 обследуемым был проведен ПТТГ с 75 г глюкозы. Результаты проведенного ПТТГ с 75 г представлены на рис. 2. Среди лиц, которым проводили ПТТГ, у 430 показатель ГВПН исходно был в пределах ≥ 5,6–≤ 6,0 ммоль/л. Формально они не нуждались в дальнейшем обследовании. Однако всем с МС или выявленными факторами риска развития СД2 (277 из 430) был проведен ПТТГ с 75 г глюкозы. Результаты теста для лиц с исходным уровнем ГВПН в пределах ≥ 5,6–≤ 6,0 ммоль/л представлены на рис. 3. Сравнение результатов ПТТГ в зависимости от исходного уровня ГВПН представлены на рис. 4.
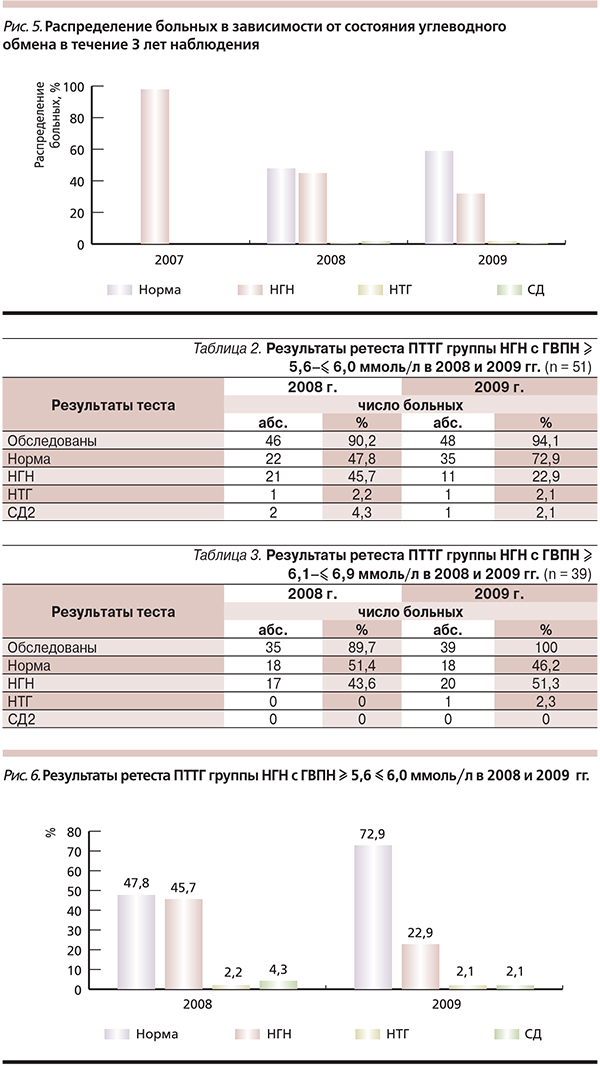
Полученные результаты диагностики нарушений углеводного обмена в группе лиц с МС или без такового, но с факторами риска развития СД2, имевших гликемию натощак ≥5,6–≤ 6,0 ммоль/л, доказали абсолютную необходимость проведения им диагностических мероприятий (ПТТГ с 75 г глюкозы). Прежде всего следует особо отметить, что среди них распространенность нарушений углеводного обмена оказалась даже выше, чем среди лиц с исходно НГН 37,5 против 31,8 % (р < 0,05). НГН оказалась идентичной (18,4 и 18,4 %), в то время как нарушенная толерантность к глюкозе (НТГ) преобладала в группе с исходно нормальной гликемией (19,1 против 4,1 %). Однако следует подчеркнуть, что в этой группе не было выявлено ни одного случая СД2, тогда как среди лиц с уровнем ГВПН ≥ 6,1–< 7,0 ммоль/л – 20 случаев.
Таким образом, среди 1136 обследованных лиц в соответствии с критериями ВОЗ (1999) нарушения углеводного обмена были выявлены у 18,5 % (210 из 1136), среди которых у 57 человек был диагностирован СД2, а у 153 – предиабет. У лиц с предиабетом преобладала НГН (91 против 62). Больным СД2 была назначена соответствующая сахароснижающая терапия.
Целью данного исследования явилось изучение влияния модификации образа жизни и метформина на самых ранних стадиях нарушения углеводного обмена, а именно – НГН, на процесс конверсии НГН в НТГ и в СД2.
С целью коррекции гликемии натощак и предотвращения развития СД2 лица с НГН мотивировались прежде всего на изменение образа жизни (соблюдение диеты и расширение режима физических нагрузок) [6, 7].
В качестве медикаментозного лечения в дополнение к модификации образа жизни всем лицам с НГН был назначен метформин и обязательная коррекция всех факторов риска развития сердечно-сосудистых заболеваний [8–11]. Так, пациентам с гиперхолестеринемией наряду с ограничением животных и термически обработанных жиров была назначена гиполипидемическая терапия. Лицам с артериальной гипертензией назначали или корректировали антигипертензивную терапию.
Противопоказание к назначению метформина в виде наличия хронической сердечной недостаточности IIАстепени имело место лишь в одном случае. Всем остальным (n = 90) лицам с НГН был назначен метформин в дозе 500 мг (перед сном).
В начале исследования наблюдаемых лиц с НГН вызывали на осмотр ежемесячно. При этом детально оценивали результаты самоконтроля гликемии и артериального давления, при необходимости корректировали диету, режим физических нагрузок, дозу метформина и антигипертензивную терапию. На каждом визите оценивали динамику массы тела и объема талии. С учетом отсутствия целевой гликемии натощак 10 % пациентов (9 из 90) доза метформина перед сном была увеличена до 1000 мг. Этой дозы препарата оказалось абсолютно достаточно для нормализации уровня гликемии натощак. При достижении целевых показателей гликемии натощак (≤ 5,5 ммоль/л) кратность визитов сокращали до 1 раза в 3 месяца.
В последующие 2008 и 2009 гг. проводился контроль ПТТГ с 75 г глюкозы. На обследование пациентов вызывали заблаговременно по телефону с напоминанием правил проведения теста.
Как видно из данных, приведенных в табл. 1, несмотря на проводимую терапию, у троих пациентов НГН трансформировалась в СД2, а у троих – в НТГ. В 46,9 (2008) и в 35,6 % (2009) прием метформина позволил удержать процесс нарушения углеводного обмена на стадии НГН. И наконец в 49,4 (2008) и в 60,9 % случаев (2009) проведенные мероприятия привели к нормализации углеводного обмена (рис. 5).
Пациентам с НТГ к лечению добавляли ингибиторы α-глюкозидаз (акарбозу) с постепенным титрованием суточной дозы до 150 мг/сут.
Важно отметить, что описываемая группа лиц с НГН изначально была разнородной, т. е. в этой группе оказались лица, которым по общепринятым критериям можно было бы и не проводить ПТТГ. Учитывая данное обстоятельство, мы проанализировали динамику углеводного обмена в зависимости от исходного состояния гликемии.
Динамика результатов контрольных тестов с углеводной нагрузкой представлена в табл. 2, 3.
Как видно из данных, приведенных в табл. 2, на фоне постоянного приема метформина и изменения образа жизни у троих пациентов НГН трансформировалась в СД2, у двоих – в НТГ. В 45,7 (2008) и 22,9 % (2009) прием метформина позволил удержать процесс нарушения углеводного обмена на стадии НГН. На фоне проведенных мероприятий нормализация углеводного обмена достигнута в 47,8 (2008) и 72,9 % случаев (2009) (рис. 6).
Лицам с НТГ к лечению была добавлена акарбоза с последующим титрованием дозы по схеме. Пациентам с СД была назначена сахароснижающая терапия.
Как видно из табл. 3, при проведении контрольных ПТТГ на фоне постоянного приема метформина НГН подтвердилась в 43,6 в 2008 г. и 51,3 % случаев в 2009 г. Нормализация углеводного обмена отмечена у 51,4 % человекв2008г.иу46,2%–в2009г. Трансформация НГН в НТГ зарегистрирована у 2,3 % обследованных в 2009 г. Конверсии НГН в СД за период наблюдения данной группы зарегистрировано не было (рис. 7).
При анализе динамики углеводного обмена в данных группах (рис. 8) обращает на себя внимание стойкое уменьшение числа лиц с НГН в группе с исходным уровнем ГВПН ≥ 5,6–≤ 6,0 ммоль/л, чего нельзя сказать о второй группе обследованных с исходно более высоким уровнем ГВПН (≥ 6,1 ≤ 6,9 ммоль/л). Отчетливая положительная динамика за период наблюдения отмечена также и в увеличении числа лиц с нормализацией углеводного обмена именно в группе с изначально меньшим диапазоном ГВПН ≥ 5,6–≤ 6,0 ммоль/л.
Однако следует отметить, что в группе НГН с исходной ГВПН ≥ 6,1–≤ 6,9 ммоль/л конверсии НГН в СД за период наблюдения отмечено не было. В группе же с исходно меньшей ГВПН ≥ 5,6–≤ 6,0 ммоль/л отмечены случаи трансформации НГН как в НТГ, так и в СД в каждом из годов наблюдения. Данный факт диктует необходимость своевременного выявления, лечения и наблюдения любых категорий нарушения углеводного обмена среди лиц не только с ГВПН ≥ 6,1–≤ 6,9 ммоль/л, но и с ГВПН ≥ 5,6–≤ 6,0 ммоль/л.
Выводы
1. Для своевременного выявления ранних нарушений углеводного обмена должен проводиться скрининг СД в соответствии со стандартами ВОЗ (1999) и Алгоритмами специализированной медицинской помощи больным сахарным диабетом (2011).
2. С целью уточнения состояния углеводного обмена необходимо проведение диагностических мероприятий (ПТТГ с 75 г глюкозы) всем лицам с МС или без такового, но с факторами риска развития СД2, у которых гликемия натощак превышает ≥ 5,6 ммоль/л.
3.Нормализация состояния углеводного обмена в 49,4 (2008) и 60,9 % случаев (2009) среди лиц с НГН, подтвержденной ПТТГ с 75 г глюкозы, доказывает необходимость модификации образа жизни, коррекции всех факторов риска развития сердечнососудистых заболеваний и приема метформина с целью профилактики развития СД2.
4. В отсутствие противопоказаний всем лицам с НГН необходимо назначение метформина в стартовой дозе 500 мг перед сном с последующим титрованием дозы до достижения гликемии ≤ 5,5 ммоль/л.
5. Всем лицам с выявленной НГН необходимо динамическое наблюдение с ежегодным проведением контрольных ПТТГ с 75 г глюкозы на фоне медикаментозной терапии.



