Введение
Остеоартроз (ОА) – заболевание суставов, характеризующееся клеточным стрессом и деградацией экстрацеллюлярного матрикса, возникающих при макро- и микроповреждениях, которые активируют ненормальные адаптивные процессы восстановления, включая провоспалительные реакции иммунной системы, костного ремоделирования и образования остеофитов [1]. Основными клиническими прояв-
лениями ОА являются боль различной степени выраженности, как правило механического стартового характера, умеренно выраженная непродолжительная скованность в суставах и нарушение функции. Терапия ОА носит комплексный характер и зависит от выраженности воспалительной реакции, степени функциональной недостаточности, структурных изменений и наличия сопутствующих заболеваний. В клинической практике наиболее часто для купирования симптомов ОА применяют нестероидные противовоспалительные средства (НПВС). Однако их применение может оказывать токсическое действие на органы желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы, почек
и печени. Российские, Европейские и Американские руководства рекомендуют использовать НПВС короткими курсами в минимальных эффективных дозах [2, 3]. В 2003 г. Европейская антиревматическая лига (EULAR – The European League Against Rheumatism) отдельно выделила группу лекарственных средств, определяемых как препараты замедленного действия для симптоматической терапии ОА (SYSADOA – symptomatic slow acting drugs for osteoarthritis). К настоящему времени накоплен большой научный и клинический опыт, позволивший сделать предварительные выводы и
о возможном наличии структурномодифицирующего эффекта, присущего этим препаратам.
ХС является типичным представителем группы лекарственных средств замедленного действия. Несмотря на то что ХС используется в медицине уже более 30 лет, до настоящего времени
не утихают споры о месте и роли этого препарата в терапии пациентов с ОА, что, впрочем, относится ко всей группе лекарственных средств замедленного действия. Отражением этих споров, в частности, являются рекомендации Американской коллегии ревматологов, где авторы условно не рекомендуют использовать ХС и глюкозамин в качестве терапии пациентов с ОА [4]. Тем не менее в большинстве национальных рекомендаций, включая и таких авторитетных организаций, как Международное общество по изучению ОА (OARSI – Оsteoarthritis Research Society International) и EULAR, ХС
включен в качестве терапевтического средства для лечения пациентов с ОА.
Фармакокинетика и биологическая активность ХС в значительной степени определяются массой молекулы и степенью сульфатирования [10]. В качестве исходного сырья для получения ХС используется хрящевая ткань крупного рогатого скота, свиней, цыплят или рыб [11–14]. Разные источники получения ХС определяют особенности молекулярной структуры ХС, что в свою очередь помимо степени очистки оказывает влияние на эффективность применения того или иного препарата.
Большая часть ХС выпускается в виде форм для перорального применения. При попадании в ЖКТ происходит разрушение большинства молекул ХС, и в системный кровоток, как правило, попадают низкомолекулярные дериваты, обладающие небольшой терапевтической активностью. По некоторым данным, доля нативных молекул в системном кровотоке при пероральном приеме составляет всего 10 %. Максимальная концентрация препарата в крови достигается через 3–4 часа после приема, а в
синовиальной жидкости – через 4–5 часов. В целом же биодоступность ХС при пероральном приеме составляет в среднем от 10 до 20 % [15–17].
При внутримышечном введении ХС выявляется в значительных концентрациях в системном кровотоке уже через 30 минут, а максимальная концентрация достигается через час. В синовиальной жидкости препарат выявляется через 15 минут после внутримышечной инъекции, а максимальная концентрация в хрящевой ткани достигается через 48 часов [18]. Внутримышечный способ введения ХС увеличивает биодоступность и долю нативных молекул в системном кровотоке, благодаря чему может повышаться как эффективность проводимой терапии, так и более быстрое развитие симптоматического эффекта.
Целью исследования явилась оценка эффективности, переносимости и безопасности ХС (Хондрогарда) для пациентов с ОА коленных суставов при внутримышечном применении.
Материал и методы
В 2-месячное проспективное когортное исследование были включены 70 человек с диагнозом ОА коленных суставов, среди них были 67 (96 %) женщин и 3 (4 %) мужчины. Диагноз остеоартроза устанавливался на основании классификационных критериев Американской коллегии ревматологов
(АКР) 1986 г. [5].
Критерии включения:
• возраст 45–70 лет;
• установленный диагноз первичного тибиофеморального ОА, согласно критериям АКР;
• боль при ходьбе не менее 40 мм по визуально-аналоговой шкале (ВАШ);
• II или III рентгенологическая стадия по Kellgren–Lawrence;
• потребность в приеме НПВС в стабильной дозе длительностью не менее 30 дней за предшествующие
3 месяца;
• подписанное информированное согласие.
В исследование не включали лиц с вторичным гонартрозом, внутрисуставным введением любых препаратов за последние 6 недель до начала исследования, наличием хондрокальциноза, асептического некроза мыщелков бедренных и большеберцовых костей, оперативных вмешательств на коленном суставе, а также с известной повышенной чувствительностью к ХС, тяжелыми сопутствующими заболеваниями, язвой желудка или двенадцатиперстной кишки в течение последнего
месяца, кровотечениями в анамнезе, тромбофлебитами, беременностью ипериодом лактации, принимавшими препараты с симптоматическими и структурно-модифицирующими свойствами. Разрешалось использование НПВС, которые пациенты принимали на момент включения в исследование. Не допускались внутрисуставные инъекции, в т. ч. глюкокортикоидов и препаратов гиалуроновой кислоты, прием антикоагулянтов, антиагрегантов, фибринолитиков, проведение физиотерапевтических процедур.
В исследование вошли лица в возрасте от 45 до 70 лет, средний возраст составил 61,0 ± 6,4 года, рост – 1,63 ± 0,06 м, масса тела – 81,6 ± 12,9 кг, индекс массы тела (ИМТ) – 31 ± 4,6 кг/м2, медиана длительности заболевания – 9 лет (25-й, 75-й процентили – 5 и 12 лет), медиана длительности
последнего обострения – 2 месяца (25-й, 75-й процентили – 1,4 и 4,0 месяца). Наиболее выраженная симптоматика на момент включения в исследование, как правило, отмечалась в правом коленном суставе (64 %) по сравнению с левым (36 %). При этом большинство (79 %) лиц имели ОА II
рентгенологической стадии и 21 % – ОА III стадии.
Характеристика участников исследования представлена в табл. 1.
Таблица 1. Характеристика участников исследования.
В качестве показателей эффективности использовали динамику индекса WOMAC (Western Ontario and
McMaster University) в целом, а также отдельных параметров: значение боли, скованность и функциональная недостаточность (ФН). Оценивали динамику изменений скорости ходьбы на
15 метров, потребность в НПВС на протяжении исследования и общую оценку эффекта пациентом в конце исследования. Также оценивали частоту и характер нежелательных явлений (НЯ), их связь с исследуемым препаратом.
Всем пациентам через день внутримышечно вводили ХС на протяжении 2 месяцев (№ 30). Первые три инъекции выполнялись в дозе 1 мл (100 мг), последующие – в дозе 2 мл (200 мг). В случае необходимости пациенты продолжали терапию НПВС, при этом применения другого НПВС на протяжении исследования не допускалось. Статистическая обработка данных
проведена с помощью программы SPSS 16.0. Результаты представлены в виде среднего значения и стандартного отклонения или медианы и 25-й и 75-й процентилей. Нормальность распределения оценивали с помощью теста Колмогорова–Смирнова. Оценка изменений проведена с помощью однофакторного дисперсионного анализа с повторными измерениями и парного t-теста.
Результаты исследования
Всего в исследовании приняли участие 70 человек, среди них 67 (96 %) женщин и 3 (4 %) мужчины.
Полностью завершили исследование 66 (94 %) человек, 4 (6 %) пациента выбыли: трое – в результате появления НЯ и один – из-за отсутствия эффекта от проводимой терапии.
Терапия ХС в виде внутримышечных инъекций была эффективной для большинства больных. Были выявлены статистически значимые улучшения как отдельных показателей: боль, скованность, ФН, так и WOMAC в целом. Результаты представлены на рис. 1. Показатели WOMAC значимо уменьшились уже через две недели, в среднем на 167 (14 %) мм (95 % доверительный интервал [ДИ] – 112–219; р < 0,001), а через 2 месяца – на 465 (39 %) мм (95 % ДИ – 387– 569; р < 0,001).
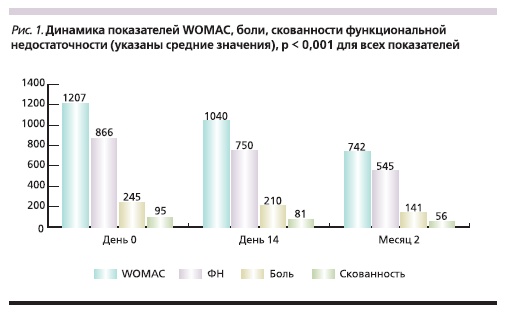
На фоне лечения препаратом Хондрогард отмечено статистически значимое уменьшение боли по шкале WOMAC через две недели на 14 %, или в абсолютных значениях – на 35 мм (95 % ДИ – 21–49; р < 0,001). При продолжении терапии ко второму месяцу положительная динамика достигла 43 %,
что соответствовало снижению боли в среднем на 104 мм (95 % ДИ – 85–124; р < 0,001).
Скованность в оцениваемом коленном суставе через 2 недели статистически значимо уменьшилась на 14 мм (95 % ДИ – 8–22; р < 0,001), 15 %, через два месяца – на 39 мм (95 % ДИ –31–51; р < 0,001), 41 %. Отмечено статистически значимое улучшение функциональных показателей через 2 недели на 13 % и снижение ФН на 116 мм (95 % ДИ –78–154; р < 0,001), ко второму месяцу терапии улучшение достигло 37 %, а показатели ФН снизились на 321 мм (95 % ДИ – 265–393; р < 0,001; табл. 2).
Таблица 2. Динамика показателей WOMAC, боли, скованности ФН в процессе лечения.
Через две недели терапии достигнуто незначительное увеличение скорости прохождения дистанции 15 метров, время прохождения дистанции снизилось на 0,75 секунды (95 % ДИ – 0,12–1,38, р = 0,021), 5 %; через 2 месяца –на 1,88 секунды (95 % ДИ – 1,25–2,51, р < 0,001), 13 %.
Из 63 пациентов, отметивших положительный эффект от проводимой терапии, полностью прекратили прием НПВС 28 (44 %) человек, или 40 % от общего числа участников исследования. Уменьшили дозу в 2 раза или стали принимать НПВС не чаще 1 раза в 3 дня 21 (33 %) участник, или 30 % от общего их числа. Отметили улучшение состояния, но продолжали принимать прежнюю дозу НПВС 14 (22 %), или 20 % от общего числа участников. Два человека прекратили прием НПВС, но отметили усиление
симптоматики и в дальнейшем выбыли из исследования.
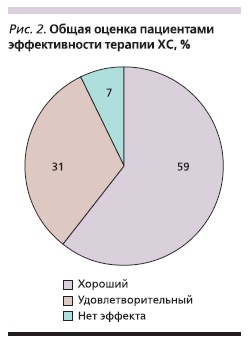
В среднем на 23 ± 10-й день пациенты отмечали эффект от лечения. Из 70 участников исследования эффективность препарата оценили 68 человек (двое выбыли и не принимали участие в общей оценке). Из оставшихся 68 пациентов полностью закончили исследование 66 и 2 выбыли, но также
принимали участие в оценке эффективности. Хороший эффект препарата отметил 41 (59 %) пациент, удовлетворительный – 22 (31 %) и 5 (7 %) человек не заметили какого-либо эффекта (рис. 2).
В ходе исследования были выявлены следующие НЯ: небольшие гематомы в месте введения препарата – 8 (11%) пациентов; кожный зуд, папулезную сыпь – 4 (6 %); болезненные уплотнения в месте инъекции – 2 (3 %); чувство жара после инъекции – 1 (1 %); тошноту, диарею – 1 (1%). Серьезные
НЯ отсутствовали.
Из-за НЯ выбыли 3 (4 %) человека и 1 – из-за неэффективности лечения. При этом у двоих отмечены папулезная сыпь и кожный зуд, что было расценено исследователями как реакция, связанная с препаратом; у одного пациента – тошнота и диарея, которые купировались после прекращения введения препарата. Эта реакция также была расценена исследователями как связанная с применением препарата.
Обсуждение
ХС относится к группе препаратов замеленного действия для симптоматической терапии ОА, препарат
обладает большим спектром биологической активности, оказывая влияние почти на все ключевые моменты патогенеза ОА. Литература располагает массой работ, в которых оценивался симптоматический эффект ХС. В некоторых мета-анализах был выявлен значимый эффект ХС на боль, скованность и ФН. Так, у 372 больных ОА Leeb и соавт. [6] отметили положительный эффект ХС на боль 0,9 (95 % ДИ – 0,8–1,0) и функцию суставов 0,74 (95 % ДИ – 0,65–0,85). По данным мета-анализа 15 рандомизированных контролируемых исследований (РКИ) McAlindon и соавт. [7] обнаружили достаточно выраженный эффект ХС. Размер общего терапевтического эффекта составил 0,78 (95 %
ДИ – 0,6–0,95). Согласно общепринятому подходу, эффект менее 0,2 рассматривается как незначительный, 0,5 – как средний и более 0,8 – как выраженный. Однако при учете
только крупномасштабных исследований или исследований, характеризующихся высоким качеством, показатели размера эффекта снижались. Проведя мета-анализ 20 РКИ влияния ХС на боль у 3846 больных ОА коленных и тазобедренных суставов, Reichenbach и соавт. [8] тоже выявили довольно высокие показатели эффективности проведенной терапии – - 0,75 (-0,99 до -0,5).
В представленной работе, которая имела дизайн открытого проспективного исследования, авторы выявили статистически значимое улучшение показателей боли, скованности, ФН и общего WOMAC по сравнению с исходными данными уже через две недели, хотя изменения и не достигли уровня клинической значимости (улучшение показателя более чем на 20 %). Однако уже ко второму месяцу терапии все значения индекса WOMAC (боль, скованность, ФН) снизились на 43 %, 41 и 37 % соответственно. Эффект от проводимой терапии отмечен 90 % пациентов, в 3 % случаев присутствовал положительный эффект, однако после отмены НПВС этот эффект исчезал. В РКИ, проведенном в США (n = 1583) [9], авторы в целом не обнаружили клинически значимого влияния
ХС и глюкозамина на показатели боли (эффект считался клинически значимым при снижении уровня боли на 20 %) по сравнению с плацебо. Однако комбинированное применение ХС и глюкозамина лицами с умеренными и выраженными болями оказалось более эффективным по сравнению с плацебо (79,2 против 54,3 % соответственно; р = 0,002).
Недостаточная эффективность применения ХС может быть обусловлена различными причинами: особенностью самого препарата, его химической структурой, степенью очистки, способом введения препарата, а также активностью заболевания и степенью деструктивных изменений в суставе.
Следует отметить, что ХС обладает высоким профилем безопасности. Ни в одном из проведенных клинических исследований не было выявлено каких-либо значимых побочных эффектов, в т. ч. и при длительном применении. EULAR рассматривает ХС в качестве одного из самых безопасных лекарственных препаратов терапии ОА. При использовании внутримышечных форм отмечено увеличение числа локальных побочных эффектов по сравнению с пероральными. В нашем исследовании в 8 (11 %) случаях были выявлены небольшие гематомы в месте введения препарата, что указано в инструкции по применению Хондрогарда; кожный зуд; папулезная сыпь – в 4 (6 %);
болезненные уплотнения в месте инъекции – в 2 (3 %); чувство жара после инъекции – в 1 (1 %);
тошнота, диарея – в 1 (1 %) случае. Серьезные НЯ отсутствовали.
Таким образом, препарат Хондрогард, представляющий собой раствор ХС натрия для внутримышечного применения, обладает достоверным симптоматическим эффектом, уменьшая
боль, скованность и улучшая функциональные показатели. Преимущество препарата состоит в быстром наступлении эффекта при внутримышечном применении, возможности отмены или снижения дозы НПВС на фоне лечения и хорошей переносимости. Препарат Хондрогард может быть рекомендован в качестве терапии лицам, страдающим ОА, как первое средство, дающее более быстрый эффект с последующей заменой его на пероральные формы.



