Остеоартроз (ОА) – гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц [1, 2]. В англоязычной литературе используется другое название заболевания – остеоартрит, ввиду частого выявления в суставе воспа-ления.
Искусство врача при лечении больного состоит в создании условий, когда усиливаются целебные свойства медикамента и нивелируются его побочные эффекты. Так как пусковым механизмом, эпицентром и конечным инвалидизирующим субстратом является сустав, локальная терапия (ЛТ) становится патогенетически обоснованной, клинически значимой и психологически привлекательной, потому что притягивает внимание больного к конкретному местному лечению, укрепляя сотрудничество врача и пациента в борьбе с недугом.
Положительные особенности ЛТ:
Непосредственное воздействие на основной очаг поражения – орган-мишень, каким при ОА служит сустав.
 Достижение оптимальной лечебной концентрации лекарственного препарата в пораженном органе, что уменьшает потребность в системно назначаемых фармакологических средствах. При этом снижается токсическое действие медикаментозных препаратов на организм.
Достижение оптимальной лечебной концентрации лекарственного препарата в пораженном органе, что уменьшает потребность в системно назначаемых фармакологических средствах. При этом снижается токсическое действие медикаментозных препаратов на организм.
ЛТ – важное звено реабилитации ОА, т.к. проводится лечение именно тех суставов, нарушение функции которых служит причиной потери трудоспособности.
Вовлеченные в патологический процесс различные суставы обладают только для них предназначенной функциональной нагрузкой и в зависимости от этого по-разному определяют прогноз болезни. Воздействуя на конкретные суставы, ЛТ способна значительно улучшать качество жизни.
ЛТ не исключает, а часто проводится в сочетании с системным лечением.
По данным автора, в поликлинике ЦКБ число больных ОА составило 522 человека. Соотношение мужчин и женщин при данном заболевании равнялось 1:2,6. Средний возраст составил 68,8 года. Поскольку пожилой возраст в 1,3 раза превышал средний возраст прикрепленного контингента к поликлинике (53,1 года), были проанализированы сопутствующие заболевания у 175 больных гонартрозом. Выяснилось, что частота сопутствующей патологии внутренних органов отмечалась при ОА в 1,7 раз чаще по сравнению с контингентом поликлиники. Артериальная гипертензия (АГ), ишемическая болезнь сердца (ИБС), ожирение, жировая дистрофия печени, катаракта встречались чаще более чем в 2 раза. Язвенная болезнь желудка отмечена в 1,3 раза чаще [3].
Таким образом, многообразие форм и высокая частота сопутствующей соматической патологии при ОА диктуют необходимость их учета при выработке тактики лечения суставов. Ассоциация дегенеративных поражений суставов с пожилым возрастом и полиморбидность патологии предполагают разработку принципов индивидуального подхода к лечению артрологических больных с коррекцией общей терапии. Преимущественно женский пол, пожилой возраст, частая патология желудка затрудняют общее лечение, особенно применение нестероидных противовоспалительных средств (НПВС) у больных ОА [4, 5].
С учетом этих факторов ЛТ приобретает большое значение для купирования обострений артрита, тем самым предопределяя тактику комплексной терапии.
Различают несколько видов ЛТ:
- аппликационная терапия;
- локальная инъекционная терапия;
- местное лечение физическими факторами;
- сочетание различных методов ЛТ.
Аппликационная терапия
Аппликационное применение лекарственных препаратов является одним из наиболее широко встречающихся методов ЛТ и обусловлено простотой и безболезненностью. По данным поликлинического приема, пациент, пришедший впервые на прием к ревматологу, в 50–70% случаев уже использовал мази и гели в лечении своего недуга. Врач обязан расспросить и оценить проводимую терапию перед назначением новых препаратов с учетом эффективности, переносимости и доступности медикамента в аптечной сети.
Все аппликационные средства можно разделить на 3 класса:
1. Средства раздражающего, отвлекающего, охлаждающего и/или согревающего действий. Широкое распространение нашли мази на основе пчелиного, змеиного ядов, а также растительные и синтетические согревающие средства. Данные препараты используются при ОА обычно разово для снятия болевого синдрома при невыраженном синовите.
2. Средства, содержащие НПВС. Местные НПВС показаны в острую стадию артроза для купирования синовита. Они проникают в полость суставов при адекватной длительности и кратности их нанесения.
С помощью мета-анализа 86 испытаний (10 160 больных) R.A. Moore и соавт. в 1998 г. оценили эффективность и безопасность НПВС для наружного применения (НПВС-НП) при острой и хронической боли с полученным выводом, что НПВС-НП эффективны и безопасны при болях в опорно-двигательном аппарате [6]. Применение локальных форм НПВС (мази, гели, растворы для нанесения на кожу, спреи) возможно рассматривать как важный и самостоятельный элемент анальгетической терапии [7, 8].
Мази желательно применять, когда пораженный сустав располагается на небольшой глубине и можно надеяться, что трансдермальная диффузия обеспечит лишь в этой области достаточную для получения лечебного эффекта концентрацию действующей субстанции [9]. НПВС-НП показали статистически значимое преимущество по сравнению с плацебо [10]. При этом системный эффект при накожном нанесении незначителен, что определяется очень небольшим количеством препарата, попадающим в системный кровоток [11]. НПВС-НП в отличие от системного применения этих препаратов практически не вызывают класс-специфических осложнений со стороны желудочно-кишечного тракта, сердечно-сосудистой системы и почек и могут назначаться пациентам с коморбидной патологией [12].
Поскольку больные ОА часто ожидают получить сиюминутный эффект, врач должен настроить пациентов на длительную терапию в течение 10–14 дней с кратностью применения мазевого средства 4–6 раз в сутки и с достаточным количеством препарата. На крупный сустав наносится полоса от 5 до 10 см, на средний – от 3 до 5, на мелкий – от 1 до 2 см [13, 14]. Использование НПВС-НП возможно при болевом синдроме как при выраженном синовите, так и в его отсутствие.
3. Средства, улучшающие трофику суставных тканей. К ним относятся бишофит, нафталан, медицинская желчь и др. Препараты используются преимущественно в период ремиссии ОА.
Для локальных средств В.А. Насонова (1998) разработала следующие требования:
Местно применяемый препарат должен быть эффективным при лечении.
Не должен вызывать местных токсических и аллергических реакций.
Должен достигать органа-мишени.
Концентрация препарата в сыворотке не должна приближаться к уровню, приводящему к зависимым от дозы побочным эффектам.
Метаболизм и выведение препарата должны быть такими же, как при системном применении.
Недостатком аппликационной ЛТ является невысокое количество лекарственного вещества, проникающего в ткани. Затруднением к поступлению лекарства в глубину тканей являются барьерные функции кожных покровов, в т.ч. перепад градиентов рН. Степень проникновения препарата зависит от его липофильности, правильного увлажнения рогового слоя эпидермиса.
Локальная инъекционная терапия
Четкий положительный эффект отметил J.L. Hollander в 1951 г. в Филадельфии, вводя ацетат гидрокортизона в суставы больным с синовитами, что вызвало подавление синовита в 90% случаев. Ярковыраженный эффект позволил называть глюкокортикоиды (ГК) то «улучшенным аспирином», то «эликсиром жизни». За полвека применения ГК зарекомендовали себя как самые эффективные среди противовоспалительных средств [15]. Внедрение в клиническую практику локальной стероидной терапии (ЛСТ) для лечения как суставов, так и мягких околосуставных тканей при ревматических заболеваниях, в частности ОА, стало одним из крупнейших достижений медицины середины XX в. [16].
ЛСТ проводится по четким показаниям, таким как:
- Выраженные экссудативные явления в одном или нескольких суставах.
- Неэффективность консервативного лечения.
- Наличие противопоказаний к общей гормонотерапии.
- Необходимость снижения дозы или отмены перорально применяемых стероидов.
- Непереносимость лекарственных препаратов.
- Воспалительные явления в параартикулярных тканях.
- Облегчение программ реабилитации.
Абсолютные противопоказания к ЛСТ :
- Наличие инфекции как в суставе, так и в организме.
- Выраженная деструкция сустава.
- Геморрагический синдром.
- Артрит неясной этиологии.
- Анатомическая недоступность сус-тава.
- Тяжелое общее состояние.
 К относительным противопоказаниям относятся отсутствие воспалительного процесса в суставе, остеопороз, склероз капсулы сустава, лечение сочленений, лишенных синовиальной оболочки (лонное, реберно-грудинные и др.), резистентность больного к стероидам, отсутствие эффекта от предыдущих двух инъекций [17].
К относительным противопоказаниям относятся отсутствие воспалительного процесса в суставе, остеопороз, склероз капсулы сустава, лечение сочленений, лишенных синовиальной оболочки (лонное, реберно-грудинные и др.), резистентность больного к стероидам, отсутствие эффекта от предыдущих двух инъекций [17].
Существует «золотое» правило ЛСТ при ОА: если в течение года потребность введения в сустав ГК превышает 2–4 раза, необходимо пересмотреть общее лечение данного больного.
«Несмотря на возможность побочных эффектов, полувековое лечение больных артритами и ОА с помощью внутрисуставного введения ГК показало высокую эффективность этого локального метода лечения при достаточно хорошей переносимости» [18]. Несмотря на непревзойденные противовоспалительные и анальгетические свойства, ЛСТ остается терапией отчаяния и весьма рискованным мероприятием. Полярные представления о хондропротективных и хондродегенеративных свойствах ГК имеют практически равное количество подтверждений [19].
Автор оценил десятилетние результаты ЛСТ у 39 больных ОА (4 мужчин и 35 женщин среднего возраста 68,2 года), которым на протяжении 10 лет проводилась ЛСТ. Данным больным при обострении ОА в коленный сустав вводили 1 мл ГК кратностью от 1 до 4 раз в год. Результаты лечения сравнивали с контрольной группой из 15 больных гонартрозом, сопоставимых по полу, возрасту и стадии болезни с основной группой, которым ЛСТ никогда не проводились. Клиническая эффективность ЛСТ при ОА равнялась 85–90,2%. Ухудшения общего самочувствия, достоверно более быстрого прогрессирования сопутствующих заболеваний, сокращения сроков жизни у больных, леченных ЛСТ, по сравнению с пациентами, не получавшими ЛСТ, не отмечено. По рентгенологическим данным не получено достоверно более выраженной дегенерации костно-хрящевой ткани у больных, леченных ЛСТ. Инфекционных осложнений при ЛСТ не было. У пациентов с ОА при учете показаний (стадии, фазы болезни, оценки сопутствующих заболеваний), соблюдении числа и кратности процедур, правильного выбора доз вводимых препаратов ЛСТ эффективна, хорошо переносится и не оказывает достоверного отрицательного влияния на костно-хрящевые структуры сустава. ЛСТ можно использовать как ключевой метод в купировании обострений ОА, формируя мост для дальнейшего лечения базисными структурно-модулирующими хрящ препаратами [3].
Надежды возлагаются на интраартикулярное введение гиалуронатов – препаратов, модулирующих структуру хряща и вязкоэластические свойства синовиальной жидкости. Эти препараты по своему биологическому сродству с суставным хрящом и синовиальной жидкостью проникают в структуры сустава, обладают антигиалуронидазной активностью, подавляют протеолитические ферменты, стимулируют обмен хрящевой ткани, задерживают развитие дегенеративного процесса [20]. В 2003 г. гиалуронаты были рекомендованы EULAR (European League Against Rheumatism) для лечения ОА в виде медленнодействующей симптом-модифицирующей терапии – SYSDOA (Symptomatic Slow Acting Drugs for Osteoarthritis) [21].
Способы интра- и периартикулярного введения лекарственного препарата могут быть различными:
Традиционные игольно-шприцевые инъекции.
Безыгольные инъекции.
Игольно-струйные инъекции.
Игольно-шприцевые инъекции. Интра-артикулярная игольно-шприцевая ЛТ при ОА технически достаточно сложна, т.к. фиброзносклеротические изменения капсулы сустава, деформация суставных поверхностей, невысокий объем синовиального выпота при ОА затрудняют пункцию сустава шприцом, усиливая травмирующее действие иглы на структуры сустава. Это послужило стимулом для разработок новых методов – струйного и игольно-струйного введения лекарственных препаратов.
Струйные (безыгольные) инъекции. В.Н. Никифоров и соавт. в 1974 г. при радикулитах вводили с хорошим эффектом подкожно безыгольным инъектором новокаин. В 1956 г. в Нью-Йорке M. Ziff и соавт. применили струйный инъектор «Hyposprey» для внутрисуставных инъекций гидрокортизона при ОА, отметив улучшение у 76,5–94,3% больных [22].
Игольно-струйные инъекции.
М.В. Провоторов и И.А. Ханин в Воронеже в 1982 г. предложили игольно-струйный инъектор «ИСИ-1» для трансторакального интрапульмонального введения жидких лекарственных средств при пневмониях, абсцессах легких, бронхиальной астме. Было констатировано проникновение медикамента до 6 см в легочную ткань [23].
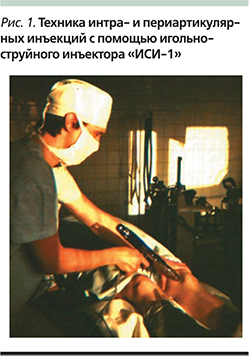
Эффективное применение инъектора «ИСИ-1» у пациентов с патологией легких [24] позволило автору ожидать положительные результаты у артрологических больных. Игольно-струйные инъекции в сустав проводились из доступов, стандартных для игольно-шприцевых пункций. После нажатия на спусковой крючок инъектора происходил быстрый (за 0,08–0,12 секунды) прокол мягких тканей иглой на 3–5 мм с последующим автоматическим струйным выбросом лекарства под давлением 200 кг/кв. см (рис. 1).
Исследования секционного материала показали проникновение в полость коленного сустава большей части жидкого лекарственного средства. Оставшаяся часть препарата располагалась параартикулярно.
В условиях поликлиники ЦКБ проведено лечение с использованием инъектора «ИСИ-1» 41 больного ОА коленных суставов в фазе обострения без выраженного экссудативного компонента. За одну игольно-струйную инъекцию в полость сустава вводили 20 мг триамцинолона с 0,5 мл 2%-ного раствора новокаина.
На фоне терапии игольно-струйными инъекциями у больных уменьшились боли, отек коленного сустава, увеличился объем движений в нем. Улучшение отметили 90,2% больных. Осложнений не отмечено [25]. Метод игольно-струйных инъекций малоболезнен, прост и эстетически привлекателен в лечении ОА, был запатентован в1995 г. [26]
Ирригация полости сустава. Пока-занием к ирригации сустава является недостаточная эффективность шприцевой элиминации жидкости из сустава, что возможно при накоплении большого количества экссудата с обильными хлопьями фибрина. Поскольку подобные сгустки не могут быть удалены шприцем, результат достигается с помощью промывания полости сустава с помощью системы капельницы. Способ использовался при хронических синовитах в НИИ ревматологии А.Г. Беленьким в 1990-х гг.
При обострении ОА, характеризую-щемся малым выпотом, метод не нашел применения [27].
Пункции суставов под ультразвуковым контролем. Внедрение в артрологическую практику ультразвукового исследования (УЗИ) суставов позволило улучшить пункционную технику. Артросонография уточняет наличие, объем, локализацию экссудата, наличие в нем фибрина, что облегчает работу артролога. Нередко осуществляются пункции суставов под непосредственным контролем УЗИ [28].
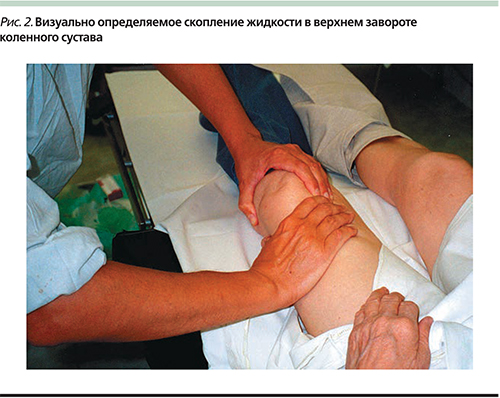
При наличии в клинике ультразвукового линейного датчика с частотой 7,5 Мгц возможен адекватный контроль эффективности пункции, что проиллюстрировано следующим примером. На рис. 2 представлен запатентованный автором бимануальный способ определения жидкости в полости сустава [29]. При УЗИ верхнего заворота сустава определяется скопление жидкости в виде гомогенной анэхогенной полосы и утолщенная синовиальная оболочка, что видно на эхограмме на рис. 3. Визуальный и сонографический контроль позволяют оптимально проводить пункцию сустава в месте максимального скопления жидкости.
Местное лечение физическими факторами
При ОА активно используются физические методы лечения, которые уменьшают болевой синдром, мышечный спазм, воспалительные процессы, улучшают микроциркуляцию и трофику. Лекарственный электрофорез (ЛЭ) положительно зарекомендовал себя как метод, сочетающий терапевтическое воздействие как самого физического фактора – постоянного электрического тока, так и медикаментозного средства, вводимого с его помощью. Постоянный электрический ток оказывает противовоспалительный, вазодилатирующий, дренирующе-дегидратирующий, анальгетический, миорелаксирующий, седативный (на аноде), метаболический эффекты [30].
При ЛЭ основными путями пенетрации лекарств в ткани являются выводные протоки потовых и сальных желез, волосяные фолликулы и в меньшей степени межклеточные пространства. Лекарственные вещества в основном накапливаются в эпидермисе и дерме, образуя кожное депо ионов, где могут находиться от 3 часов до 15–20 суток. Лекарство постепенно диффундирует в лимфатические и кровеносные сосуды, проникая в воспаленные очаги. Количество попадаемого в ткани лекарственного вещества невелико и колеблется от 2 до 10% от применяемого (нанесенного на прокладку), при этом лекарства проникают на небольшую глубину [31].
ЛЭ с инъекционным депонированием препаратов
С учетом достоинств и недостатков различных методов ЛТ для лечения ОА автор предложил их сочетание, применив ЛЭ с предварительным инъекционным депонированием препаратов в мягкие околосуставные ткани.
Инъекционное перифокальное депонирование лекарственных препаратов осуществлялось в мягкие ткани медиальной поверхности коленного сустава, т.н. гусиную лапку. Часто встречаемая патология этой области – анзериновая энтезопатия – протекает как самостоятельное заболевание, а также на фоне гонартроза, клинически же эффективная ЛСТ при анзериновой энтезопатии способствовала выбору данной области сустава для создания депо препаратов.
Техника выполнения ЛЭ с депонированием препаратов состоит в следующем. В первый день пациенту параартикулярно в мягкие ткани внутренней поверхности коленного сустава, ниже уровня суставной щели шприцом вводится от 5 до 10 мл 0,5%-ного раствора новокаина с 50 мг суспензии гидрокортизона – создается перифокальное депо препаратов (рис. 4). Далее с первого дня на протяжении 10 дней ежедневно выполняется электрофорез новокаина данной области [3].
Аналогичная терапия выполнена автором 22 пациентам с гонартрозом. После терапии у большинства больных отмечалось улучшение в виде уменьшения боли, окружности сустава, увеличения амплитуды сгибания в нем. Значительное улучшение отмечено у 18 (81,8%) человек [3].
Лечение апизартроном
Полиморбидный нелеченый болевой синдром при ОА, особенно при сопутствующих ОА жизнеугрожающих заболеваниях, таких как АГ, атеросклероз и др., приводит к уменьшению продолжительности жизни больного – «снижает не только качество, но и количество жизни больного» [32]. Терапия клинических проявлений ОА у больных ожирением и другими метаболическими заболеваниями (АГ, ИБС и т.д. или их высоким риском) должна быть тщательно продумана врачом. Оценка сопутствующих заболеваний при ОА диктует четкое осмысленное назначение лекарственных препаратов [33].
В связи с этим весьма перспективными в силу своей безопасности представляются местные методы лечения болевого синдрома.
Препараты местного действия обладают следующими характеристиками:
- оказывают действие только на локальную активность структур в периферических тканях, например периферических ноцицепторов в коже;
- их концентрация в крови не достигает уровня, измеряемого лабораторными тестами;
- не имеют системных побочных эффектов;
- не вступают в реакции лекарственного взаимодействия [34].
Решающим направлением в местном лечении болевых синдромов является десенситизация рецепторов, играющих ключевую роль в развитии периферической сенситизации ноцицепторов (т.е. снижения уровня деполяризации мембран аксонов, необходимого для генерации потенциала действия) [35]. С этой целью применяются мази раздражающего, отвлекающего и согревающего действий, механизм действия которых заключается в стимуляции немиелинизированных С-волокон, вызывающей высвобождение субстанции Р и, возможно, других нейротрансмиттеров из терминалей. Последовательное истощение запасов субстанции Р приводит к уменьшению ноцицептивной афферентации в центральную нервную систему и десенситизации рецепторов. Местное применение данных средств оказалось эффективным в лечении болей при таких патологиях, как диабетическая полиневропатия, постгерпетическая невралгия, болевые дистальные полиневропатии, при послеоперационных невропатических болевых синдромах [36].
В генезе болей при ОА большое значение придается параартикулярному миофасциальному синдрому, который проявляется как спазмом, так и наличием в напряженных мышцах болезненных уплотнений (участков гипертонуса) и триггерных точек. Спазм мышц вызывает боль, объясняющуюся накоплением метаболитов, выделенных сокращенной мышцей. В нормальных условиях эти метаболиты вымываются кровью. При спазме кровоток нарушается и накопленные метаболиты активируют болевые рецепторы. Боль, вызванная локальным спазмом мышц, сама по себе может быть стимулом, провоцирующим спазм. Таким образом, возникает порочный круг, в котором изначальная мышечно-скелетная патология активирует местные болевые рецепторы, боль вызывает рефлекторный спазм, в свою очередь усиливающий боль, которая служит стимулом для пролонгирования или усиления спазма [36].
Для снятия мышечного спазма хорошо подходит Апизартрон – комбинированный препарат на основе пчелиного яда для наружного применения. Апизартрон представляет собой мазь для безрецептурного отпуска, содержащую 3 мг пчелиного яда, 10 г метилсалицилата, 1 г аллилизотиоцианата (горчичного масла).
Препарат эффективен при невыраженном синовите. Апизартрон оказывает местное раздражающее действие благодаря стимуляции нервных окончаний, осуществляет сосудорасширяющее действие, что приводит к улучшению снабжения тканей кислородом; ускоряет распад вызывающих боль продуктов обмена веществ. Метилсалицилат и аллилизотиоцианат вызывают гиперемию кожи с улучшением кровотока в ней, оказывают анальгезирующий и разогревающий эффекты. Апизартрон способствует активизации обмена веществ, повышению эластичности соединительной ткани и мышц, понижению болезненного гипертонуса прилегающих мышц [37].
Апизартрон показан при заболеваниях опорно-двигательного аппарата (ОА, поражениях мягких тканей), дегенеративно-дистрофических поражениях и болях в суставах. Апизартрон применяется также при заболеваниях периферической нервной системы, сопровождающихся ощущением боли: невралгиях, невритах, радикулитах, болях в поясничной области, болях в мышцах и поражениях мягких тканей, в т.ч. вызванных травмой. Апизартрон используется для разогрева мышц до, во время и после физических нагрузок и занятий спортом; при повреждениях мягких параартикулярных тканей, сопровождающихся болью и отеком.
Из проведенного в данной статье анализа методов ЛТ можно признать, что все они модифицируются и успешно применяются для лечения ОА. Апизартрон как неотъемлемая часть ЛТ широко и положительно зарекомендовал себя в лечении заболеваний опорно-двигательного аппарата.



