Введение
Достижения современной дерматовенерологии значительно расширили представление о патогенезе развития себорейного дерматита (СД).
В начале ХХ в. основное значение в интерпретации понятия о СД отводили гиперколонизации кожи грибами рода Malassezia и рассматривали исключительно как инфекционное заболевание. В настоящее время ведущим вектором в понимании патогенетического значения является не исключительная роль процесса как инфекционного, а как заболевания, также имеющего иммуноопосредованные, генетические и другие факторы [1, 2].
СД является хроническим рецидивирующим воспалительным заболеванием с периодами обострений и ремиссий, характеризующимся развитием воспаления на участках кожи в областях с высокой концентрацией сальных желез [3]. Как правило, СД развивается на следующих участках кожных покровов: лицо (глабелла, область межбровья и лоб, крылья носа с возможным переходом на подглазничную и щечную области, носогубная область), волосистая часть головы, внутренняя поверхность наружного уха и ретроаурикулярная область, верхняя часть туловища (межлопаточная область и область в проекции грудины и грудинно-ключичного сочленения), паховые и подмышечные складки, субмаммарная область [4]. СД характеризуется формированием эритематозно-сквамозных или папуло-сквамозных высыпаний на вышеуказанных кожных покровах, вызывающих шелушение, воспаление и зуд, а также выраженную эритему, которая зачастую принимает вид бляшек или кольцевидных фигурных очертаний. Стресс, сезонная смена погодных условий, повышенная выработка кожного сала (себума), наличие иммуносупрессивного статуса, хронических неврологических, эндокринных и психиатрических заболеваний, гепатита В, С, ВИЧ, а также применение некоторых лекарственных средств могут провоцировать или усугублять уже имеющееся заболевание [2, 4].
Результаты эпидемиологического исследования демонстрируют, что различными формами СД в настоящее время страдают во всем мире около 5% всего населения, более того, распространенность существующей невоспалительной формы СД (сухая форма СД, или перхоть), вероятно, стремится ближе к 50%. Существует мнение, что именно СД является самым распространенным дерматологическим заболеванием среди всех групп населения. Необходимо особо выделить, что ученые отмечают несколько пиков заболеваемости СД в течение жизни, есть данные, что существующие пики связаны с изменением гормонального фона [4, 5].
Тактика ведения пациентов подразумевает использование системных препаратов, а именно пероральных противогрибковых средств (флуконазол, итраконазол, кетоконазол и тербинафин) в качестве основного фактора воздействия на грибы рода Malassezia [6]. Кроме того, для лечения упорных и тяжелых форм СД в современной литературе имеются данные о применении системного изотретиноина, использующегося в основном для терапии акне или розацеа [7]. Механизм действия системного изотретиноина основывается на воздействии на терминальную дифференцировку кератиноцитов, снижая секрецию сальных желез и стимулируя базальный апоптоз себоцитов [8].
Поскольку процент тяжелого течения СД достаточно невысок, зачастую врачи-дерматовенерологи используют весь доступный арсенал топических лекарственных средств. Вышеуказанными средствами в настоящее время являются топические антимикотические препараты, глюкокортикостероиды (ГКС), комбинируемые с антимикотическими и противобактериальными препаратами или же монотерапевтическое использование вышеуказанных групп препаратов. Кроме того, используются ингибиторы кальценеврина, препараты с кератолитическим действием и средства с цинком пиритионом [9].
Говоря об активированном цинке пиритионе (АЦП), следует отметить, что средство обладает не только выраженным противовоспалительным, но и противобактериальным и противогрибковым действиями [10, 11]. Вышеизложенные свойства данного средства основываются на способности АЦП встраиваться в клеточные мембраны за счет образования прочной связи с фосфолипидами. Тем самым АЦП выполняет роль ионофора, активируя каскад реакций, состоящих из изменения поляризации и проницаемости клеток. В процессе данных реакций происходит высвобождение митохондриального цитохрома С и последующий апоптоз клеток за счет экспрессии проапоптозных факторов. Немаловажным остается особенность АЦП влиять на активацию дермальных макрофагов, тем самым реализуя опосредованное действие на активацию, пролиферацию и дифференциацию Т-клеток [12, 13].
Целью представленного ретроспективного исследования стала оценка эффективности монотерапии различными формами препарата АЦП пациентов с дифференцированной локализацией СД.
Методы
В ходе исследования в амбулаторных условиях были обследованы 76 пациентов с СД различной степени тяжести, имевших хроническое подостро-воспалительное течение заболевания с периодами длительных обострений. Длительность заболевания варьировалась от 2–3 месяцев до 37 лет.
Диагноз СД установлен на основании типичных жалоб пациентов (высыпания на коже, зуд, шелушение) и физикальной оценки состояния кожных покровов с проведением тщательного визуального осмотра и дерматоскопии элементов высыпаний. Кроме того, на волосистой части головы оценивался симптом Картамышева (пальпация инфильтративных высыпаний для проведения дифференциальной диагностики СД с псориазом: при псориазе исследуемые высыпания имеют четкие периферические границы и при пальпации ощущаются с закрытыми глазами), у всех пациентов симптом носил отрицательный характер [14, 15].
В исследование были включены пациенты в возрасте старше 18 лет с диагностированным рецидивирующим хроническим СД, с ограниченным и распространенным процессом. Критерии невключения: возраст младше 18 лет, беременность, противопоказания к применению АЦП, а также наличие в анамнезе сведений о недавнем применении (10 дней) наружной терапии для лечения СД, использовании пероральных форм противогрибковых препаратов или системного изотретиноина в течение предшествовавших 3 месяцев.
Возраст обследованных пациентов составил 34,29±5,7 года, соотношение женщин и мужчин – 1:3,47 (17 женщин и 59 мужчин соответственно).
Все пациенты были разделены на три группы, исходя из клинической картины течения СД; оценки проходили при первом визите пациента и спустя 2 недели.
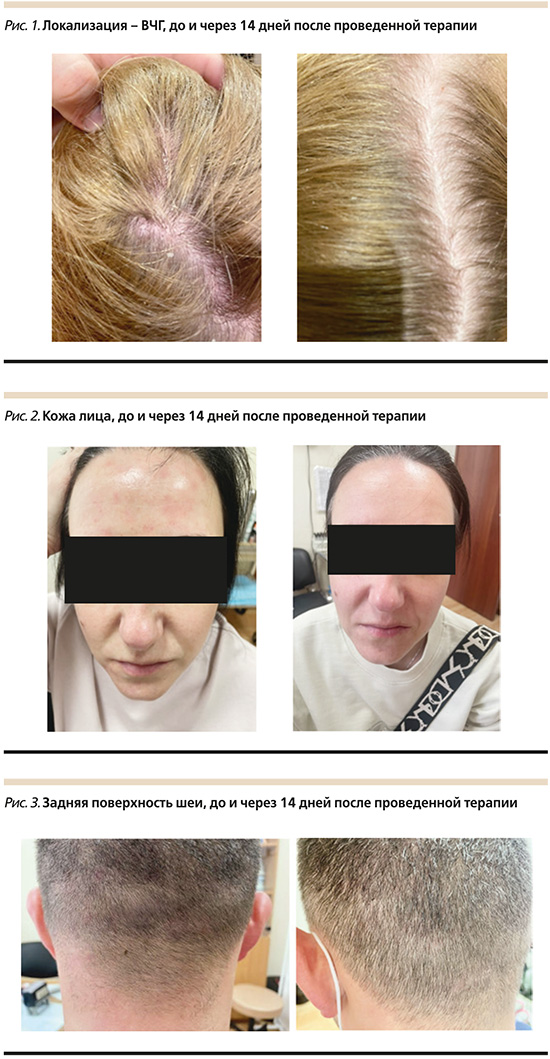
Первая группа – 28 пациентов. Локализация СД затрагивала исключительно кожу волосистой части головы (ВЧГ) и ретроаурикулярной области, при этом характер сыпи носил скорее лихеноидную форму с выраженным мелкопластинчатым шелушением.
В данной группе к применению в качестве монотерапии в состав был включен исключительно шампунь с АЦП. Шампунь использовался 3 раза в неделю в течение 2 недель (рис. 1).
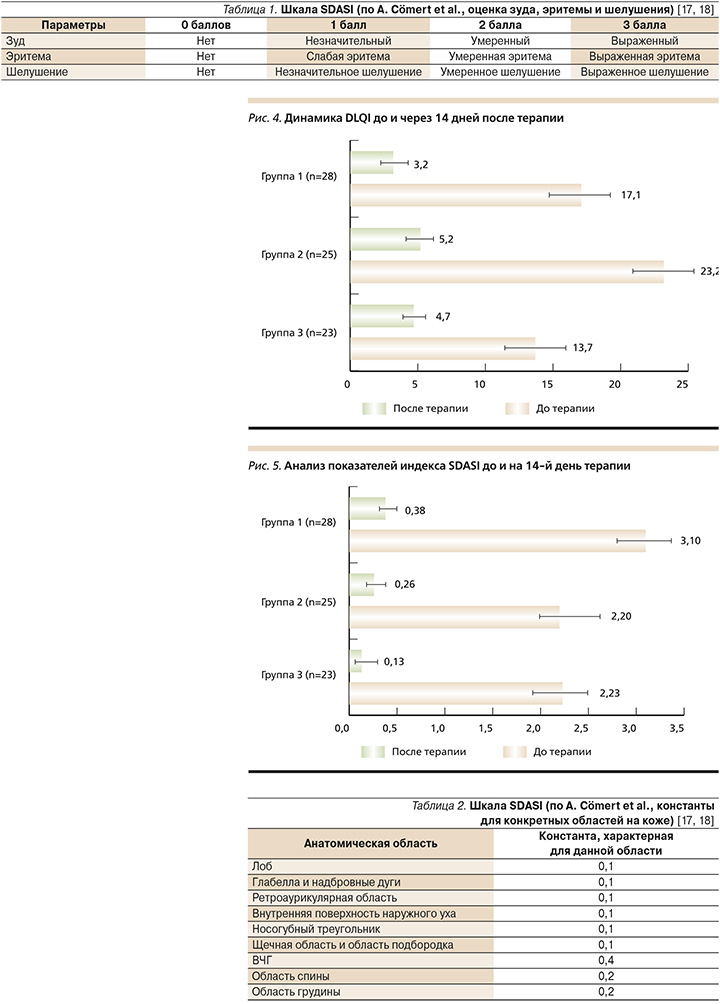
Вторая группа – 25 пациентов. Высыпания были выявлены только на коже лица (область глабеллы, носогубные складки, кожные покровы наружного слухового прохода). В данном случае СД носил скорее эритематозный характер, кроме того, ввиду трудности использования других форм (аэрозоль или шампунь) рекомендован крем АЦП; препарат наносился пациентами на сухую кожу 2 раза в сутки 14 дней (рис. 2).
Третья группа – 23 пациента. Данная группа включала пациентов с экссудативным течением СД на коже груди, спины, на коже задней поверхности шеи и затылочной области ВЧГ. Пациенты использовали аэрозоль АЦП, так же как и предыдущая группа, 2 раза в сутки в течение 14 дней (рис. 3).
Эффективность терапии оценивали на основании дерматологического индекса качества жизни DLQI (the dermatology life quality index), позволяющего оценивать общее здоровье, зуд или болезненность, социальное и эмоциональное функционирование, а также психологическое здоровье пациентов. Полученные данные расценивались по шкале интерпретации, где «0–1 балл – заболевание не влияет на качество жизни», а «29–30 баллов – заболевание чрезмерно сильно влияет на качество жизни» [16, 17]. Кроме того, оценивали индекс тяжести течения СД по шкале SDASI (Seborrheic Dermatitis Area Severity Index), разработанной A. Cömert et al. (2007) на основании шкалы PASI (Psoriasis Area and Severity Index). A. Cömertet al. предлагали оценивать 3 параметра, такие как зуд, интенсивность шелушения и выраженность эритемы, по шкале от 1 до 3 баллов на разных участках кожных покровов, затем сумма полученных баллов (по всем параметрам) умножалась на константу, характерную для конкретной зоны (табл. 1, 2), итоговая сумма баллов при этом варьировалась от 0 до 12,6 балла [17, 18].
Результаты
Среднее значение DLQI у пациентов 1-й группы (n=28) с локализацией на ВЧГ (использование формы шампуня) на первичном приеме составило 17,1±5,3 балла (p<0,05), исходно заболевание сильно влияло на качество жизни пациентов. Индекс SDASI у пациентов 1-й группы составил 3,1±1,11 балла (p<0,05).
Значение DLQI у пациентов 2-й группы (n=25) с локализацией СД на коже лица (использовался крем) составило 23,2±4,7 балла (p<0,05), индекс SDASI у пациентов 2-й группы до начала лечения составлял 2,2±1,86 балла (p<0,05). Результаты опроса свидетельствовали о чрезвычайно сильном влиянии заболевания на жизнь пациентов.
В 3-й группе (n=23, использовался аэрозоль); ввиду локализации процесса на закрытых участках кожного покрова результаты DLQI были несколько ниже: 13,7±3,3 балла, (p<0,05) и существенно сказывались на качестве жизни (рис. 4). Индекс SDASI у пациентов 3-й группы составил 2,23±1,12 балла (p<0,050).
Во группах на фоне проведенного лечения достигнута полная ремиссия во всех случаях на конец 14-го дня использования: отмечалось выраженное снижение зуда, уменьшение площади поражения и выраженности гиперемии и шелушения. Среднее значение DLQI при повторном приеме у пациентов 1-й группы с локализацией на ВЧГ составило 3,2±1,3 балла (p<0,05), во 2-й группе с локализацией СД на коже лица – 5,2±1,7 (p<0,05), в 3-й – 4,7±1,1 балла (p<0,05). Анализ показателей индекса SDASI (рис. 5) также показал достаточно значимый клинический результат. У пациентов 1-й группы с локализацией на ВЧГ значение после терапии составило 0,38±0,2 балла (p<0,05), во 2-й группе с локализацией СД на коже лица – 0,26±0,17 (p<0,05), в 3-й – 0,13±0,16 балла (p<0,05).
Выводы
В заключение следует отметить, что препарат АЦП является эффективным и безопасным средством для топической терапии различных форм СД. С учетом того факта, что препарат выпускается в нескольких лекарственных формах (шампунь, крем и спрей), выбор средства определяется индивидуальными особенностями течения заболевания: удобство использования крема на открытых участках кожного покрова, шампуня – для локализации на ВЧГ, спрея – при локализации на туловище и при экссудативных формах. Поскольку СД является хроническим рецидивирующим процессом, вышеизложенные схемы лечения были рекомендованы пациентам для купирования обострения заболевания (именно в том состоянии, когда пациенты первично обращались за специализированной помощью). Для предотвращения рецидивов пациентам в дальнейшем рекомендовано использование препаратов с частотой применения 1 раз в неделю на протяжении 6 месяцев. Можно предположить, что указанная схема позволит предотвращать обострение СД и добиваться стойкой ремиссии [16].



