Половые стероиды оказывают модулирующее воздействие на синтез и обмен всех важнейших нейротрансмиттеров и нейропептидов. Снижение продукции эстрогенов на фоне угасания функции яичников способствует появлению у ряда женщин разнообразных климактерических расстройств, в связи с чем применение гормональных средств можно отнести к разряду патогенетически обоснованной терапии.
Эстрогеновые рецепторы (α и/или β) обнаружены в отделах лимбической системы мозга (преоптическая область гипоталамуса, гиппокамп и его проводящие пути, прозрачная перегородка, ядра миндалевидного комплекса, поясная извилина), являющихся анатомическим субстратом вегетативных и эмоциональных реакций. При этом половые гормоны оказывают мощное воздействие на центральную нервную систему (ЦНС) не только благодаря связыванию со специфическими внутриядерными рецепторами, но и вследствие различных мембранных негеномных, т. н. “быстрых” составляющих “доли секунды” эффектов [1, 2].
Эндогенные эстрогены имеют первостепенное значение при развитии структур мозга, определяющих женское поведение. Взаимодействие геномных и негеномных механизмов действия эстрогенов определяет широкий спектр и многообразие модулирующего воздействия половых стероидов на основные функции головного мозга. Геномное действие эстрогенов осуществляется через мозговые структуры и синаптические контакты посредством специфических рецепторов. Циркулирующие в крови стероиды влияют на функции лимбической системы, ответственной за эмоции и поведение. Геномные эффекты являются постоянными и контролируют нейрональную архитектонику. Происходит модуляция транскрипции нейротрофинов и их рецепторов (BDNF – нейротрофический фактор мозгового происхождения; NGF–фактор роста нервов); нейротрофины в свою очередь могут активировать эстрогеновые рецепторы в отсутствие эстрогенов. Регуляция морфологии и экспрессии глиальных клеток приводит к снижению активации NF-κВ транскрипционного фактора в глиальных клетках, который регулирует многие провоспалительные гены; модулируется выработка факторов роста [3].
Эстрогены могут оказывать негеномные, “быстрые” эффекты. За счет негеномного действия на мембраны клеток активируется фосфолипаза С и NO-синтаза; снижается перевозбуждение; уменьшается оксидативный стресс в нейронах. Негеномные эффекты эстрогенов затрагивают механизмы нейропередачи: изменение концентрации и доступности таких нейромедиаторов, как серотонин и норадреналин. Эстрогены способствуют вытеснению триптофана из связанного состояния с альбумином плазмы, усилению синтеза и транспорта серотонина. Полагают, что модуляция эстрогенами серотонинергического и адренергического тонуса определяет положительное влияние терапии эстрогенами на настроение и поведение женщин в климактерии [4].
Установлено, что нейроны и глиальные клетки содержат ферментные системы, необходимые для метаболизма половых стероидов, в связи с чем они способны превращать классические стероиды в различные их производные. К таким ферментам относятся ароматазы (в основном в нейронах и, возможно, в момент стресса дополнительно в глиальных клетках). В экспериментальных исследованиях на животных было показано, что содержание ароматаз оказывало влияние на сексуальное поведение и когнитивные функции. Более того, наиболее выраженные дегенеративные изменения отмечались в нервной ткани мышей с выраженным дефицитом ароматаз, что свидетельствует о важной роли локальной конверсии андрогенов в эстрогены в coxранении интегративных функций мозга с возрастом.
По мере угасания функции яичников обмен нейроактивных веществ подвергается серьезным изменениям, обусловленным дефицитом яичниковых гормонов, в связи с чем могут появляться специфические симптомы. Приливы жара, гипергидроз, ожирение и гипертензия рассматриваются как следствие нейроэндокринных изменений в гипоталамусе. Лабильность настроения, раздражительность, депрессия, бессонница, головные боли, снижение когнитивной функции являются результатом изменений в лимбической системе. Самая высокая частота эмоциональных pacстройств у женщин имеет место в послеродовом, предменструальном и перименопаузальном периодах, т. е. в периоды сниженного уровня эстрогенов. В связи с этим терапия эстрогенами является весьма эффективной [5].
Снижение уровня половых гормонов в перименопаузе – своего рода “экзамен” для этих высших регуляторных систем. Синдром дезинтеграции, т. е. нарушение интеграции психических, вегетативных, эндокринных и других функций, клинически проявляется в виде вазомоторных, эмоционально-аффективных нарушений и бессонницы, которые определяют понятие “климактерические расстройства”, по сути, относящиеся к разряду психовегетативых синдромов [6].
Помимо вышеуказанных нарушений в этот период у женщин отмечается снижение когнитивной эффективности, что значительно нарушает социальную адаптацию, работоспособность и отрицательно влияет на ощущение общего благополучия. К настоящему времени вскрыты множественные нейрохимические и нейрофизиологические механизмы, с помощью которых эстрогены оказывают модулирующее влияние на структуру и функцию областей головного мозга, вовлеченных в процессы памяти и другие когнитивные механизмы. В связи с увеличением “жизненных надежд” современных женщин в последнее время отмечается рост внимания исследователей к проблемам возрастного снижения когнитивной функции и роли эстрогенного дефицита в этих процессах [7].
У женщин снижение когнитивной эффективности, особенно памяти и внимания, происходит одновременно с развитием эстрогенного дефицита в климактерии [8, 9]. Безусловно нельзя недооценивать вклад собственно возрастных изменений головного мозга в когнитивную дисфункцию, но, принимая во внимание значительное влияние половых гормонов на структуру, функцию и метаболизм головного мозга, полагают, что в определенной мере эти процессы взаимосвязаны [10].
Успешное развитие диагностических технологий способствовало выявлению половых различий старения головного мозга. Показано, что атрофические процессы, характеризующиеся увеличением объема желудочков, у женщин начинаются уже после 50 лет, т. е. в момент угасания функции яичников, у мужчин позднее – после 60 лет, кроме того, у женщин они прогрессируют быстрее. Связанная с возрастом общая потеря массы мозга у мужчин более выражена во фронтальных и темпоральных отделах, у женщин – в теменных областях и гиппокампе [11, 12]. Использование позитронно-эмиссионной томографии (ПЭТ) выявило значительные различия метаболизма глюкозы в когнитивных центрах у женщин, не характерных для мужчин. Возможно, этим определяются некоторые особенности возрастного снижения когнитивной функции и превалирования ряда нейропсихиатрических расстройств, связанных с этой сферой у женщин (аутизм, дизлексия, болезнь Альцгеймера и др.) по сравнению с мужчинами.
Болезнь Альцгеймера у женщин
Болезнь Альцгеймера (БА) развивается у женщин в 2–3 раза чаще, чем у мужчин, что можно лишь частично объяснить половыми различиями продолжительности жизни. Большинство исследователей, изучающих эту проблему, сходятся во мнении, что снижение уровня эстрогенов в постменопаузе вносит значительный вклад в патогенетические механизмы возникновения и развития этого заболевания у женщин [13, 14].
Половые стероиды имеют значительное регуляторное влияние на структуры головного мозга, связанные с когнитивной функцией. Помимо более высокой частоты БА у женщин по сравнению с мужчинами некоторые факторы риска могут косвенно свидетельствовать о значении гипоэстрогении в патогенезе БА у женщин, к которым относятся гистерэктомия, низкая масса тела и переломы костей. Полагают, что в результате гистерэктомии вторично снижается кровоток в яичниках, что приводит к более быстрому “истощению” яичникового резерва фолликулов и преждевременной менопаузе [15]. Установлено, что у женщин с ранней менопаузой риск БА повышается. Получены данные, что у женщин с массой тела более 68 кг риск развития БА снижается на 30 % по сравнению с теми, у кого этот показатель составляет менее 56 кг. Как известно, уровень эстрогенов в постменопаузе коррелирует с массой тела, поскольку при ожирении повышается продукция эстрогенов на периферии из андрогенных предшественников, а также отмечается более низкий уровень глобулина, связывающего половые стероиды, что может способствовать повышению уровня свободных, биологически активных фракций эстрогенов [16]. Кроме того, к факторам риска БА относят переломы шейки бедра вследствие сенильного остеопороза. И хотя сенильный остеопороз развивается у лиц 70 лет и старше, а гипоэстрогения “ответственна” только за постменопаузальный остеопороз, они несомненно вносят свой вклад как в снижение минеральной плотности кости (МПК), так и в развитие постуральной нестабильности, т. е. обоих факторов, способствующих повышению риска переломов [17, 18]. Риск падений у женщин после наступления менопаузы повышается в 3 раза по сравнению с мужчинами-сверстниками, что в определенной степени определяется нарушением центральной интеграции поступающих извне сенсорных стимулов, а также снижением скорости психомоторных реакций, коррелирующих с уровнем эстрогенов. Таким образом, по-видимому, нарушения ЦНС являются одним из факторов риска переломов наряду со снижением МПК, а не наоборот.
Ведущую роль в патогенезе БА играют также изменения со стороны нейротрансмиттерных систем, особенно холинергическая дисфункция.
Важно отметить еще одно патогенетическое звено развития деменции – сосудистый компонент, поскольку регионарная сосудистая недостаточность отмечается среди 50 % больных БА. Несомненно атеросклеротическое поражение сосудов головного мозга и мозговая ишемия ухудшают течение этого заболевания.
Полагают, что это заболевание, по сути, является следствием дисбаланса между процессами повреждения и восстановления структуры и функции нейронов.
Более половины всех эпидемиологических исследований свидетельствуют о благоприятном влиянии гормональной терапии (ГТ) в качестве профилактики снижения когнитивной функции. В наиболее крупном исследовании Cache Country Study изучали влияние заместительной ГТ на частоту БА в течение трех лет среди 1889 женщин старшего возраста. В ходе наблюдения было выявлено 88 новых случаев деменции по типу БА (диагноз подтвержден в 84 % случаев). У женщин, принимавших ЗГТ, риск БА был снижен (26 случаев из 1066 женщин), по сравнению с женщинами, не принимавшими ЗГТ (58 случаев из 800 женщин) (ОР 0,59; 95 % ДИ 0,36–0,96). Снижение риска было более выраженным у женщин, принимавших ЗГТ ранее не менее 10 лет (7 случаев из 427 женщин) (ОР 0,41; 95 % ДИ 0,17–0,86). В том случае если терапия была начата женщиной более старшего возраста (средний возраст – 70,9 года) и длительность приема терапии составляла от 3 до 10 лет, риск БА повышался (ОШ = 2,12; 95 % ДИ – 0,83–4,71; см. рисунок) [19].
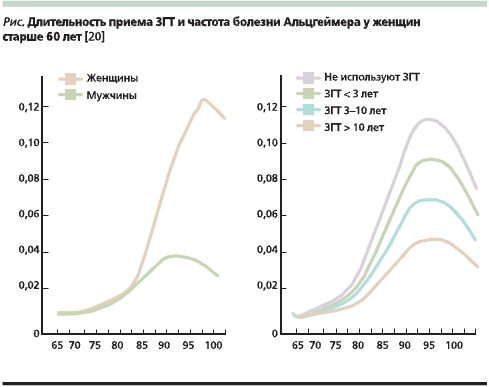
Эстрогены относят к числу регуляторов апоптоза, т. к. они различными путями “защищают” нервную ткань от неблагоприятных эндогенных и экзогенных воздействий, а при возникновении нарушений способствуют восстановлению структуры и функции нейронов, т. е. нормализуют баланс между процессами деструкции и регенерации.
Микроглия представляет собой важный тип глиальных клеток, поскольку “отвечает” за процессы иммунорегуляции в головном мозге. Эстрогены оказывают выраженный противовоспалительный эффект благодаря наличию эстрогеновых рецепторов-α (ЭР-α) в глиальных клетках, регуляции образования цитокинов, влиянию на образование иммуноцитов и мощному антиоксидантному воздействию. Как известно, способность 17-β эстрадиола “гасить” свободные радикалы не уступает таковой витамина Е (α-токоферола) и определяется их некоторой структурной схожестью, а именно наличием гидроксильной группы в позиции 3-го кольца А-стероидной молекулы.
Эстрогены повышают продукцию глиальными клетками важнейших ростовых факторов, а именно фактора роста нервов (nerve growth factor) и нейротрофного фактора, продуцируемого мозгом, играющих очень важную роль в процессах регенерации нервной ткани при неблагоприятных воздействиях.
Крайне важно, что эстрогены увеличивают транспорт глюкозы в головной мозг и усиливают ее метаболизм, поскольку нарушения углеводного обмена играют важную роль в процессах его старения у женщин. Улучшение мозгового кровотока на фоне гормональной терапии обнаружено во многих клинических работах, что также является немаловажным фактором для предупреждения развития деменции. Эстрогены повышают образование фермента NO-синтетазы в эндотелии сосудов, катализирующего превращение L-аргинина и кислорода в мощный вазодилататор оксид азота. Множественное, благоприятное воздействие эстрогенов на сосудистый тонус приобретает все большее значение в свете появившихся в последние годы работ о значительном негативном влиянии артериальной гипертензии на когнитивные функции в различные возрастные периоды. Все эти эффекты эстрогенов улучшают обменные процессы в головном мозге в целом, крайне важны для процессов обучения и памяти в молодом возрасте, а также сохранения функционирования этих механизмов на должном уровне в период возрастной перестройки, профилактики повреждения и гибели нейронов в процессе старения и особенно при БА [6].
Эстрогены оказывают защитное воздействие на синтез и обмен важнейших нейротрансмиттеров, в той или иной мере участвующих в реализации когнитивных процессов и их нарушении с возрастом [7].
Таким образом, к настоящему времени установлены основные нейробиологические механизмы, с помощью которых эстрогены обладают “защитным” влиянием на структуру и функцию нейронов и глиальных клеток, соответственно, на память и другие аспекты когнитивной функции. Ниже суммированы эффекты эстрогенов, позволяющие отнести их к т. н. регуляторам апоптоза, что приобретает особую значимость при дегенеративных процессах в ЦНС.
“Защитное” действие эстрогенов при нейродегенеративных процессах [21] состоит из следующего:
• снижение нейротоксического действия нейротрансмиттера глутамата и уровня свободного кальция в нейронах;
• повышение экспрессии антиапоптотического белка Bcl-2 в мембране митохондрий;
• выраженный противовоспалительный эффект;
• антиоксидантное действие;
• повышение продукции важнейших ростовых факторов;
• увеличение транспорта глюкозы в головной мозг и усиление ее метаболизма;
• повышение уровня белка аполипопротеина Е;
• подавление образования β-амилоида из белка-предшественника;
• рост нервных волокон, повышение синаптической “плотности”;
• усиление мозгового кровотока;
• влияние на важнейшие нейротрансмиттерные системы, особенно повышение образования ацетилхолина;
• защита гиппокампа от неблагоприятного влияния глюкокортикоидов при стрессорных воздействиях.
Следовательно, принимая во внимание роль эстрогенов и их дефицита в функционировании ЦНС, представляется логичным применение ЗГТ в пери- и постменопаузе. Опубликовано более 200 научных статей о благоприятных эффектах эстрогенов на структуру и функцию головного мозга как в культуре клеток, так и на моделях животных, включая приматов. Получены многочисленные данные о молекулярно-биологической основе нейропротективного влияния эстрогенов [22].
Эстрогены: новый подход к терапии шизофрении?
Одной из наиболее интересных гипотез при обсуждении вопросов о возможных причинах развития шизофрении и потенциально новых методах терапии является гипотеза о защитном влиянии эстрогенов.
Обычно рассматривают два аспекта этой гипотезы:
1. На женщин эстрогены оказывают “защитное” влияние в отношении развития тяжелой формы шизофрении в молодом возрасте;
2. Снижение уровня эстрогенов в постменопаузе у чувствительных женщин способствует рецидиву заболевания или первичному проявлению поздней формы шизофрении.
Результаты рандомизированных клинических исследований убедительно свидетельствуют о снижении частоты и выраженности симптомов шизофрении на фоне приема эстрадиола [22]. Обзор более 50 исследований также свидетельствует о различии времени проявления первого эпизода заболевания у мужчин и женщин. Результаты популяционного исследования 232 эпизодов первичных случаев шизофрении свидетельствуют о том, что у мужчин отмечается резкий всплеск частоты заболевания между 15 и 25 годами [23]. Для женщин не характерно резкое повышение частоты заболевания, чаще оно возникает между 15 и 30 годами, у них нередко отмечается второй небольшой пик между 45 и 50 годами. Эти данные подтверждены в крупных популяционных национальных исследованиях, в которых проводилась регистрация отдельных заболеваний, например в Danish Case Register [24].
Принимая во внимание благоприятные результаты эпидемиологических и экспериментальных исследований, авторы данной статьи провели серию клинических работ с женщинами, страдающими шизофренией. В открытом пилотном исследовании было выявлено достоверно более быстрое купирование острых психических симптомов и субъективное ощущение улучшения общего состояния здоровья женщин, получавших 2 мг эстрадиола валерата перорально, по сравнению с пациентками с тем же заболеванием, сравнимых по возрасту, но не получавших эстрадиол (p < 0,05). Далее авторы провели двойное слепое плацебоконтролируемое 28-дневное исследование, целью которого был поиск оптимальной дозы эстрадиола для женщин с шизофренией, в ходе которого все участницы получали традиционный нейролептик, но при этом дополнительно 12 из них – 50 мкг трансдермального эстрадиола, 12 женщин – 100 мкг трансдермального эстрадиола и 12 женщин – плацебо. Всем участницам диагноз “шизофрения” был поставлен в соответствии с критериями Diagnostic and statistical manual of mental disorders, 4-го пересмотра (DSM-IV). Наилучшие результаты, согласно специальной рейтинговой шкале Positive And Negative Syndrome Scale (PANSS), был получен в группе женщин, получавших 100 мкг трансдермального эстрадиола наряду со специфической терапией (р < 0,01) [25]. В продолжение этой работы было проведено еще одно двойное слепое плацебо-контролируемое 28-дневное исследование с участием 102 пациенток с шизофренией, диагностированной согласно критериям DSM-IV. При этом 56 участниц получали 100 мкг трансдермального эстрадиола в виде пластыря, а 46 женщин – идентичный пластырь-плацебо. Всем пациенткам было назначено также антипсихотическое средство в соответствии со стандартным протоколом исследования. Психопатологические проявления исследовались с помощью вышеуказанной рейтинговой системы PANSS. Измерялись уровни эстрадиола, прогестрона, лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона. Кроме того, проведено несколько когнитивных тестов. Женщины, получавшие 100 мкг трансдермального эстрадиола, демонстрировали достоверно лучшие показатели купирования симптомов шизофрении, когнитивных тестов и выздоровления в целом по сравнению с пациентками, получавшими только стандартную антипсихотическую терапию (p < 0,01). В настоящий момент авторы провели еще одно исследование, ADEPT (Definitive Estrogen Patch Trial), по изучению оптимальной дозы эстрадиола с участием 180 женщин с шизофренией репродуктивного возраста в трех группах: 100 мкг трансдермального эстрадиола и пластырь-плацебо. Исследование проводили в течение 8 недель с более жестким контролем антипсихотического лечения и когнитивного тестирования. Полученные в ходе вышеприведенных исследований результаты четко свидетельствуют в пользу гипотезы о протективном влиянии эстрогенов на пациенток с шизофренией. Авторы обнаружили, что применение эстрадиола в виде трансдермальных форм коррелирует со статистически значимым снижением психотической симптоматики у женщин с шизофренией, подтвержденной на основании критериев DSM-IV, по сравнению с женщинами, получавшими только стандартную терапию нейролептиками (p < 0,01). Влияние 100 мкг трансдермального эстрадиола непосредственно на гипоталамо-гипофизарно-яичниковую систему (согласно изменению уровня ЛГ) свидетельствует о том, что эта доза и путь введения оказывают антипсихотическое влияние через центральные дофаминергические и серотонинергические системы [22, 25].
Следовательно, использование эстрогенов в качестве потенциального медикаментозного средства лечения шизофрении у женщин открывает новые возможности для предупреждения и лечения острых случаев заболевания. Необходимо проведение крупных исследований для определения оптимальной дозы и продолжительности терапии женщин с шизофренией и ее безопасности в отношении известных побочных эффектов, а также для решения вопроса о возможности ее использования в качестве монотерапии, а не в комбинации с антипсихотическими препаратами. Существует необходимость разработки новых подходов к терапии шизофрении для достижения длительной ремиссии и значительного улучшения качества жизни этих пациенток.
Эстрогены и эпилепсия
Эндогенные и экзогенные половые стероиды оказывают влияние на частоту приступов и течение эпилепсии у женщин, при этом эстрогены можно отнести к активным проконвульсантам, а прогестагены, наоборот, – к антиконвульсантам. По-видимому, благоприятные эффекты последних вызваны влиянием метаболита прогестерона – аллопрегненолона [26]. Частота приступов эпилепсии у женщин может меняться в течение менструального цикла и с наступлением менопаузы. Тем не менее данные о влиянии пери- и постменопаузы на течение эпилепсии ограниченны и противоречивы. В одних работах выявлено повышение частоты приступов, в других – нет. Есть данные, что у женщин с эпилепсией менопауза наступает на 3–5 лет раньше, но их не достаточно [27].
Эстрогены и мигрень
При выборе ЗГТ пациенток с мигренями необходимо придерживаться следующих рекомендаций [28]:
• использовать максимально низкие дозы эстрогенов;
• отдавать предпочтение 17β-эстрадиолу по сравнению с конъюгированными эстрогенами;
• использовать трансдермальные формы гормонов;
• в качестве гестагенного компонента предпочтение отдавать производным прогестерона (гестагены с остаточными андрогенными свойствами нежелательны);
• по возможности быстрее переходить с циклического на непрерывный режим терапии.
Заключение
Назначая ЗГТ в перименопаузе по поводу климактерических расстройств, мы рассчитываем на благотворное влияние натуральных эстрогенов на мозговой кровоток. Получены объективные доказательства важности эндогенных эстрогенов для сохранения ментальной функции в любом возрасте, а также для профилактики или хотя бы стабилизации нейродегенеративных процессов благодаря комплексному нейропротективному влиянию, направленному на повышение жизнеспособности нейронов. Однако в связи с противоречивостью результатов, полученных в ходе наблюдательных и рандомизированных клинических исследований, относительно влияния ГТ на эти процессы возникает закономерный вопрос: существуют ли критические сроки для назначения ГТ, когда можно рассчитывать на максимально благоприятный эффект такой терапии на когнитивные функции?
У женщин, рандомизированно получавших в ранней постменопаузе эстрогены или плацебо в одном из четырех 2–3-летних исследований, а затем через 5, 10 и 15 лет повторно прошедших исследование когнитивной функции, выявлено снижение риска когнитивных нарушений (ОР = 0,36, 95 % ДИ – 0,15–0,90) по сравнению с участницами, получавшими плацебо [19]. Эти результаты свидетельствуют в пользу утверждения, будто применение даже краткосрочной эстрогенной терапии в перименопаузе и ранней постменопаузе может оказывать протективное влияние на когнитивные функции в дальнейшем.


