Обсуждается проблема острого ринита (ОР), наиболее частой причиной которого является вирусная инфекция. Раскрываются патогенетические механизмы ОР, связанные с нарушением деятельности мерцательного эпителия, угнетением механизмов локальной защиты верхних дыхательных путей. С учетом морфофункциональных нарушений, возникающих в полости носа при ОР, и клинических проявлений заболевания (назальная обструкция, ринорея)? закономерным и патогенетически обоснованным компонентом лечения в этих случаях является использование деконгестантов, обеспечивающих быстрое уменьшение отека, восстановление проходимости носовых ходов и улучшение носового дыхания.
Наиболее частой причиной острого ринита (ОР) является вирусная инфекция. По
разным данным, частота вирусной этиологии острого воспаления слизистой оболочки носа колеблется от 70 до 80 % [13]. В России, по оценкам экспертов, на долю гриппа и других острых респираторных вирусных инфекций приходится до 90 % всей инфекционной заболеваемости [1]. Дети болеют
чаще, чем взрослые (6–8 и 2–4 эпизода соответственно) [13].
При этом заболевании вирусы гриппа, парагриппа, риновирусы могут играть самостоятельную этиологическую роль или определяться в виде вирусно-микробных ассоциаций, что наблюдается среди 20 % больных острым риносинуситом (Е.И. Каманин и соавт., 2008). Инкубационный период при риновирусной инфекции составляет 1–3 дня, при гриппе А – от нескольких часов до 2 суток, а при
гриппе В – до 3–4 суток.
Начальным этапом развития ОР является адгезия вируса к клеткам респираторного эпителия. В дальнейшем происходят его проникновение в клетку и репликация. Выход зрелых вирионов сопровождается гибелью клеток мерцательного эпителия, нарушением барьерной функции слизистой
оболочки, микробной контаминацией начальных отделов респираторного тракта и трансэпителиальной миграцией патогенов.
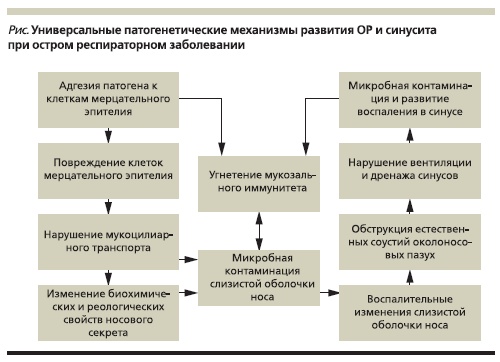
Универсальные патогенетические механизмы ОР при остром респираторном заболевании независимо от вида возбудителя связаны с нарушением деятельности мерцательного эпителия, угнетением механизмов локальной защиты (неиммунной и иммунной) верхних дыхательных путей. В общем
виде последовательность основных этапов патогенеза ОР можно представить следующим образом (см. рисунок).
Наиболее вероятными бактериальными возбудителями ОР являются Streptococcus pneumoniae и Haemophilus influenzae, а также Moraxella catarrhalis, Streptococcus pyogenes, Streptococcus
viridans, Pseudomonas spp. и некоторые другие. Большинство из перечисленных микроорганизмов продуцируют вещества, которые стимулируют назальную секрецию, ингибируют мукоцилиарную активность. Изменение количественных и качественных характеристик носового секрета, скопление большого количества слизи в полости носа отрицательно сказываются на эффективности
транспортной функции мерцательного эпителия. При этом биение ресничек мерцательных клеток не сопровождается перемещением носового секрета. Происходит закономерное увеличение экспозиции патогенов на поверхности слизистой оболочки, усиление их цитопатического действия, угнетение
факторов местной защиты начальных отделов респираторного тракта.
Интенсивность воспалительной реакции в значительной мере зависит от вирулентности возбудителя, исходного состояния слизистой оболочки и макроорганизма в целом. На фоне трансэпителиальной миграции патогенов происходит активация антибактериальной защиты. Важную роль в реализации иммунного ответа играет фагоцитоз, который обеспечивается макрофагами и нейтрофилами. Эти клетки проникают через капиллярную стенку и перемещаются в очаг воспаления, осуществляя поглощение, переваривание и представление Т-лимфоцитам частиц лизированных бактериальных
клеток, которое происходит с помощью белков главного комплекса гистосовместимости. Это в свою очередь стимулирует секрецию В-клетками специфических антител (иммуноглобулинов), основной функцией которых является распознавание и элиминация антигенов. В первую очередь осуществляется продукция иммуноглобулинов класса М, которые обладают высокой комплементарной активностью и эффективно связывают комплемент.
Система комплемента осуществляет неспецифическую защиту организма и состоит примерно из 20 различных белков (компонентов), которые находятся в плазме крови и составляют около 4 % от всех белков плазмы. Действие системы комплемента может осуществляться по нескольким направлениям:
путем привлечения в очаг воспаления фагоцитирующих клеток; путем прикрепления компонентов комплемента к микробной стенке и формирования в ней отверстия и лизиса микроба; путем опсонизации, когда компоненты комплемента присоединяются к бактерии, в результате чего она становится мишенью для фагоцитирующих клеток, которые имеют рецепторы к компонентам комплемента. В дальнейшем при повторных контактах с антигеном В-клетки осуществляют продукцию
иммуноглобулинов G, A.
Большую роль в патогенезе острого воспаления слизистой оболочки носа играют цитокины, источниками которых являются активированные макрофаги и Т-клетки. Представляя собой небольшие белково-пептидные информационные молекулы, цитокины играют ключевую роль в реализации и регуляции неспецифической защиты и специфического иммунитета. Одним из первых в ответную защитную реакцию организма при действии патогенных факторов включается интерлейкин-1β (ИЛ-1β), который синтезируется и выделяется преимущественно макрофагами и моноцитами. Он регулирует воспалительные и иммунные процессы, активирует нейтрофилы, Т- и В-лимфоциты, стимулирует синтез белков острой фазы, повышает фагоцитоз, проницаемость сосудистой стенки.
Мощным провоспалительным медиатором является ИЛ-8, относящийся к хемокинам. Его высвобождение из фибробластов и эпителиальных клеток контролируется действием бактериальных эндотоксинов, а также фактора некроза опухоли α (ФНО-α), ИЛ-1 и ИЛ-3. Этот цитокин стимулирует миграцию фагоцитирующих клеток в очаг воспаления, участвует в формировании на эндотелиальных клетках
рецепторов, которые, взаимодействуя с нейтрофилами, обеспечивают их адгезию к эндотелию. В дальнейшем происходит перемещение нейтрофилов в ткани, где они поглощают микробные клетки, ассоциированные с иммуноглобулином G и фрагментом комплемента C3b.
Необходимо отметить, что изменения микроциркуляторного русла – mодин из наиболее важных и раннихпатофизиологических сдвигов, возникающих в слизистой оболочке носа вответ на воздействие патогена. При этом после спазма микрососудов возникает выраженное расслабление артериовенозных анастомозов и прекапиллярных сфинктеров, которое сопровождается замедлением крово-
тока, повышением давления в мелких артериях, артериолах, венулах и капиллярах, местной гиперемией. Нарастание давления в микрососудах и увеличение проницаемости сосудистой стенки ведут к фильтрации жидкой части крови из микрососудов в окружающие ткани, способствуют развитию воспалительного отека слизистой оболочки носовой полости. Кроме увеличения проницаемости сосудистой стенки процессы экссудации связаны с повышением коллоидно-осмотического давления в тканях. Важная роль в развитии артериальной гиперемии и отека тканей в очаге воспаления принадлежит провоспалительным медиаторам. Существенное влияние на артериальный кровоток и транссудацию плазмы оказывает оксид азота, продуцируемый эндотелием [11]. Полагают, что оксид азота может также участвовать в регуляции секреторной активности желез слизистой оболочки носовой полости, способствовать увеличению отечных изменений [5]. С гиперпродукцией оксида азота связывают цитотоксический эффект при воспалительных процессах в полости носа и околоносовых пазухах [14]. Это, в частности, обусловлено накоплением продуктов метаболизма оксида азота – свободных радика лов, которые вызывают токсическое повреждение эпителия дыхательных путей и способствуют усилению воспаления [4, 9].
Перечисленные патофизиологические сдвиги при ОР сопровождаются достаточно типичными субъективными и объективными изменениями, которые, как правило, характеризуются определенной последовательностью (стадийностью) процесса. Обычно дифференцируют три стадии ОР:
1-я стадия (“сухая”) – наблюдается в течение нескольких часов после начала заболевания. Субъективные ощущенияхарактеризуются наличием парестезий (зуда, ощущения жжения) в полости
носа, чихания, заложенности носа. При риноскопии определяется диффузная гиперемия, сухость слизистой оболочки.
2-я стадия (“влажная”, “стадия серозных выделений”) – проявляется нарастанием ощущения заложенности носа, появлением обильных водянистых выделений, снижением обоняния. При осмотре носовой полости выявляется избыточное количество серозного отделяемого на поверхности гиперемированной слизистой оболочки. Обычная длительность этой стадии – 2–3 суток.
3-я стадия (“стадия гнойных выделений”) – выделения из носа приобретают слизисто-гнойный характер, слизистая оболочка становится менее отечной, уменьшается ее гиперемия, наблюдается постепенное улучшение носового дыхания, обоняния. При благоприятном течении заболевания
перечисленные изменения через 7–8 суток завершаются.
С учетом морфофункциональных нарушений, возникающих в полости носа при ОР, и клинических проявлений заболевания (назальная обструкция, ринорея) закономерным и патогенетически обоснованным компонентом лечения в этих случаях является использование деконгестантов, которые обеспечивают быстрое уменьшение отека, восстановление проходимости носовых ходов и улучшение носового дыхания.
Терапевтические эффекты деконгестантов связаны с влиянием на механизмы регуляции тонуса сосудов слизистой оболочки носа. Воздействуя на постсинаптические α-адренорецепторы, деконгестанты
вызывают быстрое сокращение кавернозной ткани слизистой оболочки носа, уменьшение кровотока в микроциркуляторном русле, снижение носовой резистентности. Это обусловливает широкое использование противоотечных препаратов для восстановления (улучшения) носового дыхания.
Эффективность назальных деконгестантов при инфекционном рините подтверждена в контролируемых исследованиях. На основании анализа семи обзоров, отвечающих критериям включения (рандомизированные, плацебо-контролируемые исследования), отмечено статистически значимое по сравнению с плацебо уменьшение субъективных симптомов назальной обструкции уже после одной дозы деконгестантов, что подтверждалось и существенным снижением резистентности носовой полости. Повторные дозы назальных деконгестантов сопровождались статистически менее выраженным снижением заложенности носа и носового сопротивления в течение трех–пяти дней [15]. В двух исследованиях было констатировано относительно небольшое число побочных эффектов, проявившихся небольшим увеличением риска бессонницы у принимавших псевдоэфедрин по сравне-
нию у пациентов с плацебо.
Кроме этого терапевтическое действие деконгестантов может быть обусловлено ингибированием экспрессии провоспалительных медиаторов. Местное применение деконгестантов (нафазолина) сопровождается снижением содержания в носовой полостиоксида азота, что, как полагают, связано с вазоконстрикцией, изменением кровотока и уменьшением субстрата эндогенного оксида азота в слизистой оболочке носа [6]. В других исследованиях наблюдалось ингибирующее влияние оксиметазолина и ксилометазолина на активность ферментов, катализирующих синтез NO в слизистой оболчке носа [16]. В присутствии физиологических доз оксиметазолина отмечается снижение секреции ИЛ-1β, -6, -8; ФНО-α [10].
Применение деконгестантов, в частности оксиметазолина, ксилометазолина, при ОР обычно не сопровождается какими-либо патологическими изменениями слизистой оболочки носа. Вместе с тем одной из особенностей интраназальных сосудосуживающих препаратов, заставляющей с осторожностью относиться к их использованию, является цилиодепрессивное действие этих препаратов. В бóльшей степени это относится к производным нафазолина, тетризолина, инданозолина, в меньшей – к препаратам, содержащим ксилометазолин и оксиметазолин [3]. В экспериментально-клинических исследованиях показано, что под влиянием препаратов группы нафазолина частота биения ресничек уменьшалось на 50 % от исходного уровня в течение 2–3 минут, а для препаратов, в состав которых входят ксилометазолин и оксиметазолин, этот показатель достигал 40–60 минут.
Одним из распространенных способов повышения активности мукоцилиарного транспорта при воспалении слизистой оболочки носа являются ирригационные процедуры с использованием раствора хлорида натрия различной концентрации – изотонического, гипертонического и гипотонического. Увлажняющее и гигиеническое действия солевых растворов способствуют уменьшению экспозиции
на слизистой оболочке носовой полости различных микроорганизмов и повреждающих частиц, содержащихся во вдыхаемом воздухе, что препятствует всасыванию токсинов и аллергенов. Кроме этого эти растворы разжижают слизь и нормализуют ее продукцию бокаловидными клетками, размягчают подсыхающий секрет, улучшают кровообращение в слизистой оболочке.
Благодаря такому действию солевые растворы уменьшают потребность в использовании лекарственных препаратов при патологии носа и околоносовых пазух, улучшают качество жизни пациентов. Анализ опубликованных материалов (результатов клинических исследований, обзоров) свидетельствует о положительном влиянии увлажнения слизистой оболочки на мукоциалиарную активность, подчеркивают безопасности процедуры, которая не имеет документально подтвержденных серьезных
побочных эффектов, что делает возможным ее применение при лечении риносинусита и для послеоперационного туалета носовой полости как у взрослых, так и детей [7, 8].
С целью минимизации неблагоприятного действия деконгестатов на цилиарную активность слизистой оболочки носа в последние годы активно разрабатываются и внедряются в клиническую практику лекарственные формы, в состав которых входят сосудосуживающие препараты и морская вода. Сравнительно недавно на отечественном фармацевтическом рынке появился препарат, представляющий собой комбинацию ксилометазолина гидрохлорида и морской воды в виде назального спрея Снуп.
Как показали клинические наблюдения, уже на 4-е сутки применения спрея Снуп у 70 % пациентов с ОР отмечалось уменьшение, а на 7-е – полное отсутствие выделений из носа. Носовое дыхание у всех больных восстанавливалось на 6–7-й день лечения. В группе пациентов, использовавших 0,1 %-ный раствор ксилометазолина в виде капель, исчезновение ринореи и заложенности носа регистрировалось на 10-й день лечения [2].
По всей вероятности, определенные преимущества препарата Снуп могут быть связаны с формой доставки действующего вещества ксилометазолина. Спрей обеспечивает проникновение препарата в более глубокие отделы носовой полости и более тесный его контакт со слизистой оболочкой. К тому же морская вода, входящая в состав препарата, оказывает положительное влияние на восстановление
физиологических характеристик слизистой оболочки. Прежде всего речь идет об уменьшении вязкости носового секрета и восстановлении мукоцилиарного клиренса. По-видимому, перечисленные обстоятельства способствуют более полной реализации собственного противовоспалительного действия деконгестанта, входящего в состав препарата Снуп. Важным аспектом применения Снуп является менее выраженное цилиодепрессивное действие ксилометазолина, что может способствовать более выраженному регрессу симптомов ОР.
Как и другие деконгестанты, препарат противопоказан при беременности, артериальной гипертензии,
тахикардии, выраженном атеросклерозе, закрытоугольной глаукоме, гипертиреозе, атрофическом рините, после эндоназальных вмешательств, сопровождавшихся обнажением твердой мозговой оболочки.
При частом (длительном) применении возможны раздражение, сухость или гиперсекреция слизистой оболочки носа, парестезии в носу, заложенность носа, сердцебиение, нарушения сердечного ритма, повышение артериального давления, головная боль, рвота, расстройства сна, нарушение зрения, депрессия.
С учетом перечисленных обстоятельств рациональное применение препарата Снуп может повышать эффективность и сокращать сроки лечения острого воспаления слизистой оболочки носа.
Носуля Е.В. – д.м.н., профессор кафедры оториноларингологии, e-mail:
Ким Ирина Анатольевна – д.м.н., кафедра оториноларингологии РМАПО.
Винников Александр Константинович – к.м.н., доцент кафедры оториноларингологии РМАПО.
Васина Л.А. – врач-терапевт кафедры оториноларингологии РМАПО.