Пациенты старше 65 лет составляют около 14 % от общей численности населения Российской Федерации, однако их доля растет и к 2050 г., по прогнозам, превысит 20 % [1]. При этом, например, в ревматологии США расходуется более 50 % ресурсов на оказание помощи пожилым больным [2]. Большинство ревматических заболеваний (РЗ) чаще развивается в пожилом возрасте, поэтому следует ожидать, что число пожилых больных РЗ будет продолжать расти, в т. ч. это касается и заболеваний, которые ранее считались редкими в практике врача-терапевта и даже ревматолога.
Пожилые пациенты имеют особенности, нередко затрудняющие раннюю диагностику и эффективную терапию. Во-первых, у большинства из них имеются сопутствующие заболевания, такие как артериальная гипертензия, ишемическая болезнь сердца, сахарный диабет и многие другие. Частое исключение таких больных из рандомизированных клинических исследований также ограничивает возможность выработки подходов к терапии, основанных на принципах доказательной медицины [3]. Во-вторых, медикаментозная терапия пожилых пациентов сопряжена с повышенным риском нежелательных эффектов, множественных лекарственных взаимодействий из-за вынужденной полипрагмазии и сниженной приверженности лечению [4]. В-третьих, многие врачи справедливо насторожены в отношении онкологических заболеваний в этой группе больных. К сожалению, на фоне этого иногда происходит недооценка клинических проявлений других заболеваний, в т. ч. РЗ.
Наконец, в силу перечисленных факторов течение многих РЗ и их прогноз существенно хуже у пожилых больных, что определяет необходимость быстрого начала лечения и увеличивает цену ошибки.
Одной из наиболее сложных диагностических проблем для пожилого больного является лихорадка. Исследования лихорадки неясного генеза (ЛНГ) у пожилых показывают, что в отличие от более молодых пациентов в большинстве случаев (более 85 %) возможно установление точного диагноза [5] (табл. 1).
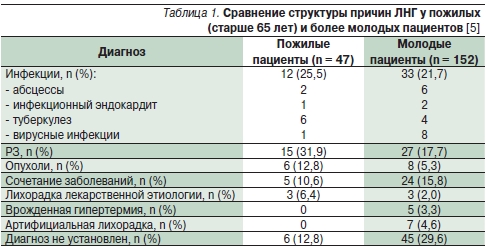
Достаточно часто ЛНГ является нетипичным проявлением распространенного заболевания. Инфекционные болезни являются причиной лихорадки в 25–35 % случаев, включая туберкулез, который более распространен среди пожилых. Доля злокачественных опухолей меньше и составляет от 12 до 23 % [5].
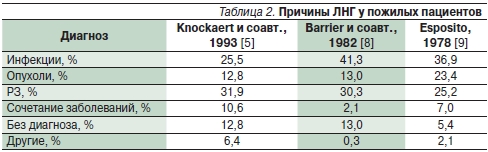
Анализ причин ЛНГ в специализированных исследованиях (табл. 2) демонстрирует, что доля РЗ составляет от 25 до 32 %. Среди РЗ преобладают (до 60 %) гигантоклеточный артериит и ревматическая полимиалгия [6, 7].
Артериит Хортона (АХ; височный артериит, гигантоклеточный артериит) – гранулематозный артериит аорты и ее главных ветвей (главным образом экстракраниальных ветвей сонной артерии) с частым вовлечением височной артерии. Обычно встречается у людей старше 50 лет и часто ассоциируется с ревматической полимиалгией [10]. Заболеваемость АХ колеблется от 7 до 33 случаев на 100 тыс. населения, распространенность АХ в Европе составляет приблизительно 15 случаев на 100 тыс. человек [6]. Среди пожилых пациентов данный васкулит в сочетании с ревматической полимиалгией занимает первое место.
Ниже приведено клиническое наблюдение пациента 67 лет, который обратился в клинику им. Е.М. Тареева с мучительной головной болью (ГБ) и лихорадкой, до этого неоднократно госпитализировался в различные медицинские стационары для исключения инфекционных и онкологических заболеваний.
Клинический случай
Пациент длительно страдал первичной артериальной гипертензией, получал эффективную терапию антигипертензивными препаратами. Заболел остро, в июле 2011 г. впервые появилась интенсивная ГБ пульсирующего характера преимущественно в левой височной области. В течение недели больной принимал различные нестероидные противовоспалительные средства (НПВС) без эффекта, интенсивность ГБ нарастала. Был госпитализирован в кардиологическое отделение городской клинической больницы с диагнозом “гипертоническая болезнь”. На момент госпитализации в общем анализе крови СОЭ 23 мм/ч, результаты общего анализа мочи и биохимического анализа крови, а также онкомаркеров – без особенностей. Проведена рентгенография органов грудной клетки: легкие без патологии, аорта уплотнена, расширение сердца влево. При рентгенографии шейно-грудного отдела позвоночника выявлен остеохондроз, признаки деформирующего спондилоартрита грудного отдела позвоночника. При компьютерной томографии данных за объемное образование или очаговый процесс в головном мозге не получено. Больной консультирован неврологом, диагностированы хроническая ишемия головного мозга, дисциркуляторная энцефалопатия II степени с цефалгическим синдромом, обузусная ГБ на фоне длительного приема анальгетиков. Рекомендовано прекратить прием НПВС, назначены амитриптилин, глицин, антипсихотические препараты. При дуплексном сканировании экстракраниальных артерий: двусторонний стеноз общей сонной артерии до 15 %, внутренней сонной артерии – до 20 %. При эхокардиографии – незначительное увеличение полости левого предсердия и незначительная концентрическая гипертрофия миокарда левого желудочка, уплотнение стенок аорты, сократительная функция левого желудочка не нарушена.
Была скорректирована антигипертензивная терапия, и больной был выписан для продолжения лечения амбулаторно. Однако и после выписки, несмотря на нормальные показатели артериального давления, проводимую терапию и прием антидепрессантов, ГБ сохранялась. К этому моменту из пероральных анальгетиков незначительное облегчение приносили только препараты диклофенака, которые пациент был вынужден использовать ежедневно.
В начале августа наряду с усилением ГБ пациент впервые отметил повышение температуры тела до 39 °C, появление озноба на высоте лихорадки. Состояние было расценено как инфекционный процесс неуточненной локализации, амбулаторно назначен цефтриаксон, однако лихорадка и ГБ сохранялись. При магнитно-резонансной томографии головного мозга были обнаружены небольшие очаги повышенной интенсивности в глубоких и субкортикальных слоях обоих полушарий большого мозга, расцененные как сосудистые.
С учетом сохранения нестерпимых ГБ в сочетании с лихорадкой пациент был направлен в инфекционную больницу с подозрением на менингоэнцефалит. Выполнена люмбальная пункция, позволившая исключить данный диагноз, тем не менее проведен курс антибактериальной терапии без эффекта. После выписки сохранялись выраженные ГБ, впервые в височной и лобной областях с обеих сторон появились плотные извитые сосуды.
При повторной госпитализации в районную ГКБ в анализах: повышение СОЭ до 70 мм/ч, фибриноген – 10,8 г/л, С-реактивный белок (СРБ) – 20 норм, анемия (гемоглобин 113 г/л). Вновь обсуждался септический процесс, неоднократно проводился посев крови, однако роста бактерий не выявлено. При чреспищеводной эхокардиографии данных за эндокардит также не получено. Исключены кишечные инфекции, редкие инфекционные заболевания.
С учетом возраста пациента также проводился онкопоиск, который включил компьютерную томографию грудной клетки, брюшной полости с контрастированием, эзофагогастродуоденоскопию. Онкомаркеры (раковый эмбриональный антиген, простатоспецифический антиген, маркер рака поджелудочной железы CA19-9, α-фетопротеин) – в пределах нормы. Была выполнена стернальная пункция: пунктат клеточный, показатели миелограммы в пределах нормальных значений, мегакариоциты в достаточном количестве. Методом полимеразной цепной реакции исключены вирусы простого герпеса VI типа, цитамегаловирус, вирус Эпштейна–Барр, отрицательные пробы на бруцеллез, иерсиниоз, псевдотуберкулез, сальмонеллез. Прокальцитониновый тест – менее 0,5 (отрицательный), антицитоплазматические антитела не обнаружены. Повторно выполнено ультразвуковое исследование органов брюшной полости, почек, малого таза, щитовидной железы, рентгенография придаточных пазух носа, правой височной кости. Фиброколоноскопия и ректороманоскопия были выполнены в марте 2011 г., от повторения данных исследований было решено воздержаться. Была предпринята еще одна попытка лечения антибактериальными препаратами, не имевшая успеха.
После выписки состояние пациента продолжало ухудшаться: сохранялись интенсивные ГБ, требовавшие ежедневного внутримышечного введения НПВС, лихорадка до 39,4 °С. Был консультирован в клинике им. Е.М. Тареева амбулаторно. При осмотре обращали на себя внимание выступающие над поверхностью кожи артерии в височных и лобных областях, которые отчетливо пальпировались в виде плотных тяжистых жгутов.
Подробное обследование позволило исключить онкологические, инфекционные и неврологические причины ГБ и лихорадки; кроме того, активное лечение различными антибактериальными препаратами и НПВС оказалось неэффективным. Характерное сочетание визуального изменения височных артерий, длительной лихорадки и мучительной ГБ позволило диагностировать АХ.
Больной был госпитализирован в клинику им. Е.М. Тареева. По результатам обследования сохранялась выраженная воспалительная активность в виде повышения СОЭ до 63 мм/ч, СРБ до 11 норм, фибриноген 9,6 г/л, гемоглобин 96 г/л. Характерная клиническая картина заболевания и подробное обследование, выполненное до момента госпитализации, позволили начать патогенетическое лечение преднизолоном в дозе 25 мг/сут без проведения морфологического исследования височной артерии. Уже на второй день лечения отмечены уменьшение ГБ вплоть до их полного исчезновения, нормализация температуры, что было расценено как дополнительный признак височного артериита. Через 2 недели при контрольном исследовании СОЭ 20 мм/ч, СРБ отрицательный, фибриноген 4,1 г/л, появление тенденции к повышению концентрации гемоглобина (106 г/л). Был выписан под амбулаторное наблюдение, при консультации через месяц лабораторных признаков активности заболевания обнаружено не было, ГБ не рецидивировали, начато постепенное снижение дозы глюкокортикоидов.
К марту 2012 г. получает преднизолон в дозе 15 мг/сут, ГБ не рецидивировали. В лабораторных анализах признаков воспалительной активности нет, СОЭ и СРБ в пределах нормы.
Приведенное выше клиническое наблюдение демонстрирует достаточно типичный путь пациента с гигантоклеточным артериитом, когда предположение о системном характере заболевания возникает только после появления отчетливых признаков системного воспаления и видимого изменения височных артерий. К сожалению, нередки случаи, когда диагноз устанавливают уже только после развития тяжелых и зачастую необратимых осложнений, в первую очередь тромбоза артерий сетчатки, приводящего к необратимой потере зрения.
Обсуждение
Причины ГБ у лиц пожилого возраста разнообразны. Как и у молодых пациентов, у них преобладает первичная ГБ (ГБ напряжения, мигрень и т. п.), однако ее доля с возрастом уменьшается, а вторичной, наоборот, возрастает [11]. Среди вторичных ГБ (к причинам которых относятся объемные образования в головном мозге, невралгии, тромбозы и др.) особое место занимает АХ [12].
Предположить диагноз АХ можно при сочетании характерных клинических проявлений и наличии признаков системного воспаления. Настороженность в отношении данного заболевания должны вызывать любая лихорадка неясного генеза у лиц старше 50 лет, необоснованное повышение СОЭ, а также появление новых сильных ГБ у пациентов данной группы [13]. Все три “классических” признака наблюдались и у описанного выше пациента, однако постепенное, а не одномоментное их появление, возможно, затруднило диагностику данной патологии на ранних этапах и привело к достаточно позднему установлению диагноза.
ГБ наблюдается среди 80–90 % пациентов и является самым характерным признаком АХ [14, 15]. Офтальмологические расстройства имеют место среди 25–50 % больных АХ [16, 17]. Частичная или полная потеря зрения является наиболее грозным осложнением АХ, однако вовремя начатая адекватная иммуносупрессивная терапия значительно снижает риск их развития [18]. Именно высокий риск поражения органов зрения заставил начать лечение описанного выше больного глюкокортикоидами до проведения биопсии височной артерии.
Среди частых симптомов височного артериита также важно отметить “хромоту” нижней челюсти (слабость и быструю утомляемость жевательных мышц) – 64 %, а также болезненность в месте пальпации a. temporalis superficialis – 40 %. Поражение почек встречается крайне редко, однако при этом может носить самый разнообразный характер: мембранозный гломерулонефрит, гломерулонефрит с полулуниями, гранулематозный гломерулонефрит. Описаны случаи возникновения острой почечной недостаточности среди пациентов с гигантоклеточным артериитом, а также развития амилоидоза почек на фоне АХ.
Причиной поражения сердца (ишемия и инфаркт миокарда) служат патологическое сужение коронарных артерий и тромбоз, возникающие в результате васкулита коронарных артерий. Необходимо отметить, что в силу возраста пациентов (старше 50 лет) дополнительный вклад могут вносить атеросклеротические изменения коронарных сосудов, что затрудняет дифференциальную диагностику между атеросклеротическим и воспалительным (требующим активного иммуносупрессивного лечения) генезом ишемии. Высокий уровень холестерина у пациента в приведенном наблюдении является дополнительным фактором риска развития острых сердечно-сосудистых нарушений.
Лабораторная диагностика АХ основана на выявлении различных маркеров системного воспалительного процесса в крови. При рутинном обследовании обнаруживают повышение СОЭ, возможно появление реактивного тромбоцитоза или развитие анемии, вызванной длительным течением основного заболевания. Число лейкоцитов обычно остается в пределах нормы. Для подтверждения наличия воспалительного процесса и более точной оценки его выраженности используют ряд дополнительных исследований: определение уровня СРБ, интерлейкина-6, α2-глобулинов, VIII фактора свертывания, повышение уровней которых указывает на наличие воспалительного процесса.
Среди инструментальных методов наиболее простое в использовании – дуплексное ультразвуковое исследование поверхностной височной артерии. Наиболее характерными признаками АХ, по данным ультразвукового исследования крупных артерий, являются гипоэхогенный ореол, видимый в обеих проекциях, а также стенозы или окклюзия.
Вовлечение в патологический процесс аорты и экстракраниальных артерий отмечается в 15–27 % случаев и может потребовать проведения позитронно-эмиссионной томографии (при Такаясу-подобном или атипичном вариантах АХ) [19].
Цель лечения АХ – подавление активности впервые выявленного заболевания и поддержание ремиссии посредством минимально возможной иммуносупрессивной терапии. Основную угрозу при данном васкулите представляют офтальмологические осложнения, выраженность которых может варьироваться от минимальных и кратковременных нарушений зрения до полной и необратимой слепоты.
Лечение больных АХ без непосредственной угрозы потери зрения рекомендуется начинать с назначения преднизолона или его эквивалентов в дозе 40–60 мг/сут (0,7 мг/кг). Если у больного были анамнестически amaurosis fugax (проходящая слепота), полная или значительная потеря зрения на один глаз или ранние признаки поражения второго глаза, рекомендуется следующая терапия: однократное внутривенное введение метилпреднизолона в дозе 1000 мг с последующим переходом на прием преднизолона внутрь в дозе 60–80 мг/сут. Крайне важно назначение антиагрегантной или антикоагулянтной терапии, т. к. воспалительный процесс в ветвях сонной артерии может приводить к тромбированию артерий сетчатки и центральной артерии сетчатки, а также к другим ишемическим осложнениям. Поэтому всем пациентам с АХ в отсутствие абсолютных противопоказаний рекомендуется прием ацетилсалициловой кислоты в дозе 75–150 мг/сут для профилактики ишемических осложнений.
Неоднозначной остается роль метотрексата в лечении АХ. В крупном многоцентровом исследовании [20] показано, что дополнительное применение метотрексата не улучшает прогноз при данном васкулите. Однако необходимо отметить, что, согласно дизайну исследования, спустя 3 месяца от начала лечения преднизолоном пациенты переходили на прием преднизолона через день, что, возможно, повлияло на результаты исследования. Тем не менее в двух других проспективных плацебо-контролируемых исследованиях [21, 22] метотрексат продемонстрировал свою эффективность. Мета-анализ трех описанных выше исследований [23] показал преимущество комбинированной терапии. Так, в группе метотрексата относительный риск развития обострений был меньше, кроме того, удавалось раньше снизить дозу глюкокортикоидов. Таким образом, авторы мета-анализа делают важный практический вывод, что метотрексат может быть рекомендован в качестве дополнительной к глюкокортикоидам терапии больных АХ с рецидивирующим течением или высокой активностью васкулита, сохраняющейся, несмотря на монотерапию глюкокортикоидами.
При АХ, рефрактерном к стандартной терапии, возможна попытка применения биологических препаратов – антагониста фактора некроза опухоли α инфликсимаба. Однако имеющийся в настоящее время небольшой опыт не позволяет рекомендовать широкое использование этой терапии.
АХ имеет тенденцию к самоограничивающему течению спустя многие месяцы или годы от начала заболевания. Большинству больных со временем удается отказаться от приема глюкокортикоидов. К настоящему моменту нет данных, что артериит уменьшает продолжительность жизни. В то же время необходимо помнить, что АХ достоверно ассоциируется с повышенной частотой развития несмертельных сердечно-сосудистых и офтальмологических осложнений, что в значительной мере ухудшает качество жизни. В первую очередь это касается остроты зрения, т. к. почти каждый 6-й пациент с АХ страдает амаврозом.
К сожалению, длительный путь пациента от дебюта болезни до момента установки диагноза не является редким. Пациенты с височным артериитом могут продолжительно наблюдаться с диагнозом ЛНГ, определить причину которой удается только после развития офтальмологических нарушений, зачастую необратимых. С другой стороны, симптомы, характерные только для данного васкулита, у описанного больного появлялись постепенно, что, вне всякого сомнения, затрудняло его раннюю диагностику.
Тем не менее в случаях вовремя начатого лечения глюкокортикоидами прогноз у пациентов с данным васкулитом остается благоприятным [24]. Крайне важным с точки зрения профилактики офтальмологических нарушений является продолжение терапии глюкокортикостероидами, при их преждевременной отмене риск необратимых нарушений зрения составляет 54–95 % [25]. Однако гигантоклеточный артериит хорошо поддается терапии и не уменьшает продолжительность жизни, что позволяет надеяться на завершение иммуносупрессивной терапии через 1–2 года от начала лечения.



