Аллергические заболевания в большинстве стран мира входят в число наиболее распространенных болезней. В разных странах ими болеют от 20 до 40 % населения [1, 2]. Количество лиц, страдающих аллергией, увеличивается из года в год. Все это превратило аллергию в глобальную медико-социальную проблему. Поскольку каждый третий житель планеты страдает аллергическим ринитом (АР), а каждый десятый – бронхиальной астмой (БА) [2, 3], существует огромный разрыв между реальной и зарегистрированной заболеваемостью аллергией. В частности, по данным Минздравсоцразвития РФ, заболеваемость аллергией по обращаемости не превышает 0,5−1,0 % в зависимости от региона. При этом в России, по официальной статистике, аллергическим заболеваниям подвержены от 10 до 15 % населения (в зависимости от региона) [4–7]. В Москве число больных аллергическими заболеваниями достигает 16–17 % от всего населения города. Наиболее принципиальные выводы расширенных и углубленных эпидемиологических исследований по выявлению аллергической патологии, в т. ч. проведенных в Москве, могут быть сведены к следующему: высокие уровни распространенности и заболеваемости типичны в отношении всех основных аллергических болезней, подлежащих учету органами здравоохранения [4, 6]. Повышение распространенности аллергической патологии может быть связано с применением пищевых добавок и ухудшением экологической обстановки. Уменьшение в пищевом рационе антиоксидантов способствует снижению продукции интерферона γ, а преобладание в пище ω-6 над ω-3 жирными кислотами ведет к усилению продукции простагландина Е2, что может сдвигать иммунный ответ в сторону Th2-типа. Обеспечивая триггерный эффект, экологические факторы могут усиливать IgE-опосредованную сенсибилизацию. Предложена гипотеза дисбаланса Th1-/Th2-клеток, объясняющая рост аллергических заболеваний в городах с высоким уровнем жизни и низкими уровнями загрязнения и инфекций. Например, нарастание синтеза и уровня прогестерона в популяции способствует преобладанию Th2-типа иммунного ответа [8–11]. Для него характерна выработка интерлейкина-4 (ИЛ-4), стимулирующего cинтез IgЕ, тогда как для иммунного ответа Тh1-типа типичен синтез интерферона γ и ИЛ-2, необходимых для адекватной продукции IgG и формирования клеток иммунологической памяти. Между Тh1- и Тh2-клетками существуют реципрокные отношения, реализуемые с участием продуктов их синтеза – соответственно ИФН γ и ИЛ-4 или ИЛ-10, что определяет тип иммунного ответа [10–12].
Аллергия – состояние повышенной чувствительности животного организма по отношению к определенному веществу или веществам (аллергенам), развивающееся при повторном воздействии этих субстанций. Физиологический механизм аллергии заключается в образовании в организме антител, что приводит к понижению или повышению его чувствительности. Аллергия проявляется сильным раздражением слизистых оболочек, кожными сыпями, общим недомоганием и т. п. Под аллергическими реакциями в клинической практике понимают симптомы, в основе возникновения которых лежит иммунологический конфликт. При диагностике аллергических реакций важно выявить аллерген, его причинную связь с клиническими проявлениями и тип иммунологической реакции.
Итак, аллергия – это патологически повышенная и/или извращенная реакция организма на определенные субстанции антигенной природы, которые у нормальных индивидуумов не вызывают болезненных явлений. Важная роль в развитии аллергии отводится состоянию нервной и эндокринной систем, патологии желудочно-кишечного тракта [12, 13]. Причиной аллергии могут быть различные вещества, которые, попадая в организм, вызывают иммунный ответ гуморального или клеточного типа. Иммунно-аллергологическое обследование пациентов включает все самые современные методы диагностики: определение состояния иммунной системы; кожное тестирование с отечественными и импортными аллергенами; определение методом иммуноферментного анализа уровня специфических IgE-и IgG-антител к бытовым, эпидермальным, пищевым и пыльцевым аллергенам; фибер-глассовый метод определения уровня гистамина в крови больного с соответствующими аллергенами.
К основным аллергическим заболеваниям относятся БА, АР, аллергический конъюнктивит, поллиноз – аллергия к пыльце растений, атопический дерматит, аллергический отек, крапивница, анафилактический шок, пищевая аллергия.
Поллиноз – сезонное заболевание, причиной которого является аллергическая реакция на пыльцу растений, иногда также называемое сенной лихорадкой. Поллинозы относятся к числу самых распространенных аллергических заболеваний. В разных странах мира поллинозами страдает от 0,2 до 39 % населения. Чаще всего болеют лица в возрасте от 10 до 40 лет, среди детей до 3 лет заболевание поллинозом встречается редко, до 14 лет в 2 раза чаще заболевают мальчики, а в возрасте от 15 до 50 лет – лица женского пола [4, 10, 11, 14]. Среди горожан заболеваемость в 4–6 раз выше, чем среди сельских жителей.
Распространенность пыльцевой аллергии зависит от природно-климатических, экологических и этнографических особенностей. Из нескольких тысяч растений всего лишь 50 могут вызывать поллиноз, обычно его инициирует самая мелкая ветропереносимая пыльца, количество которой в период цветения достигает огромной величины [17]. Основным аллергеном в России является пыльца березы, ольхи, клена, ковыля, полыни, амброзии.
По данным статистики, за последние годы заболеваемость поллинозами среди детей увеличилась в 5 раз. Рост заболеваемости в детском возрасте, возможность прогрессирования болезни с развитием тяжелых форм БА, синдрома Меньера и эпилепсии указывают на важность данной проблемы. Особенно большое значение изучение поллинозов приобретает в связи с увеличивающимися масштабами озеленения городов, а также созданием больших зон лесопарков, газонов и бульваров.
Поллинозу присущи четкая сезонность и острые, рецидивирующие клинические проявления. Наиболее типичен риноконъюнктивальный синдром: слезотечение, светобоязнь, выраженная гиперемия конъюнктив, резкий зуд и отек век, ощущение “песка” в глазах в сочетании с зудом в носу и носоглотке, приступами чихания с обильным жидким прозрачным отделяемым.
Для климата центральной полосы России характерны три основных периода появления аллергии:
• весенний (апрель–май) – пора цветения березы, ольхи, дуба, орешника и др.;
• летний, или “злаковый” (июнь–июль), – тимофеевка, мятлик, пырей, овсяница, ежа, лисохвост, и др.
• поздний летний, летне-осенний (август–октябрь), связанный с цветением сложноцветных и маревых, – полынь, лебеда, амброзия.
Более тяжелым проявлением поллиноза является БА [7, 15], как правило, сочетающаяся с ринитом и конъюнктивитом. Клиническая картина пыльцевой БА типична: приступы удушья; свистящие хрипы, слышные на расстоянии; сухой кашель. В целом пыльцевая астма возникает у 20 % больных поллинозом.
К довольно редким проявлениям пыльцевой аллергии относятся крапивница, отек Квинке, а также сезонные атопические дерматиты. Крайне редкими для пыльцевой аллергии являются поражения нервной, сердечно-сосудистой, мочеполовой систем, желудочно-кишечного тракта, сочетающиеся с основными симптомами поллиноза [6, 13].
Значительное число пациентов, страдающих поллинозом, отмечают в период цветения головные боли, слабость, расстройства сна, раздражительность, плаксивость, повышенную утомляемость, иногда подъемы температуры. Аллергическое воспаление верхних дыхательных путей проявляется ринореей (выделениями из носа), чиханием, нарушением носового дыхания, зудом носа, неба, глаз, слезотечением. У больных выделяется жидкий водянистый секрет с большим количеством эозинофилов. Если в процесс вовлекаются слизистые оболочки мелких бронхов и бронхиол, могут развиваться приступы БА.
Тяжесть сезонного обострения заболевания зависит от концентрации пыльцы в воздухе, длительности пыльцевого сезона, степени индивидуальной чувствительности. Даже после снижения концентрации пыльцы в воздухе у отдельных больных долгое время наблюдаются проявления поллиноза в связи с неспецифическим реагированием на различные факторы (сильный запах, загрязнение воздуха, изменение температурного режима и др.). У части больных поллинозом отмечаются симптомы поражения внутренних органов, характеризующиеся строгой сезонностью и полной обратимостью после окончания сезона цветения [1, 15, 16].
Лечение аллергических заболеваний обязательно включает специфические методы и рациональную фармакотерапию. К специфическим методам лечения аллергических заболеваний относятся мероприятия, направленные на элиминацию аллергена; кроме того, если это возможно и есть соответствующие показания, проводят аллерген-специфическую иммунотерапию (АСИТ).
Если речь идет о пыльцевых аллергенах, осуществлять элиминационные мероприятия очень трудно. В период цветения растений свободный от пыльцы воздух может быть обеспечен специальной очисткой с помощью электростатических фильтров или кондиционирования лишь в закрытых помещениях. Если есть такая возможность, то в случае повышенной чувствительности к пыльце деревьев пациенту рекомендуют на время цветения поменять климатическую зону на более южные области, а в случае сенсибилизации к пыльце сорных трав – переезд в северные регионы. Чтобы уменьшить контакт с пыльцой растений, следует не выезжать в загородную зону, закрывать окна на ночь, не выходить из дому в ранние утренние часы, на которые приходится максимальная концентрация пыльцы в воздухе.
В настоящее время в распоряжении врачей имеется несколько групп противоаллергических лекарственных препаратов, которыми можно эффективно контролировать симптомы поллиноза.
Особую роль среди них играют антагонисты Н1-гистаминовых рецепторов, а также препараты, подавляющие воспаление, в первую очередь глюкокортикостероиды (ГКС) и препараты кромоглициевой кислоты.
Традиционно при АР проводится базисная терапия (антигистаминные препараты, назальные кортикостероиды), направленная на подавление аллергического процесса в шоковом органе и санацию очагов инфекции рото- и носоглотки. Перспективны методы иммунотерапии, влияющие на Th1-, Th2-дисбаланс. Патогенетическим методом лечения является АСИТ, эффективность которой может достигать 80–90 % и более [19]. АСИТ необходимо проводить в течение нескольких лет, соблюдая строгий протокол лечения. Метод применяется с 1911 г. и был предложен Noon и Freeman как способ лечения сенной лихорадки. Механизм действия АСИТ связан с переключением синтеза IgE-специфических антител, вырабатываемых после введения аллергена, на синтез блокирующих IgG-антител, при этом происходит переключение иммунного ответа с Th2- на Th1-клетки, торможение как ранней, так и поздней фазы IgE-опосредованной аллергической реакции, угнетение развития воспаления и неспецифической тканевой гиперреактивности [16, 19]. Проведение АСИТ часто невозможно пациентам с очагами инфекции, живущим в отдаленных районах или имеющим другие противопоказания (тяжелый иммунодефицит; онкологические заболевания; тяжелые психические расстройства; необходимость назначения β-адреноблокаторов, включая топические формы; тяжелая форма БА, неконтролируемая фармакотерапией, – объем форсированного выдоха менее 70 % после проведения адекватной фармакотерапии, сердечно-сосудистые заболевания с риском осложнений при назначении препаратов адреналина, дети в возрасте до 5 лет).
Несмотря на многообразие методов лечения, не всегда удается достигать стойкого клинического эффекта, что усугубляется сложностью патогенеза поллиноза, в частности АР. Необходимость комплексной терапии АР подтверждена многочисленными клиническими, функциональными и морфологическими исследованиями [16, 17, 19].
В последние годы широко применяется элиминационная терапия: изменение места жительства в период цветения, применение воздухоочистителей, пылесосов, синтетических наполнителей для подушек и одеял (синтепон, холофайбер). Применение солевых растворов для орошения и элиминации аллергенов со слизистой оболочки (Аква Марис, Физиомер и др.) в комплексной терапии уменьшает тяжесть клинических проявлений поллиноза [18].
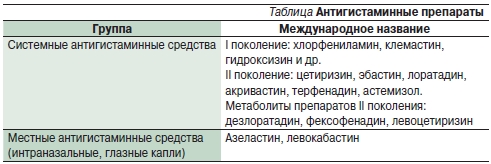
Важнейшее место в лечении поллиноза занимают антигистаминные препараты – блокаторы H1-рецепторов. Антигистаминные средства I поколения обеспечивают блокаду Н1-рецепторов в течение 4–12 часов, препараты II поколения – 12–24 часов. В результате гистамин не может взаимодействовать с Н1-рецепторами, что препятствует развитию симптомов аллергической реакции немедленного типа (зуд, заложенность носа, чихание, ринорея, бронхоспазм, спазм гладкой мускулатуры). Переносимость Н1-блокаторов I поколения вариабельна, выражен эффект седации, возможно развитие тахифилаксии. Противопоказаниями к назначению антигистаминных препаратов I поколения являются гипертрофия предстательной железы, задержка мочи, глаукома, заболевания печени, эпилепсия, порфирия (хлорфенирамин). Побочные эффекты: сонливость (при назначении высоких доз может развиваться возбуждение), головная боль, слабость, атропиноподобные эффекты (задержка мочи, сухость во рту, нарушения зрения, функций желудочно-кишечного тракта и печени), гипотензия, кожные высыпания, фотосенсибилизация, экстрапирамидные расстройства, спутанность сознания, депрессия, расстройство сна, тремор, судороги, потливость, миалгия, парестезии, нарушение кроветворения. Некоторые препараты вызывают нарушение сердечного ритма, в частности желудочковую аритмию, удлинение интервала QT при увеличении концентрации в плазме крови. Их концентрация в плазме может повышаться при одновременном приеме антибиотиков (эритромицин) и противогрибковых препаратов (кетоконазол) [19, 20]. Препараты II поколения плохо проникают через гематоэнцефалический барьер, практически не обладают седативным и холинлитическим действиями, не вызывают тахифилаксии, характеризуются более длительным периодом полувыведения (12–24 часов), что позволяет уменьшать дозу и кратность приема. Антигистаминные средства I поколения не рекомендованы к лечению АР, исключение составляет клемастин [18].
К числу метаболитов антигистаминных препаратов II поколения относятся дезлоратадин, фексофенадин, левоцетиризин. Одним из эффективных лекарственных средств данной группы является дезлоратодин (Эриус) – селективный блокатор периферических Н1-гистаминовых рецепторов. Дезлоратадин – это активный первичный метаболит лоратадина. Препарат не проникает через гематоэнцефалический барьер и не вызывает седативного действия; показано, что при его приеме в рекомендуемой дозе (5 мг/сут) частота возникновения сонливости не отличается от таковой в группе плацебо. В исследованиях доклинической фазы не было выявлено количественных или качественных различий между лоратадином и дезлоратадином в отношении токсичности. По данным многочисленных исследований, дезлоратадин (Эриус) обладает противовоспалительным и противоаллергическим действиями.
Установлено, что он подавляет каскад разнообразных реакций, являющихся основой воспаления аллергического характера:
• выработку провоспалительных цитокинов (ИЛ-4, ИЛ-8, ИЛ-6, ИЛ-13);
• выделение RANTES и других провоспалительных хемокинов;
• хемотаксис и адгезию эозинофильных гранулоцитов;
• IgE-зависимое выделение простагландина D2, гистамина и лейкотриена С4;
• образование супероксидного аниона полиморфно-ядерными нейтрофильными гранулоцитами (активированными);
• экспрессию Р-селектина и других молекул адгезии;
• острый бронхоспазм атопического характера в экспериментах на животных.
Клинические исследования показали, что ежедневный прием Эриуса в дозировке 20 мг на протяжении 2 недель не сопровождается статистически достоверными и клинически значимыми нарушениями функций сердечно-сосудистой системы. Не обнаружено также удлинения интервала Q–T при применении в течение 10 дней дозы дезлоратадин (45 мг/сут), в 9 раз превышающей среднетерапевтическую (5 мг/сут). Кроме того, исследования показали, что прием препарата в дозе 7,5 мг/сут не вызывает изменений психодвигательных реакций [20, 21].
Через 30 минут после приема внутрь дезлоратадин начинает определяться в плазме крови. Максимальная концентрация препарата в плазме крови достигается уже через 3 часа. Период полувыведения в среднем составляет 27 часов. Клинически значимой кумуляции дезлоратадина при приеме дозировки 5–20 мг однократно в сутки в течение 1-й недели не выявлено. Биодоступность Эриуса пропорциональна введенной дозе (в диапазоне 5–20 мг). С протеинами плазмы крови связывается 83–87 % дезлоратадина.
Проведенные сравнительные перекрестные исследования доказали биоэквивалентность лекарственных форм дезлоратадина в виде сиропа и таблеток. Дезлоратадин не является ни ингибитором, ни субстратом Р-гликопротеида и не подавляет систему цитохрома Р450 (CYP 2D6 или CYP 3A4). На распределение дезлоратадина (при однократном применении дозировки 7,5 мг) в отличие от других антигистаминных средств не влияет одновременный прием грейпфрутового сока или жирной пищи [19–22].
Топические ГКС (беклометазон, будесонид, флунизолид, флютиказон, мометазон) являются наиболее эффективными препаратами контроля местных симптомов при поллинозах, особенно при выраженном АР и пыльцевой БА. В рамках действующей с 2001 г. программы ВОЗ ARIA [23] интраназальные ГКС-аэрозоли позиционируются в качестве средств первого выбора при среднетяжелом и тяжелом течении круглогодичного (персистирующего) АР и средств второй линии (после антигистаминных препаратов) при сезонной (интермиттирующей) форме ринита. Находящийся пока в стадии разработки международный согласительный документ по лечению полипозного риносинусита также рекомендует топическую и системную ГКС-терапию как средство первого выбора лечения этого заболевания.
Безусловно ГКС не излечивают полностью ни ринит, ни полипозный риносинусит. В то же время правильно подобранная ГКС-терапия в подавляющем большинстве случаев способна практически полностью купировать симптомы АР и существенно отсрочить сроки рецидива носовых полипов. Интраназальные ГКС – единственные препараты, эффективность которых при полипозном риносинусите подтверждена на доказательном уровне [24].
Регулярное профилактическое использование топических ГКС взрослыми и детьми, страдающими поллинозом, эффективно уменьшает заложенность носа, ринорею, чихание и зуд, предотвращает развитие приступов удушья. Топические ГКС уменьшают назальную и бронхиальную гиперреактивность, активно ослабляют воспаление слизистой оболочки; эффект проявляется через 6–12 часов и достигает максимума через несколько дней. Кроме того, использование топических ГКС позволяет снизить их курсовую дозу.
Известно, что ГКС осуществляют свое действие на клетки посредством активации рецептора, который в свою очередь прямым или непрямым способом регулирует в ДНК транскрипцию определенных генов-мишеней. Гены, являющиеся мишенями ГКС-воздействия, ответственны за синтез белковых молекул, участвующих во всех звеньях воспалительного процесса. Возвращаясь от фундаментальных основ фармакотерапии к практике лечения воспалительных заболеваний носа и околоносовых пазух, можно с уверенностью заключить, что ГКС воздействуют практически на все этапы патогенеза АР и полипозного риносинусита. Многие исследования убедительно свидетельствуют, что ГКС тормозят синтез ряда цитокинов, в частности ИЛ-1, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-13, фактора некроза опухоли α и гранулоцитарно-макрофагальный колониестимулирующий фактор. Кроме того, они уменьшают индукцию синтетазы оксида азота, активация которой приводит к избыточному образованию NO, оказывающего выраженное провоспалительное действие. ГКС снижают активность генов, кодирующих синтез ферментов и других обладающих провоспалительным действием белковых молекул (циклооксигеназы, фосфолипазы А2 и эндотелина-1), тормозят экспрессию молекул адгезии ICAM-1 и Е-селектина [6, 24, 25].
На клеточном уровне противовоспалительное и десенсибилизирующее действие ГКС осуществляется следующими путями:
• уменьшение количества тучных клеток и базофилов, а также выделяемых ими медиаторов в эпителии дыхательных путей;
• выраженное снижение количества эозинофилов и их продуктов в эпителии и собственном слое слизистой оболочки; ГКС могут также воздействовать на процесс апоптоза, уменьшая срок жизни эозинофилов;
• уменьшение числа клеток Лангерганса, а также ингибирование процессов захвата и транспортировки антигенов этими клетками;
• снижение количества Т-клеток в эпителии и воздействие на их функции;
• уменьшение продукции лейкотриенов в слизистой оболочке;
• ингибирование продукции IgE, в частности, при аллергии к пыльце растений.
Введение ГКС уменьшает секрецию желез слизистой оболочки дыхательных путей, экстравазацию плазмы и тканевой отек. Они также снижают чувствительность рецепторов слизистой оболочки носа к гистамину и механическим раздражителям, т. е. в определенной степени воздействуют и на неспецифическую назальную гиперреактивность. ГКС не действуют на нейтрофилы и макрофаги, не изменяя, таким образом, иммунный ответ организма на бактериальную инфекцию [25].
Подчеркивается, что правильный выбор средств профилактики и лечения поллиноза позволяет предупреждать его проявление или существенно снижать их выраженность, что значительно улучшает качество жизни людей, страдающих этим заболеванием.


