После открытия роли инфекции Helicobacter pylori в качестве этиологического фактора хронического гастрита и язвенной болезни возобладала точка зрения, будто данные заболевания можно излечить весьма простым способом – применением антихеликобактерной (т. н. эрадикационной) терапии (АХТ). Однако два с лишним десятилетия практического применения АХТ и сотни проведенных клинических исследований однозначно говорят об отсутствии гарантированного успеха вне зависимости от выбранной схемы терапии.
Интерес ученых к проблеме недостаточной эффективности эрадикационных схем подчеркивается колоссальным числом публикаций, включившим более 100 мета-анализов контролируемых исследований, посвященных различным аспектам АХТ (см. таблицу).
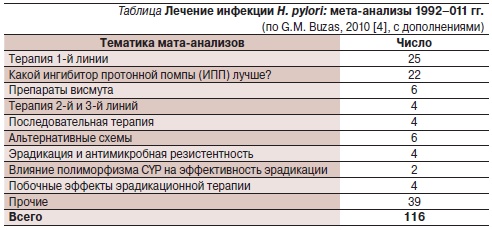
Как следует из таблицы, наибольшее число мета-анализов посвящено схемам 1-й линии, традиционно включающим ИПП, кларитромицин и амоксициллин (или метронидазол). Интерес ученых вполне оправдан, т. к. за последние годы эффективность тройной терапии 1-й линии прогрессивно снижается [17], давно уже “недотягивая” до рекомендованного известным Маастрихтским соглашением (Маастрихт-III, 2005) 80 %-ного уровня [20]. В рекомендациях Американского колледжа гастроэнтерологии, опубликованных вскоре после появления соглашения Маастрихт-III и допускающих применение тройной терапии 1-й линии, отмечено, что эффективность эрадикации при этом колеблется в пределах 70–85 % [6]. Подобная ситуация прослеживается и в Италии, где национальные рекомендации рабочей группы Cervia-II подчеркивают, что эффективность стандартных эрадикационных схем “очень сильно снизилась”, но, несмотря на это, тройные схемы терапии остались в качестве схем 1-й линии [5]. Аналогичным образом в не так давно опубликованном проекте рекомендаций Управления по контролю качества пищевых продуктов и лекарственных средств США (Food and Drug Administation (FDA) [18] “H. pylori – ассоциированная язвенная болезнь двенадцатиперстной кишки у взрослых: разработка схем лечения” также отмечена необходимость применения стандартной терапии 1-й линии.
Как практикующему врачу найти правильный ответ в сложной ситуации, когда даже ведущие мировые эксперты разошлись во мнениях, говоря, что, с одной стороны, “имеются очевидные доказательства неприемлемо низкой эффективности схем АХТ 1-й линии” [17], а с другой – что “стандартная тройная терапия 1-й линии остается терапией выбора во всем мире” [21]? Чтобы разобраться в этой непростой ситуации, необходимо найти ответы на ряд важнейших вопросов: почему снижается эффективность стандартных схем 1-й линии, почему эти схемы до сих рекомендуются (и, видимо, будут рекомендоваться согласно неопубликованному пока решению экспертов Маастрихт-IV), что мы можем дать взамен?
Очевидно, что главной причиной снижения эффективности стандартной эрадикационной терапии 1-й линии является растущая резистентность к базовым антихеликобактерным средствам – метронидазолу и кларитромицину [17, 22], поскольку проведенный еще в 2002 г. мета-анализ показал, что снижение эффективности тройных схем эрадикации с кларитромицином обратно коррелирует с ростом резистентности к этому антибиотику [10]. Кроме того, в последующем систематическом обзоре (2007) показано, что эффективность эрадикации 80 % и выше не достигалась в большей части исследований, проведенных в странах Южной и Центральной Европы (Франция, Италия, Испания и Турция), где отмечается высокая частота резистентности (примерно 18,5 %) к кларитромицину (рис. 1) [15]. Более чем полувековой опыт широкого применения антибактериальных средств свидетельствует, что эти препараты часто применялись неоправданно (например, при вирусных инфекциях), отчасти объясняя неуклонный рост антибактериальной резистентности, в т. ч. и у широко распространенной в популяции бактерии H. pylori.
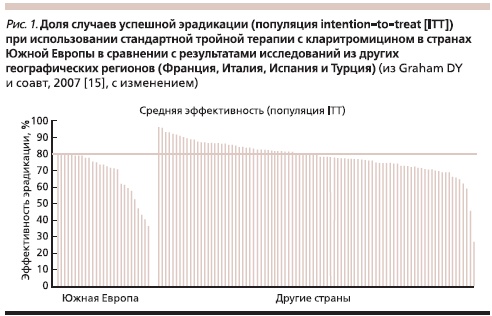
Исходя из приведенных данных, кажется парадоксальным продолжение столь широкого применения тройной схемы АХТ с кларитромицином. За 3 года после опубликования результатов Маастрихт-III (2007–2009) стали доступными результаты более 40 исследований, посвященных эрадикационной терапии 1-й линии, в которых свыше 60 % включенных пациентов получали стандартную тройную терапию с кларитромицином. Анализ данных литературы (более 100 исследований, мета-анализов и систематических обзоров) за период с 1997 по 2009 г. подтвердил, что показатель эффективности стандартной терапии 1-й линии с кларитромицином только в 18 % случаев превышал 85 % и примерно в 60 % случаев не достигал 80 % [17].
Возникает вопрос: почему указанный парадокс имеет место? Безусловно Маастрихт-III не рекомендует применять кларитромицин, если порог резистентности H. pylori к этому антибиотику достигает 15–20 %. Мало кому известно, что данный тезис устраивал не только участников конгресса, но и компании – производители препаратов для тройной терапии, особенно выпускавшие комбинированные препараты для эрадикации (т. н. 3 в 1). В то же время это положение соглашения Маастрихт-III практически малопригодно не только для врачей России, но и для большинства практикующих врачей западных стран в связи с отсутствием общедоступной информации о частоте антибактериальной резистентности в различных регионах [20].
Причины такого несоответствия могут быть следующими:
- В отдельных странах стандартная тройная терапия является единственной, официально разрешенной к применению в 1-й линии; не во всех странах препараты висмута разрешены к применению в качестве компонентов эрадикационных схем.
- Стандартизация подхода к лечению инфекции H. pylori облегчает работу практикующих врачей (не нужно “держать в голове” различные комбинации).
- Применение трех-, а не четырехкомпонентных схем с унифицированным приемом лекарств 2 раза в день упрощает режим лечения пациента, что может влиять на комплаентность, а следовательно, и на эффективность терапии.
- Важность использования кларитромицина в схемах эрадикационной терапии с учетом его специфического действия на биопленки и позитивного межлекарственного взаимодействия с ИПП (за счет общего метаболизма через CYP3A4 отмечается повышение площади под кривой “концентрация–время” для эзомепразола) [3], что ведет к усилению антисекреторного эффекта ИПП и как следствие – к повышению эффекта АХТ.
- Влияние фармацевтических компаний, которые производят препараты для тройной терапии, особенно комбинированные (3 в 1), и являются спонсорами консенсусных конференций (что делать с налаженным производством комбинированных и удобных для больного препаратов 1-й линии, если такая терапия вдруг станет неактуальной?).
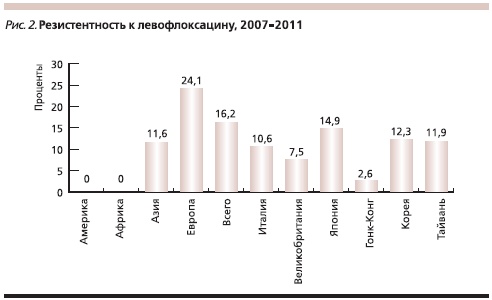
- Способность H. pylori приобретать резистентность и к новым, все чаще назначаемым препаратам резерва (левофлоксацин; рис. 2 [7]) в некоторой степени “охлаждает пыл” сторонников использования альтернативных схем в качестве терапии 1-й линии. Поэтому в большинстве регионов мира представители группы фторхинолонов не являются препаратом выбора для проведения эмпирической терапии [13]. С другой стороны, необходимо сохранение резерва антибактериальных препаратов в случае неэффективности схем 1-й и 2-й линий либо при невозможности их применения.
Почему же отсутствуют схемы терапии, гарантирующие 100 %-ную эрадикацию?
Это может быть обусловлено следующими обстоятельствами:
- особенностями микроорганизма (антимикробная резистентность, формирование микст-штаммов);
- недостаточной концентрацией антибактериального препарата в желудке (выраженная гиперацидность, быстрый метаболизм ИПП, использование ИПП старых генераций и др.);
- вариабельностью индивидуального ответа организма-хозяина на проводимое лечение [1];
- реинфицированием в результате орально-оральной передачи инфекции, что требует проведения внутрисемейной профилактики инфекции;
- комбинацией вышеуказанных факторов.
Биологические особенности инфекции H. pylori уникальны, что отражается и в способности бактерии приобретать антимикробную резистентность. Масса бактерий в желудке человека, длительный период персистирования инфекции приводят к формированию субпопуляций, пусть и весьма малочисленных, резистентных к различным антибиотикам [14]. Например, если спонтанная частота мутаций, приводящих к определенному типу резистентности, составляет 1 на 10 млн и при этом наличествуют 50 млн микроорганизмов, весьма вероятно присутствие небольшой популяции с такого рода резистентностью. При использовании только одного препарата небольшая устойчивая к нему популяция бактерий может выжить и реколонизировать желудок. К числу методов, позволяющих решать эту проблему, относятся увеличение дозы и длительности применения некоторых препаратов, одновременное использование нескольких антибиотиков (один из которых скорее всего уничтожит резистентный штамм) либо предварительная терапия лекарственными средствами, значительно снижающими колонизационную плотность (например, ИПП или препаратами висмута), что делает выживание мелких резистентных популяций менее вероятным, хотя значимой доказательной базы состоятельности такой тактики пока нет [17].
В настоящее время установлено, что резистентность H. pylori к препаратам висмута не встречается [19], а к амоксициллину, фуразолидону и тетрациклину в большинстве регионов регистрируется крайне редко [23]. С учетом того, что в России препараты висмута и фуразолидон зарегистрированы, до сих пор нет качественного тетрациклина, а антимикробная резистентность H. pylori практически не изучена, наиболее перспективными средствами АХТ представляются именно препараты висмута, амоксициллин и фуразолидон, возможно в комбинации с кларитромицином в схемах последовательной терапии, о чем будет сказано ниже. Однако регламентировать такой подход могут только решения национальных консенсусов.
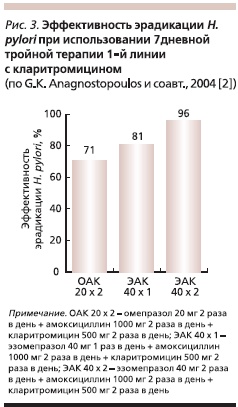
Внутренняя среда желудка определенно влияет на успешность эрадикации H. pylori, т. к. бактерии находятся в нереплицирующемся, но жизнеспособном состоянии (т. е. становятся фенотипически резистентными), когда уровень ее pH составляет от 3 до 6 [25]. Повышение pH выше 6 дает бактериям возможность перейти в репликативное состояние, когда они становятся чувствительными к амоксициллину и кларитромицину. При тех же значениях рН отмечается наибольшая устойчивость (максимальный период полураспада) указанных антибиотиков [8]. Эти факты стали теоретическим обоснованием разработки схем эрадикации с использованием двойных доз ИПП (2 или 4 раза в день) и/или схем с использованием наиболее эффективных стереоизомеров ИПП (эзомепразол 20 и 40 мг 2 раза в день) [2, 16]. Так, при использовании двойной схемы – амоксициллина в сочетании с ИПП 4 раза в день – эффективность эрадикации H. pylori была на 27 % выше, чем при использовании ИПП 2 раза в день (!) [16]. Нельзя не отметить результаты одного из первых контролируемых исследований по сравнительной оценке применения омепразола и эзомепразола в схемах эрадикационной терапии 1-й линии [2], проведенной в Греции. Авторами отмечено, что, во-первых, возможно применение эзомепразола в дозе 40 мг 1 раз в день, а во вторых, такой режим на 10 % эффективнее схем с омепразолом в дозе 20 мг 2 раза в день. Кроме того, удалось доказать, что применение эзомепразола по 40 мг 2 раза в день на 25 % эффективнее схем с омепразолом и на 15 % – схемы со стандартной дозой эзомепразола (рис. 3).
В другом исследовании, проведенном в Гонконге и Тайване, показано, что использование эзомепразола по 40 мг 2 раза в день на 7–9 % увеличивает эффективность эрадикации [26]. Это указывает на преимущество схемы с эзомепразолом, но не столь выраженное, как в предшествующей европейской работе. Причина этого кроется в генетическом полиморфизме гена CYP2C19, который, как известно, в существенной степени определяет эффективность ИПП. Авторы, зная, что быстрых метаболайзеров ИПП (отсутствие мутаций гена CYP2C19) в азиатской популяции всего 25–30 % против 90–98 % в Европе, провели пациентам генетическое исследование. Оказалось, что у быстрых метаболайзеров применение двойных доз эзомепразола позволяет преодолевать генетический полиморфизм гена CYP2C19, что дало в этой субпопуляции те же 16,0 (анализ ITT) и 17,3 % (анализ по протоколу) прироста эффективности при использовании эзомепразола. Результаты рассмотренных выше рандомизированных исследований подтверждаются крайне показательно, особенно когда есть подтверждение данными мета-анализов, свидетельствующими, что двойные дозы ИПП обеспечивают в среднем 8 %-ное повышение эффективности эрадикации [28, 29], а стереоизомеры в стандартных дозах (эзомепразол [Нексиум] 20 мг 2 раза в день) – минимум 5 %-ное в сравнении с ИПП первых генераций [30]. Для нас крайне интересны результаты последнего мета-анализа [29], в котором двойные дозы ИПП достоверно повышали эффективность стандартной тройной терапии 1-й линии с кларитромицином (5 исследований) и тинидазолом (1 исследование; рис. 4). Таким образом, более мощное антисекреторное действие стереоизомеров (эзомепразол) и/или двойных доз ИПП определяет значимое повышение эффективности схем эрадикационной терапии 1-й линии за счет повышения устойчивости кларитромицина и амоксициллина в желудочной среде. В эксперименте показано, что добиться 100 %-ной эрадикации инфекции H. pylori возможно только в случае, когда среднесуточный уровень рН в желудке достигает 6,4 (5,0–7,6), что достоверно выше среднего рН в желудке у лиц с неэффективным лечением – 5,2 (2,2– 6,2; p = 0,0131) [27]. Если вспомнить рекомендации Маастрихт-III, когда весомым аргументом в пользу увеличения длительности лечения в 2 раза (до 14 дней) был факт повышения эффективности всего на 12 %, повышение эффективности 7-дневных схем за счет использования стереоизомеров ИПП (Нексиум) и/или увеличения доз ИПП в 2 раза можно считать гораздо более перспективным. Это обусловлено существенно меньшей токсичностью и лучшей переносимостью 7-дневных схем АХТ, что определяет повышение комплаентности и фармакоэкономическую выгоду.
Рисунок 4. Результаты мета-анализа (6 исследований, 1703 больных), эффективность эрадикации H. pylori при использовании 7 дневной тройной 1-й линии (из A. Villoria и соавт., 2008 [29]).
Очевидно, что рутинная терапия двойными дозами ИПП в широкой практике возможна в России только после появления соответствующих национальных рекомендаций. В то же время использование более эффективного эзомепразола, дающего 5–10 %-ный прирост эффективности эрадикации в схемах 1-й линии с кларитромицином, не требует никаких дополнительных согласительных документов. Применив этот препарат, мы можем преодолеть вариабельность фенотипа CYP2C19 у наших больных, т. е. добиться прогнозируемого антисекреторного, а следовательно, и антихеликобактерного эффекта у подавляющего большинства пациентов.
Новым путем преодоления резистентности к кларитромицину и повышения эффективности АХТ является последовательная 10-дневная схема – классическая или модифицированная. Классическая схема последовательной терапии разработана в Италии менее 5 лет назад и включает применение ИПП и амоксициллина в первые 5 дней и ИПП, кларитромицина и нитроимидазола (метронидазол или тинидазол) в последующие 5 дней [31] в дозах, используемых при терапии 1-й линии.
В подавляющем большинстве опубликованных контролируемых исследований доказаны преимущества последовательной терапии над параллельными схемами 1-й и 2-й линий [12]. Классическая последовательная терапия со стандартными дозами Нексиума позволяет добиваться 94,4 %-ной эрадикации, т. е. на 18,7 % более высокой, чем при стандартной тройной терапии [24].
Причины большей эффективности последовательных схем кроются в следующем [9, 17, 21]:
- в популяции преобладают микст-штаммы H. pylori;
- в течение первых 5 дней уничтожаются резистентные к кларитромицину штаммы;
- даже в регионе с высокой резистентностью к кларитромицину у большинства пациентов имеются штаммы, чувствительные к данному антибиотику;
- в течение последующих 5 дней уничтожаются прочие штаммы, в т. ч. с учетом действия кларитромицина на биопленки.
Указанные положения подтверждаются сопоставимой эффективностью 5-дневных квадросхем с использованием трех антибиотиков (параллельное назначение ИПП, амоксициллина, метронидазола и кларитромицина – т. н. не содержащая висмута квадротерапия).
Очевидные преимущества последовательных схем пока не привели к их широкому применению в рутинной клинической практике; это определяется следующим:
- недостаточным количеством многоцентровых рандомизированных исследований из разных регионов мира; исследований по оценке последовательной и тройной терапии 1-й линии, а также последовательной и квадротерапии 1-й линии;
- необходимостью наличия терапии резерва (каковой последовательная терапия сегодня и является), что, вероятно, будет отмечено в согласительном документе Маастрихта-IV.
Таким образом, тройная АХТ 1-й линии, несмотря на снижение ее эффективности в связи с растущей резистентностью к кларитромицину и метронидазолу, остается терапией выбора для первичного лечения больных, инфицированных H. pylori. Путем повышения эффективности 7-дневных схем 1-й линии с кларитромицином является применение современных и более эффективных ИПП (эзомепразола), обеспечивающих 5– 10 %-ное увеличение эффективности в сравнении с ИПП первых генераций. Увеличение длительности терапии 1-й линии до 10–14 дней, согласно результатам мета-анализа контролируемых исследований, менее оправданно, т. к. дает всего 3–5 %-ный прирост эффективности [11]. В качестве терапии резерва могут быть использованы последовательная (стандартная или модифицированная) терапия, схемы с препаратами висмута и фуразолидоном, если это будет регламентировано национальными рекомендациями. Единственным ИПП, имеющим с позиций доказательной медицины преимущество перед другими ИПП в схемах эрадикационной терапии, является эзомепразол (Нексиум).
Информация об авторах:
Маев Игорь Вениаминович – доктор медицинских наук, профессор, заведующий кафедрой
пропедевтики внутренних болезней и гастроэнтерологии ГОУ ВПО МГМСУ Минздравсоцразвития РФ.
E-mail: proped@mail.ru;
Кучерявый Юрий Александрович – кандидат медицинских наук, доцент кафедры пропедевтики
внутренних болезней и гастроэнтерологии ГОУ ВПО МГМСУ Минздравсоцразвития РФ;
Оганесян Татьяна Сергеевна – кандидат медицинских наук, ассистент кафедры пропедевтики
внутренних болезней и гастроэнтерологии ГОУ ВПО МГМСУ Минздравсоцразвития РФ;
Баркалова Елена Вячеславовна – старший лаборант кафедры пропедевтики внутренних
болезней и гастроэнтерологии ГОУ ВПО МГМСУ Минздравсоцразвития РФ


