Артериальная гипертензия (АГ) давно перешагнула рамки чисто медицинской проблемы. Широкая распространенность и тяжелые последствия этого заболевания сделали его проблемой социальной. В России, как и в большинстве экономически развитых стран, АГ – одно из наиболее часто встречаемых сердечно-сосудистых заболеваний (ССЗ). По данным проведенного в 2008 г. исследования [1], распространенность АГ среди населения РФ составляла 40,8 %. В арсенале современной медицины находится масса мощных антигипертензивных препаратов, способных значительно увеличить продолжительность жизни пациентов и улучшить ее качество. Но, несмотря на это, как показали международные эпидемиологические исследования[2], целевой уровень артериального давления (АД) в реальной практике достигается не более чем в 40–60 % случаев. Причина неадекватного контроля АД не столько в недостаточной эффективности препаратов, сколько в низкой приверженности больных лечению. В России антигипертензивные препараты принимают чуть больше двух третей больных АГ – 69,5 %[1]. Из них эффективно лечатся только 27,3 % [1]. Отчасти в низкой приверженности “виновны” особенности, присущие самой АГ. Большинство больных АГ не имеют клинической симптоматики, поэтому лишь 40–50 % из них действительно начинают чувствовать себя лучше на фоне проводимого лечения [3]. У многих больных самочувствие даже ухудшается за счет слишком быстрого снижения АД либо побочных эффектов лекарств. Следовательно, принимаемые препараты должны помимо высокой антигипертензивной эффективности иметь хорошую переносимость и удобную схему приема. С другой стороны, в нашей стране на первое место среди факторов, влияющих на соблюдение рекомендаций врача, часто выходит “отсутствие средств”, а среди влияющих на выбор конкретного препарата – его стоимость и наличие в списке ДЛО (дополнительного лекарственного обеспечения) [4]. Поэтому при проведении фармакотерапии врачу приходится решать проблему выбора препарата, основываясь на данных не только о его клинической эффективности, но и о его реальной стоимости. Многие генерические препараты имеют сопоставимую с оригиналом терапевтическую активность и спектр побочных эффектов, но при этом существенно дешевле, т. к. их создание сопряжено со значительно меньшими издержками.
Одним из удачных препаратов-генериков является генерик фелодипина Фелодип (TEVA), состоящий в списке ДЛО и широко используемый врачами первичного звена в амбулаторной практике. Нами было выполнено исследование, целью которого являлась не только оценка клинической эффективности препарата у больных с АГ, но и анализ факторов, влияющих на приверженность терапии в условиях реальной амбулаторной практики.
Материал и методы
Открытое наблюдение проводили в 84 районных поликлиниках Москвы. В проведении исследования участвовали 185 врачей-кардиологов. В исследование были включены 5474 пациента с АГ, мужчины и женщины старше 18 лет с исходным уровнем офисного систолического АД (САД) 140–179 мм рт. ст. и диастолического АД (ДАД) 99–100 мм рт. ст., на фоне антигипертензивной терапии или без нее. Обязательным условием являлось отсутствие регулярной терапии антагонистами кальция (АК) в течение минимум двух недель до включения в исследование. В соответствии с критериями ESH/ESC [5] все больные имели высокий или очень высокий риск сердечно-сосудистых осложнений. Критериями исключения были симптоматическая АГ, инфаркт миокарда или инсульт, перенесенный менее 3 месяцев назад, декомпенсированная сердечная недостаточность, декомпенсированный или требующий назначения инсулина сахарный диабет (СД), выраженные нарушения функции печени и почек, непереносимость АК в анамнезе, аортальный стеноз, для женщин – беременность и лактация.
Всем включенным в исследование пациентам кроме общего клинического обследования измеряли АД в кабинете врача (офисное АД), рассчитывали индекс массы тела (ИМТ). Проводилась оценка анамнеза, факторов риска, сопутствующей терапии. Качество жизни определялось по визуально-аналоговой шкале (ВАШ). Приверженность пациента медикаментозной терапии оценивалась по тесту Мориски–Грина [6].
Комплаентными считались больные, ответившие на данные вопросы “нет” более 3 раз (набравшие более 3 баллов):
- Забывали ли Вы когда-либо принять препараты? (нет/да).
- Не относитесь ли Вы иногда невнимательно к часам приема лекарств? (нет/да).
- Не пропускаете ли Вы прием препаратов, если чувствуете себя хорошо? (нет/да).
- Если Вы чувствуете себя плохо после приема лекарств, не пропускаете ли Вы следующий прием? (нет/да).
Дизайн исследования
По результатам теста Мориски– Грина на первом визите пациенты были разделены на две группы: первая – с низкой приверженностью лечению (НПЛ), вторая – с высокой приверженностью лечению (ВПЛ).
Фелодипин назначался в дозе 5–10 мг 1 раз в день. Коррекция дозы в обеих группах при необходимости проводилась на 4-й неделе исследования. Базовая терапия оставалась неизменной. На заключительный визит (через 8 недель) больной вновь приглашался в поликлинику. Определялся процент больных, достигших целевого уровня АД (офисное АД – меньше 140/90 мм рт. ст.), процент больных, у которых отмечено снижение ДАД более чем на 10 мм рт. ст. и САД более чем на 20 мм рт. ст. от исходного уровня. Оценивались переносимость препарата (хорошая/плохая), качество жизни по результатам визуально-аналоговой шкалы (исходная и конечная точки). Определялся процент больных, отметивших различные побочные эффекты.
Статистический анализ проводился с помощью пакета программ SAS (версия 6.12). При анализе рассчитывали средние величины (М), их стандартные ошибки (m). Достоверность различий средних величин оценивали по критерию Стьюдента (t). Использовались программы параметрического и непараметрического анализа. Результаты считали достоверными при p < 0,05. Данные представлены в виде M ± m. Для изучения приверженности использовалась модель логистического регресса, приведены шансы с 95 % доверительным интервалом (ДИ) для ряда информативных для приверженности переменных.
Результаты и обсуждение
Характеристика групп
Анализу подверглось 4816 карт пациентов, полностью завершивших исследование (табл.1).
Таблица 1. Характеристика групп пациентов.
Группы не различались по возрасту, длительности АГ, наследственной отягощенности, ИМТ и степени физической активности. В группе НПЛ уровни САД и ДАД исходно были достоверно выше, чем в группе ВПЛ. Отмечено, что в группе НПЛ реже встречались ассоциированные заболевания. Пациенты этой группы чаще получали препараты по системе ДЛО (р = 0,001). При этом они реже принимали такие препараты, как АК, блокаторы рецепторов ангиотензина (БРА), ингибиторы ангиотензин-превращающего фермента (ИАПФ), аспирин, нитраты, антиаритмические средства. Средняя длительность АГ по группам не различалась, но доля больных с впервые выявленной АГ выше в группе НЛП. Средняя суточная доза фелодипина в группах на 4-й неделе его приема составила в первой группе 6,9 мг/сут, во второй – 6,7 мг/сут. На 8-й неделе приема дозы достоверно не различались.
Динамика АД
На фоне лечения через 4 и 8 недель в обеих группах наблюдалось достоверное снижение уровня и САД, и ДАД. Уровень САД снизился в среднем на 31 мм рт. ст., ДАД – на 15 мм рт. ст. (р < 0,0001). Динамика среднего офисного АД представлена на рис. 1 и 2.
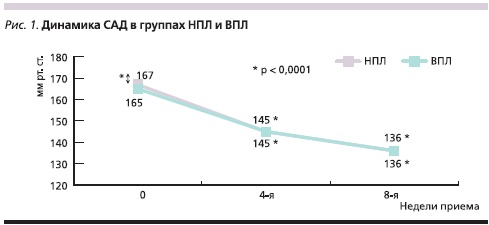

Целевого уровня АД к концу исследования достигли 50,6 % пациентов группы НПЛ и 47,7 % пациентов группы ВПЛ. САД < 140 мм рт. ст. или снижение на 20 мм рт. ст. и более, а также ДАД < 90 мм рт. ст. или снижение на 10 мм рт. ст. и более были достигнуты у 98,8 % пациентов группы НПЛ и 98,4 % пациентов группы ВПЛ.
Качество жизни
Изучение качества жизни – важный аспект оценки проводимой терапии. Анализ данных ВАШ в начале исследования выявил достоверно более низкое качество жизни в группе НПЛ. Через 8 недель наблюдения качество жизни достоверно улучшилось в обеих группах, однако в группе НПЛ это улучшение было более выраженным (табл. 2).
Таблица 2. Изменение качества жизни по ВАШ, баллы.
Субъективная оценка терапии
Переносимость терапии пациенты оценили как отличную и хорошую в 79 % (группа НПЛ) и 80,4 % случаев (группа ВПЛ; р = 0,7). Улучшение самочувствия отметили 95 % пациентов группы НПЛ и 94,2 % – из группы ВПЛ (p = 0,3). Самочувствие не изменилось (по субъективной оценке пациентов) в 5 % случаев в группе НПЛ и в 5,8 % – в группе ВПЛ. Изъявили желание продолжить терапию фелодипином 90,1 % больных в группе НПЛ и 89,7 % – в группе ВПЛ.
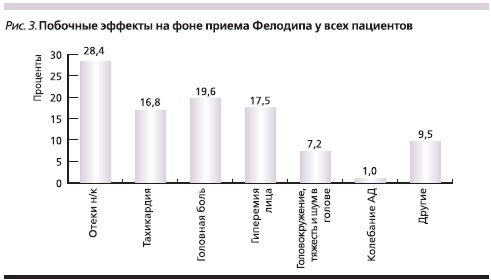
Побочные реакции, отмеченные за время наблюдения у пациентов, представлены на рис. 3. Наиболее часто наблюдали отечность голеней, головную боль и гиперемию лица, что согласуется с данными других авторов [7].
Динамика приверженности терапии на фоне лечения
На фоне лечения отмечено достоверное увеличение доли больных, положительно ответивших на вопросы теста Мориски–Грина. Причем в группе с исходно низкой приверженностью динамика была более выраженной (табл. 3).
Таблица 3. Динамика числа больных с положительным ответом на вопросы теста Мориски–Грина в ходе исследования.
При анализе группы НПЛ отмечено, что 1085 пациентов как были некомплаентными, так таковыми и остались. В то же время 1656 пациентов на заключительном визите показали повышение приверженности к терапии (по данным теста Мориски– Грина). В группе ВПЛ только 56 пациентов стали менее комплаентными, а 1724 пациента так и остались высококомплаентными.
В настоящем исследовании из 4816 пациентов были привержены терапии только 31 %. Это практически совпадает с результатами исследования Эпоха-АГ (26,5 %) [8] и несколько меньше, чем цифры, приведенные в докладе ВОЗ [9], – 40 %. Нами были проанализированы факторы, которые могли влиять на приверженность терапии у данной когорты пациентов. В анализ были включены пол, возраст, наличие ИБС и СД, длительность АГ, статус курения, образ жизни, прием медикаментозной терапии (ИАПФ, БРА, АК, аспирин), возможность измерения АД в домашних условиях (наличие дома тонометра).
Как и по литературным данным [1, 4, 10], более приверженными к терапии оказались женщины (р < 0,0001). С возрастом приверженность падала (р < 0,004), что также соответствует общепринятым представлениям [4, 10]. Такие факторы риска, как курение и малоподвижный образ жизни, также ассоциировались с низким уровнем приверженности (р < 0,0002 и р < 0,003 соответственно). Присоединение ИБС и СД, напротив, достоверно повышает приверженность пациентов лечению (р < 0,0001), заставляя их, по всей видимости, наконец-то осознать серьезность проблемы.
Наличие домашнего тонометра и возможности самостоятельно контролировать уровень АД также определяли повышенную приверженность лекарственной терапии (р < 0,03). Этот факт подтверждают и зарубежные авторы [11, 12]. Возможность самостоятельно контролировать АД делает больного активным участником процесса лечения и позволяет воочию видеть его результаты. Это делает прием препаратов более осмысленным, отсюда и повышение приверженности. Сам факт покупки тонометра уже свидетельствует об осознании имеющейся проблемы.
Был проведен анализ лекарственных препаратов, применяемых пациентами. Показано, что наиболее привержены терапии пациенты, принимающие БРА, т. е. препараты, имеющие достаточно высокую стоимость. Тем не менее они занимают в настоящее время первое место по продолжительности удержания на терапии среди антигипертензивных средств. Лидирующая позиция этих препаратов связана не столько с высокой эффективностью, сколько с благоприятным спектром побочных эффектов [13, 14,], а переносимость лечения – ведущая причина “удержания” или отказа от проводимой терапии.
Особое внимание мы уделили такому параметру, как ДЛО. При оценке базовой модели с поправкой на пол и возраст вклад ДЛО в приверженность терапии оказался очень высоким (табл. 4). Наличие препарата в списке ДЛО и выдача его пациенту достоверно повышают приверженность лечению (р < 0,0001). Однако при постепенном включении в анализ таких параметров, как наличие ИБС, присоединение к ИБС СД, наличие домашнего тонометра, мы видим постепенное уменьшение вклада ДЛО в приверженность терапии.
Таблица 4. Вклад ДЛО в приверженность лечению.
Таким образом, наличие препарата в списке ДЛО не является независимым и определяющим фактором приверженности лечению. Если больной должным образом мотивирован, он будет покупать лекарство независимо от наличия их в списке. На первый план в этом случае выходит эффективность и безопасность препарата.
Полученные нами данные свидетельствуют о высокой эффективности фелодипина. Двухмесячная терапия привела к хорошему гипотензивному эффекту у подавляющего числа пациентов. Более 98 % больных, закончивших исследование, либо достигли целевого уровня АД, либо снизили его более чем на 20 и 10 мм рт. ст. (САД и ДАД соответственно). Полученные данные согласуются с результатами других исследований [15], в т. ч. и работ с использованием оригинального фелодипина [16]. Переносимость терапии оценивалась пациентами как отличная и хорошая более чем в 80 % случаев. Было отмечено достоверное улучшение качества жизни, более выраженное в группе НПЛ. Улучшение самочувствия отметили более 90 % пациентов обеих групп. Изъявили желание продолжить терапию Фелодипом 90,1 % больных в группе НПЛ и 89,7 % – в группе ВПЛ.
Обращает на себя внимание тот факт, что в группе НПЛ эффективность лечения была такой же высокой, как и в группе ВПЛ. Уровень АД на последнем визите практически не различался между группами. Этот факт можно объяснить улучшением комплаентности в группе НПЛ. Большая часть пациентов этой группы (56,2 %) стала приверженной лечению к концу наблюдения (p = 0,001). Таким образом, мы видим, что, с одной стороны, эффективность, хорошая переносимость и удобство приема фелодипина (“хороший препарат”) способствовали увеличению приверженности.
С другой – рост приверженности (“хороший больной”) способствовал эффективности терапии. Что тут причина, что следствие – не так уж важно. Стоит лишь отметить, что “хороший препарат”, по всей видимости, не единственная причина повышения приверженности. Важную роль сыграло формирование в ходе исследования более тесного контакта больного с врачом. Следует иметь в виду, что само внимание врача к проблеме комплаентности, соответствующий опрос больного и оценка этого показателя в динамике способствуют его повышению [17].
Выводы
- Выраженный гипотензивный эффект при применении фелодипина у больных АГ был отмечен как в период подбора дозы, так и при последующем наблюдении.
- На фоне длительной терапии фелодипином отмечено достоверное улучшение комплаентности в группе пациентов с НПЛ.
- Мужской пол, пожилой возраст ассоциируются с более низкой приверженностью терапии. Наличие домашнего тонометра у больных ИБС и СД, наоборот, ассоциируется с более высокой приверженностью.
- Наличие препарата в списке ДЛО не является независимым и определяющим фактором повышения приверженности лечению.
- Фелодипин может быть рекомендован для широкого использования в амбулаторной практике благодаря его эффективности, хорошей переносимости и положительному влиянию на комплаентность пациентов.
Информация об авторах:
Фофанова Татьяна Вениаминовна – кандидат медицинских наук, старший научныйсотрудник научно-диспансерного отдела ИКК им. А.Л. Мясникова ФГУ РКНПК МЗиСР.
E-mail: t.fofanova@cardio.ru;
Смирнова Мария Дмитриевна – кандидат медицинских наук, младший научный сотрудникнаучно-диспансерного отдела ИКК им. А.Л. Мясникова ФГУ РКНПК МЗиСР.
Тел. 8 (495) 414-72-94, e-mail: naliya1@yandex.ru;
Агеев Фаиль Таипович – доктор медицинских наук, руководитель научно-диспансерногоотдела ИКК им. А.Л. Мясникова ФГУ РКНПК МЗиСР.
E-mail: ageev@cardio.ru;
Кадушина Елена Борисовна – врач-психоневролог научно-диспансерногоотдела ИКК им. А.Л. Мясникова ФГУ РКНПК МЗиСР.
Патрушева Ирина Федоровна – кандидат медицинских наук, старший научный сотрудникнаучно-диспансерного отдела ИКК им. А.Л. Мясникова ФГУ РКНПК МЗиСР.
Кузмина Алла Евгеньевна – кандидат медицинских наук, старший научный сотрудникнаучно-диспансерного отдела ИКК им. А.Л. Мясникова ФГУ РКНПК МЗиСР.
Деев Александр Дмитриевич – кандидат физико-математических наук, руководитель лабораториибиостатистики ФГУ "Государственный научно-исследовательский центр профилактической медицины".


