Введение
В настоящее время успехи вакцинопрофилактики дифтерии, коклюша, кори и других детских инфекций изменили спектр возбудителей и выдвинули на первое место острые респираторные заболевания вирусной и бактериальной природы, часто ассоциированные с простудным фактором. Хорошо известно, что грипп и корь у детей и взрослых часто осложняются различными гнойно-воспалительными бактериальными заболеваниями, в т. ч. тонзиллитами, отитами, фарингитами, поражением слизистой оболочки полости рта и носа и др. В меньшем проценте случаев дети и взрослые страдают от инфекционных воспалительных процессов со стороны желудочно-кишечного и урогенитального трактов. Для того чтобы заболевания не перешли в хроническую форму, необходимы идентификация возбудителя и адекватная терапия. Использование этиотропных химиотерапевтических препаратов часто не приводит к элиминации лекарственно-устойчивых форм возбудителей и, как правило, сопровождается нарушением нормального микробиоценоза открытых полостей организма пациента с активизацией эндогенной условно-патогенной микрофлоры.
Возбудители эндогенной оппортунистической инфекции в последние годы вызывают повышенный интерес микробиологов, педиатров, инфекционистов и врачей других специальностей, связанный с широким распространением дисбиотических и иммунодефицитных состояний, происходящим на фоне неуклонного роста числа больных, страдающих т. н. болезнями цивилизации. Это хронические воспалительные заболевания желудочно-кишечного тракта (гастриты, язвенная болезнь желудка и двенадцатиперстной кишки, панкреатиты, гепатиты и холециститы), желчно- и мочекаменная болезни, атеросклероз, астма, бесплодие, ожирение, подагра, остеохондроз, поражения суставов, остеопороз, диабет и некоторые онкологические заболевания. Положение о том, что в основе многих хронических патологических процессов лежит увеличение проницаемости кишечного барьера, ассоциированное с воспалением и цитокиновым дисбалансом, широко обсуждается на страницах
печати [1, 2].
Лечебные бактериофаги
В отраслевом стандарте “Протокол ведения больных. Дисбактериоз кишечника” (ОСТ 91500.11.0004-2003, Приказ Министерства здравоохранения РФ № 231), в составлении которого приняли участие ученые и клиницисты различных специальностей, внимание врачей было ориентировано на профилактику и терапию дисбиотических состояний с помощью пробиотиков у взрослых и применения пробиотических препаратов, а также специфических лечебных бактериофагов (ЛБФ) у детей [3].
ЛБФ, активные в отношении многочисленных возбудителей гнойно-воспалительных процессов, вызывающих респираторных кишечные и урогенитальные инфекции, известны с начала ХХ в. [4–7]. Было показано, что в ходе диффузии фаговых вирионов в слизистую оболочку, тканевую жидкость, лимфу или кровь в результате контакта с бактериальными клетками происходит адсорбция (прикрепление) фагов к поверхности возбудителя. После возникновения устойчивой связи между специфическим рецепторным участком и вирионом адсорбция фага становится необратимой. Фаговая ДНК или РНК поступает в цитоплазму бактериальной клетки, вызывает блокирование синтеза ее белков, и после репликации и сборки зрелых вирионов наступает лизис клеточной стенки изнутри с выходом 60–70 вирионов во внешнюю среду. Система фаголизиса базируется на наступающем в определенный момент времени последовательном ферментативном гидролизе цитоплазматической мембраны. Гидрофобный мембранный белокхолин обеспечивает за счет разрушения цитоплазматической мембраны доступ второго фермента, связанного с фаг-ассоциированным лизином, к клеточной стенке [8]. Циклы репродукции специфических бактериофагов с их накоплением в месте локализации воспалительного процесса являются важной особенностью фаготерапии, отличающей ее от применения этиотропных химиотерапевтических средств, обладающих широким антимикробным спектром, часто затрагивающим и нормальную микрофлору организма хозяина [9].
В настоящее время ведущую роль в этиологии гнойно-воспалительных процессов играют полиантибиотикорезистентные штаммы условно-патогенных бактерий (УПБ) различных таксономических групп. Известно ослабление эффекта этиотропной терапии из-за формирования устойчивости к лекарственным препаратам штаммов возбудителей. Более того, применение антибиотиков сопровождается нарушениями нормальной микрофлоры, что может вести к формированию иммунодефицитных состояний и аллергизации организма [10]. Альтернативой по отношению к антибиотикам и химиотерапевтическим препаратам являются ЛБФ с широким спектром антимикробной активности, подавляющие как чувствительные, так и антибиотикоустойчивые бактерии. Для подавления антибиотикоустойчивых форм УПБ рекомендовано использовать комплексные бактериофаги с высокой специфической литической активностью, способные элиминировать возбудителей гнойновоспалительных процессов различной локализации [11–13].
Диапазон способов применения ЛБФ необычайно широк и включает не только аппликации на месте поражения, но и пероральный, подкожный, внутримышечный, в также внутрибрюшинный способы введения. Эффективно и применение препаратов ЛБФ в виде клизм, аэрозолей, введение в полость легких, в перикард и т. д. В середине ХХ в. отсутствовал контроль качества производственных препаратов, что приводило к использованию бактериофагов в случайных концентрациях и часто с неизвестным составом. В связи с этим период первоначального подъема интереса к фаготерапии сменился столь же значительным охлаждением. Этому способствовали не только малая изученность и эмпирические способы фаготерапии, но и не известные в то время особенности взаимодействия бактериофага с микробной клеткой, что в целом делало труднопрогнозируемыми результаты лечения. Также в указанный период в медицинской практике начали широко применяться антибиотики, что стало дополнительным фактором, повлиявшим на снижение интереса к использованию бактериофагов.
Следует отметить, что первые сообщения о результатах лечения гнойно-септических инфекций в России с использованием ЛБФ появились в начале 1930-х гг. Была показана безвредность препарата и установлена необходимость раннего начала лечения заболевания – еще до развития интоксикации. При соответствии фага виду возбудителя отмечали высокую эффективность проводимой терапии. У детей недостаточная эффективность объяснялась ранним развитием интоксикации, присоединением гнойных процессов в верхних дыхательных путях, пневмоний, а также отитов, вызванных стафило- , стрепто- и пневмококками. На протяжении последних десятилетий исследования по изучению эффективности и разработке новых препаратов бактериофагов продолжались во Франции, Чехии и Польше, а в конце ХХ в. – и в Великобритании, США, а также в Израиле [6]. Тщательно выполненные
исследования, проведенные в Польше, включали выделение этиологического агента, подбор специфического высокоактивного фага (из коллекции более 250 фагов) с постоянным контролем в ходе лечения и заменой фага при необходимости. Подводя итог проделанной 5-летней работы, авторы сообщили о положительных результатах лечения от 75 до 100 % случаев (в среднем 92 %) бактериальных инфекций в группе больных из 550 человек [14]. Ведущее место в мировой практике разработки лекарственных форм бактериофагов в последние десятилетия заняли работы отечественных ученых, позволившие расширить ассортимент производственной продукции и перейти от жидких бактериофагов к их таблетированным формам, а в настоящее время – к концентратам, линиментам и гелям [15–17]. Номенклатура разработанных и освоенных НПО “Микроген” (Москва) препаратов насчитывает свыше десятка наименований, методы контроля каждого препарата изложены в специальном регламенте, вместе с которым утверждают и наставление по его применению, что подробно отражено в проблемной статье И.В. Красильникова и соавт. [6]. Поиск фагорезистентных штаммов микроорганизмов и подбор для них фагов с последующим включением в производство позволяют поддерживать литическую активность препаратов на высоком уровне в течение длительного времени. Очищенные от примесей концентраты бактериофагов более эффективны и менее реактогенны при введении, чем исходные жидкие формы, что показано Н.Н. Ворошиловой и соавт. на примере Enterobacter бактериофага [18]. С целью увеличения срока годности препараты высушивают. Кислотоустойчивые таблетированные формы удобнее для применения у больных. Линимент, приготовленный на ланолине и касторовом масле, обеспечивает лучшую сохраняемость бактериофага по сравнению с вазелином [13].
Противопоказаний к приему бактериофагов нет. Важными особенностями бактериофагов, обеспечивающими их преимущество перед другими препаратами, являются высокая специфичность к целевым микроорганизмам, хорошая совместимость с другими лекарственными средствами, отсутствие аллергических реакций и эффект нормализации нарушенного микробиоценоза при терапии дисбактериоза кишечника и вагинозов у женщин, что подробно изложено в материалах Отраслевого стандарта по дисбактериозам и в монографиях [3, 19, 20].
Недавно разработаны комбинированный препарат Интерфаг, содержащий интерферон и бактериофаги, и биополимер Биодерм с фагами для нанесения на раны и ожоговые поверхности. Терапевтический эффект Интерфага в стоматологической практике при лечении пародонтита составил 85 %. При синдроме избыточного бактериального роста в тонкой кишке, постдизентерийном колите клинический и бактериологический эффекты показали бактериофаги коли-протейный, стафилококковый, псевдомонадный и комплексный препарат Секстафаг. При использовании таблетированного бактериофага у ожоговых больных положительная клиническая динамика отмечена у 92,6 % пациентов по сравнению с 42,5 % за тот же период у больных контрольной группы [21].
Отсутствие противопоказаний и осложнений при применении препаратов бактериофагов, возможность их использования в сочетании с другими лекарственными препаратами, в т. ч. с антибиотиками и пробиотиками, делают их применение весьма перспективным. Активность в отношении антибиотикоустойчивых штаммов позволяет отнести ЛБФ к средствам этиотропной терапии. ЛБФ безопасны и эффективны при назначении беременным, новорожденным и детям первого года жизни [3, 17, 19]. Эффективность фаготерапии показана при лечении заболеваний, вызванных УПБ, включая дисбактериозы кишечника, гнойные поражения кожи, ЛОР-органов, опорно-двигательного аппарата, респираторного и урогенитального трактов [22, 23]. Адаптированные синегнойные и сальмонеллезный ЛБФ были успешно применены в хирургических отделениях для подавления внутрибольничных штаммов Pseudomonas aeruginosa и Salmonella typhimurium [24, 25].
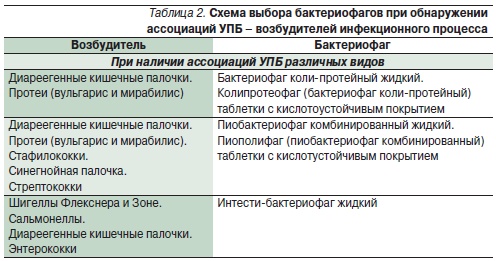
В РФ на протяжении более четырех десятилетий выпускают бактериофаги для лечения и профилактики дизентерии, брюшного тифа, сальмонеллезов, а также против возбудителей ряда гнойно-воспалительных инфекций. Это стафилококковый, стрептококковый ЛБФ, бактериофаг коли жидкий, клебсиелллезный и протейный фаги, бактериофаг синегнойный жидкий. Известны комбинированные препараты из нескольких видов бактериофагов: коли-протейный, пиобактериофаг (против стафило-, стрептококков, клебсиелл, протеев, синегнойной и кишечной палочек), интести-фаг (против шигелл, сальмонелл, стафило-, энтерококков, протеев, кишечной и синегнойной палочек). Препараты ЛБФ представляют собой стерильные фильтраты бактериальных фаголизатов, их назначают внутрь и местно: орошение ран и слизистых оболочек, введение в полости матки, мочевого пузыря, уха, придаточных пазух носа, конъюнктиву глаза, а также в дренированные полости – брюшную, плевральную, в полости абсцессов после удаления гноя. Бактериофаги быстро проникают в кровь и лимфу и выводятся через почки с мочой. Тактика выбора бактериофагов в зависимости от таксономической принадлежности возбудителя представлена в табл. 1 и 2.
Таблица 1. Схема выбора бактериофагов в зависимости от таксономической принадлежности возбудителя инфекционного процесса.
В последние годы сохраняется определенная чувствительность к ЛБФ клинических штаммов стафило-, стрептококков, клебсиелл, протеев и кишечных палочек. В исследовании Н.И. Габриэлян и соавт. из 239 изолятов УПБ в НИИ траспланталогии и искусственных органов (золотистых стафилококков, псевдомонад и кишечных палочек) фагочувствительными были 67–71 % культур, значительно меньшая чувствительность была у штаммов энтерококков и коагулазоотрицательных стафилококков [26]. По данным В.М. Лахно и соавт. (2001), а также Т.С. Перепановой и соавт. (1995), фаголизабельность нозокомиальных клинических культур, изолированных при инфекциях мочевого пузыря у пациентов Института урологии, составляла для Staphylococcus aureus и коагулазоотрицательных стафилококков 70–93 %, кишечной палочки – 68–75 %, P. aeruginosa – 43–61,5 % [22, 23]. В НИИ скорой помощи им. Склифософского в течение последних лет сохранялась высокая (98,7 %) лизабельность стафилококков по отношению к ЛБФ. В НИИЭМ им. Н.Ф. Гамалеи (Москва) М.Ю. Чернухой и соавт.(2005) были обработаны результаты 5-летних анализов на дисбактериоз кишечника 766 детей возрастом до года, страдающих дисфункцией желудочно-кишечного трата. Дети были разделены на две группы: до месяца (34 ребенка) и до года (732 ребенка). Изучены антибиотикорезистентность и чувствительность к лечебным бактериофагам 620 дисбиозных культур S. aureus и 152 штаммов Klebsiella spp. При исследовании лизабельности штаммов использовали стафилококковый и клебсиеллезный бактериофаги, интестифаг и поливалентный пиобактериофаг производства Уфимского НИИВС. Высеваемость S. aureus и клебсиелл составила 74,0 и 48,2 % соответственно. Антибиотикограммы показали, что 21,6 % изолятов S. aureus и 74,4 % штаммов клебсиелл были полирезистентными. Анализ устойчивости 620 штаммов S. aureus к антибиотикам показал, что 82,3 % культур были резистентными к ампициллину, 40,8 % – к канамицину. Метициллинрезистетные стафилококки составили 28,4 %, из них 78,0 % обладали маркерами множественной лекарственной устойчивости. Среди 152 штаммов клебсиелл 74,4 % культур характеризовались множественной лекарственной устойчивостью. Клебсиеллы и стафилококки, чувствительные ко всем антибиотикам, составили всего 1,5 и 9,9 % соответственно. При оценке чувствительности S. aureus к ЛБФ установлено, что к стафилококковому фагу были устойчивы 36,0 % культур, к поливалентному пиобактериофагу – 37,8 %, интести-фагу – 55,0 % [27].
В настоящее время адекватность ЛБФ этиологической структуре возбудителей может быть достигнутой за счет постоянной адаптации бактериофагов к циркулирующим среди больных штаммам возбудителей. Для этого требуется обновление входящих в препараты рас бактериофагов, лизирующих вновь возникающие фагоустойчивые клоны возбудителей. Важным условием, обеспечивающим эффект фаготерапии, является определение чувствительности выделенного штамма к препарату назначаемого бактериофага.
Новым направлением в разработке лечебно-профилактических препаратов является получение фагассоциированных лизинов (ФАЛ), растворяющих мембраны чувствительных клеток [28, 29]. Получены первые обнадеживающие результаты на модели пневмококкового ФАЛ, растворяющего и элиминирующего Streptococcus pneumoniae из носоглотки мышей без формирования устойчивых к препарату штаммов пневмококков [30]. Использование пневмококкового ФАЛ спустя час после экспериментальной бактериемии у мышей обеспечило 100 %-ное выживание животных опытной группы против 20 % в контрольной и элиминацию возбудителя из вагины, полости рта и носа. Показана возможность использования ФАЛ, активных в отношении стрептококков групп А, В, С и Е, для лечения фарингитов в отсутствие воздействия препарата на нормальную микрофлору носоглотки [31, 32]. Получены обнадеживающие результаты по использованию ФАЛ, специфических в отношении лизиса стафило-, энтерококков и листерий [33–35].
Как известно, при лизисе клеток возбудителя в организме больного бактериальный фаголизат остается в том месте, где произошла встреча инфекционного агента с лечебным бактериофагом. Так как фаголизат состоит из разрушенных клеточных стенок бактерий и их внутриклеточных структур, взаимодействующих с различными Toll-подобными рецепторами, можно предполагать у него опосредованное за счет протективных антигенов возбудителя иммуностимулирующее действие, важное при лечении хронических воспалительных заболеваний, протекающих на фоне иммунодефицитных состояний.
В заключение следует указать, что приведенные материалы показывают перспективность применения различных форм ЛБФ для профилактики и лечения гнойно-воспалительных заболеваний различной локализации у детей и взрослых.


