Заболевания суставов и позвоночника представляют значительную проблему для современной медицины, т. к. способствуют развитию функциональной недостаточности опорно-двигательного аппарата и как следствие – снижению илипотере трудоспособности. При этом какпричина инвалидизации больных заболевания суставов занимают 3-е место(после сердечно-сосудистых и онкологических).
Основным симптомом данной группызаболеваний является боль в суставахи спине. И поскольку распространенность различных заболеваний опорно-двигательного аппарата неуклонно растет, отмечается рост потреблениянаселением анальгетиков и нестероидных противовоспалительных препаратов(НПВП).
НПВП – группа лекарственныхпрепаратов с различной химическойструктурой, обладающих анальгетическими, противовоспалительными ижаропонижающими свойствами. Послеприема внутрь все НПВП практическиполностью всасываются в желудочно-кишечном тракте (ЖКТ), а их активные метаболиты обладают высокой тропностью к белкам плазмы (преимущественно альбуминам). Выводятся НПВП восновном через почки. Препараты данной группы различаются по скорости наступления лечебного эффекта, определяемой временем достижения максимальной концентрации в плазме, и подлительности эффекта, зависящей отвремени полувыведения препарата.Механизм действия НПВП связан свмешательством в метаболизм арахидоновой кислоты, который, как известно, может идти по двум путям, важнейшееместо в котором занимает циклооксигеназа (ЦОГ; рис. 1).
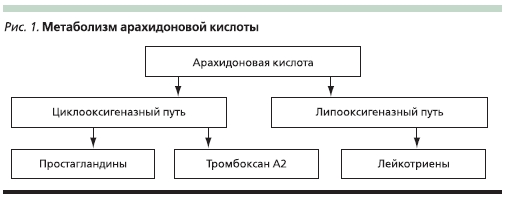
ЦОГ может существовать в виде двухизоформ – ЦОГ-1 и ЦОГ-2. ПричемЦОГ-1 является источником синтезапростагландинов (ПГ), обеспечивающих физиологическую работу клеток, ипостоянно присутствует в большинстветканей организма человека, в то время как ЦОГ-2 синтезируется при различных воспалительных процессах и способствует синтезу провоспалительныхПГ, накапливающихся в очаге воспаления [1, 2]. ПГ характеризуются широкимспектром действия: являясь медиаторами воспаления, они обладают вазодилатирующими свойствами, повышаютпроницаемость сосудов; способствуяразвитию отека и экссудации, потенцируют действие гистамина и брадикини-
на; снижают порог болевой чувствительности, а также оказывают центральноедействие – повышают чувствительность центров гипоталамуса к действиюпирогенов.
В последние годы отмечается ростинтереса к роли ЦОГ-2 в развитиигиперальгезии, что вызвано полученными данными об увеличении концентрации фермента в очаге воспаления, атакже его экспрессии в спинном мозге.Считается, что противовоспалительный эффект НПВП связан именно с ингибированием ЦОГ-2, а развитиепобочных явлений – с блокадой ЦОГ-1.В связи с этим особого вниманиязаслуживают НПВП, механизм действия которых заключается в подавлении ЦОГ-2. Согласно рекомендациямAHRQ (Agency for Healthcare Quality andResearch), все НПВП могут быть разделены на неселективные, селективные ЦОГ-2 ингибиторы (класс коксибов)и частично селективные (с преимущественным подавлением ЦОГ-2) [3].К последней группе препаратов относится нимесулид.
Нимесулид был создан в 1980 г., он относится к классу сульфонанилидов. Препарат обладает высокой биодоступностью, после перорального приема 50%-ная концентрация нимесулида в плазмедостигается уже через 30 минут, а максимальная концентрация – через 1,5–2,5 часа, благодаря чему препарат оказываетдовольно быстрое анальгетическое действие [4, 5]. Нимесулид связывается сбелками плазмы на 95 %, подвергается биотрансформации в печени и выводится через почки и кишечник. Периодполураспада нимесулида составляет от1,8 до 4,7 часа, но ингибиция ЦОГ-2сохраняется до 8,0 часов (в синовиальной жидкости – до 12,0) [6]. Механизм действия нимесулида включает:
• подавление высвобождения гистамина из базофилов и тучных клеток;
• блокирование протеинкиназы С ифосфодиэстеразы 4-го типа, приводящее к ингибированию продукциисупероксидных радикалов;
• ингибирование синтеза металлопротеиназ;
• ингибирование активности протеаз;
• подавление синтеза интерлейкина-1 и фактора активации тромбоцитов;
• подавление высвобождения факторанекроза опухоли α.
Нимесулид был подробно изучен вряде клинических исследований. Одноиз них – исследование Kullich W.C. исоавт. [7], в которое были включены20 пациентов с гонартрозом и/иликоксартрозом II–IV стадий и выраженной болью в суставах. Группу контролясоставили 22 добровольца без артралгий. Больные принимали нимесулид в дозе200 мг/сут в течение 3 недель.
Помимо доказательства клиническойэффективности нимесулида в исследовании были получены важные данныео механизме действия препарата. Присравнении со здоровыми добровольцами у больных остеоартрозом (ОА) нафоне приема нимесулида отмеченодостоверное снижение уровня олигомерного матриксного протеина (COMP)и металлопротеиназ (ММР) 3 и 8 в сыворотке крови через 3 недели терапии.Концентрация ММР-1 также снижалась, но статистически недостоверно (табл. 1).
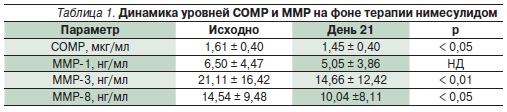
Известно, что ММР-1, -8 и -13 играют значительную роль в патогенезе ОА, инициируя деградацию коллагена II типа, фрагменты которого в дальнейшем подвергаются расщеплению ММР-3 [8, 9]. Полученные данные о снижении этихпоказателей на фоне терапии нимесулидом имеют большое значение,поскольку свидетельствуют об уменьшении деградации суставного хряща.В настоящее время доказано наличиепозитивной корреляции между уровнемСОМР в сыворотке крови и рентгенологической стадией ОА (по Kellgren и Lawrence) [10]. Кроме того, выявленаположительная корреляция данногопоказателя с наличием у больных ОАсиновитов [11].
Известно, что нимесулид, как и егоосновной метаболит 4-гидроксинимесулид, выступает в качестве акцептора свободных радикалов кислорода [12,13], которым отводится значимая рольв патогенезе ревматических заболеваний. В ходе изучения НПВП появилосьпредположение о наличии у нимесулидаантиоксидантных свойств, способствующих уменьшению воспаления при ревматических заболеваниях. В частности,Zheng S.X. и соавт. [14] опубликовалиданные о том, что нимесулид и 4-гидроксинимесулид способны не только акцептировать, но и ингибировать свободные радикалы.
Для проверки данной гипотезы использовалось изучение статусаглутатион-S-трансфераз (ГСТ), являющихся детоксикационными изоэнзимами [15], обеспечивающими защиту клеток от токсических эффектов свободныхрадикалов.
В исследование Kullich W.C. и соавт.[16] вошли 20 больных в возрасте41–71 года с ОА коленных суставов и23 здоровых добровольца. Все больныеОА принимали нимесулид в дозе 200 мг/сут, длительность терапии составила 3 недели. У больных ОА определялисьуровни ГСТ, ММР-3 и тканевого ингибитора ММР-3 – TIMP.
У больных ОА до начала приема нимесулида концентрация ГСТ была значительно ниже по сравнению со здоровыми добровольцами. После 3-недельнойтерапии нимесулидом у данной группы пациентов отмечено достоверноеповышение уровня ГСТ – примерно на64 % (р < 0,05), при этом он достигал значений, сопоставимых со здоровымконтролем.
Помимо этого в ходе исследованиябыло зарегистрировано снижение концентрации ММР-3 в группе больных,принимавших нимесулид (р < 0,001).Исследование уровня TIMP достоверных изменений за период терапии невыявило. Но было зафиксировано повышение значений индекса, представляющего собой соотношение TIMP/ММР-3. Рост индекса более чем на 20 % былотмечен у 64,7 % пациентов, что свидетельствует об уменьшении деградациихряща у больных, получающих нимесулид. Таким образом, эти данные свидетельствуют об отсутствии у нимесулидахондротоксических свойств.
Среди препаратов, обладающих анальгетическими свойствами, большинствопациентов отдают сегодня предпочтение НПВП. Высокая эффективностьлекарственных средств этого класса в купировании боли подтверждена вмножестве клинических исследований.В некоторых из них проводилось сравнение анальгетического эффекта НПВП и опиоидных препаратов у больных ОА. Так, сравнительное изучение эффективности диклофенака в дозе 100 мг/сут и опиоидного анальгетика декстропоксифена в дозе 180 мг/сут в комбинациис парацетамолом до 2 г/сут показало достоверно более выраженное уменьшение интенсивности боли (р = 0,05)и увеличение функциональной активности (р = 0,01) в группе больных, принимавших НПВП. Исследование было проведено на большой когорте больных ОА (846 человек), длительность наблюдения составила 8 недель[17]. Аналогичные результаты былиполучены в исследовании Beaulieu А.и соавт. [18], в котором участвовали107 больных ОА, принимавших диклофенак 75–100 мг/сут или трамадол 200–400 мг/сут + парацетамол “по требованию”. Статистически значимое уменьшение выраженности боли в суставахбыло выявлено в обеих группах, приэтом эффективность препаратов оказалась идентичной.
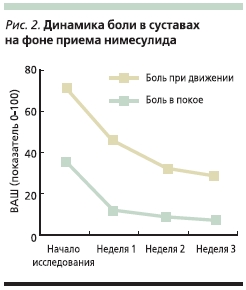
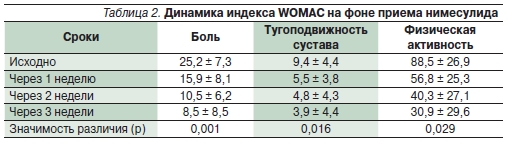
Эффективность нимесулида при ОАподтверждена многочисленными клиническими исследованиями. На сегодняшний день получены доказательства, чточастично селективные НПВП сопоставимы по эффективности с неселективными [3]. В исследовании Kullich W.C. исоавт. [7] изучалось влияние нимесулидана симптомы ОА. Оценка эффективности препарата проводилась с использованием опросника WOMAC. Было зарегистрировано достоверное улучшение повсем оцениваемым параметрам – боли,скованности и функциональной недостаточности (рис. 2, табл. 2).
По результатам длительного (12-месячного) сравнительного исследованиянимесулида 200 мг/сут и напроксена750 мг/сут у 370 больных ОА эффективность обоих препаратов была практически одинаковой: изменение суммарногоиндекса WOMAC в конце исследования составило 22,5 % в группе нимесулидаи 19,9 % в группе напроксена. Числопобочных явлений оказалось ниже вгруппе больных, принимавших нимесулид, – 47,5 % против 54,5 % [19].
Финскими авторами (Pohjolainen Т. исоавт.) [20] были опубликованы результаты рандомизированного двойногослепого сравнительного исследованияэффективности нимесулида и ибупрофена у пациентов с острой болью внижней части спины. В исследованиебыли включены 104 пациента в возрастеот 18 до 65 лет, получавших в группахпо 52 пациента нимесулид 200 мг/сут или ибупрофен 1800 мг/сут в течение10 дней. Интенсивность боли в спинеи физическая активность пациентов оценивались с помощью опросникаОсвестри. Улучшение по всем оцениваемым параметрам отмечено в обеихгруппах, однако через 10 дней терапиинимесулид вызывал более выраженное уменьшение интенсивности боли вспине (р < 0,05). Кроме того, при приемеибупрофена наблюдалось большее количество побочных эффектов со стороныЖКТ.
В НИИР РАМН также было проведено несколько исследований по изучениюэффективности и переносимости нимесулида при ОА и болях в нижней частиспины. В одном из них участвовали 40 больных в возрасте 49–79 лет, из них 32 –с ОА, и 8 – с ревматоидным артритом.Включенные в исследование пациентына протяжение 5 лет и более страдалиартериальной гипертензией. Больные были рандомизированы в две группы: первая принимала диклофенак в дозе100–150, вторая – нимесулид (Найз) вдозе 200–400 мг/сут. Продолжительность исследования составила 20 дней.
Эффективность Найза оказалась сопоставимой с таковой диклофенака. В то же время среди больных, получавших Найз, не было отмечено значимого изменения уровня артериального давления, увеличения потребности в антигипертензивных препаратах, тогда как в группе диклофенака было зарегистрировано достоверное повышение среднесуточного систолического артериального давления, в связи с чем препарат был отменен у 8 больных.
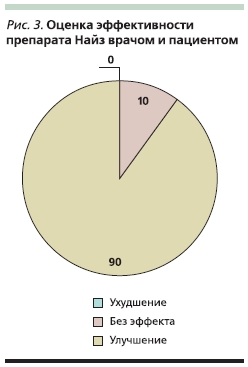
В 2008 г. было проведено открытое сравнительное исследование эффективности и безопасности Найза в сравнении с ибупрофеном. В исследование вошли 40 больных женского пола с ОА коленных суставов и остеопорозом поясничного отдела позвоночника или шейки бедра с болями в нижней части спины. При этом 20 пациенток принимали Найз по 200 мг/сут, а 20 – ибупрофен 1200 мг/сут. Обе группы больных были сопоставимыми по возрасту, длительности болезни, индексу массы тела, интенсивности боли в суставах и спине по ВАШ. Через 2 недели терапии отмечено статистически значимое уменьшение интенсивности боли, скованности и суммарного индекса WOMAC в обеих группах. Однако суммарный показатель боли на фоне приема Найза был ниже, чем при приеме ибупрофена (173,5 ± 66,1 против 182,3 ± 53,7 мм). При оценке индекса Освестри достоверные изменения были зафиксированы только в группе больных, принимавших Найз. Таким образом, Найз оказывал более быстрый и выраженный анальгетический эффект, в т. ч. и на боль в нижней части спины. Рис. 3 демонстрирует эффективность Найза у включенных в исследование больных.
В связи с ростом потребности вНПВП среди населения возникаетпроблема безопасности использования данных препаратов, т. к. НПВПобладают рядом побочных эффектов,наиболее частыми из которых являются т. н. класс-специфические, связанные с подавлением активности ЦОГ-1.К ним относятся патология желудка,тонкой и толстой кишок (развитие диспепсических симптомов, эрозий, язв,желудочно-кишечного кровотеченияи перфораций), расстройство агрегации тромбоцитов, нарушение функции почек и сердечно-сосудистой системы.При этом значительную когорту больных, нуждающихся в приеме НПВП,составляют лица пожилого возраста,страдающие различными сопутствующими заболеваниями. Вследствие этогориск развития побочных эффектов у них значительно возрастает. РазвитиеНПВП-гастропатий в основном связано с блокадой ЦОГ-1, приводящей кподавлению синтеза цитопротективныхПГ – ПГE2 и ПГI2.
Рассматриваются следующие механизмы защитного действия ПГ на слизистую оболочку желудка:
• локальная вазодилатация (улучшениекровотока);
• повышение секреции слизи;
• стимуляция пролиферации эпителия.
Следует отметить, что частота обнаружения язв ЖКТ при эндоскопии у больных, не предъявляющих субъективных жалоб, также высока, как и у пациентов с симптомами диспепсии. К факторам риска развития НПВП-гастропатий относятся [21]:
• возраст старше 65 лет;
• тяжелое поражение ЖКТ в анамнезе (язвы, кровотечения, перфорации);
• применение высоких доз НПВП;
• сочетанный прием двух и более препаратов этой группы, включая низкие дозы ацетилсалициловой кислоты;
• одновременный прием антикоагулянтов и кортикостероидов;
• коморбидные заболевания (сердечно-сосудистая патология и др.);
• инфекция Helicobacter pylori.
Сочетанное применение низких доз аскорбиновой кислоты (АСК) как с неселективными, так и с селективными НПВП существенно повышает вероятность серьезных осложнений со стороны ЖКТ. По данным ряда авторов, одновременный прием этих препаратов увеличивает риск развития НПВП-гастропатий в 2–4 раза [22, 23], причем применение кишечнорастворимых форм НПВП не приводит к снижениюриска серьезных побочных эффектов[24, 25]. При этом имеются сведения о меньшей частоте (примерно на 50 %)возникновения НПВП-гастропатий прикомбинации АСК с селективными ингибиторами ЦОГ-2. В связи с высокойчастотой развития различных побочныхэффектов со стороны ЖКТ, согласнорекомендациям ACG (American Collegeof Gastroenterology) от 2008 г., всем больным с повышенным риском развитияданных осложнений следует назначатьгастропротективную терапию. В ходе исследований показано, чтоиспользование H-блокаторов не является надежным средством профилактики язв ЖКТ. По мнению большинства исследователей, ингибиторы протонной помпы обладают преимуществом в предупреждении НПВП-индуцированных язв и диспепсии.
Существует ряд зарубежных исследований по изучению частоты осложнений со стороны ЖКТ, вызываемых НПВП.Так, Bradbury F. и соавт. сравнили частоту таких осложнений при приеме трехчасто используемых в клинической практике препаратов: диклофенака (принимали 3553 больных), нимесулида (3807 больных) и ибупрофена (1470 больных). Анализ результатов показал, что частота НПВП-гастропатий была меньше в группе нимесулида по сравнению с диклофенаком (8,1 и 12,1 % соответственно) и сопоставима с ибупрофеном (8,1 и 8,6 % соответственно) [26]. Двукратное уменьшение риска развития осложнений со стороны ЖКТ на фоне приема нимесулида (по сравнению с другими НПВП) подтверждена Conforti A. и соавт., проанализировавшими 10 608 зафиксированных случаев побочных эффектов у больных, принимающих НПВП [27].
Отдельно был изучен риск развития кровотечений из ЖКТ при приеме различных НПВП. Laporte J. и соавт. была проведена оценка сообщений о желудочно-кишечных кровотечениях – всего 2813 случаев [28]. В группу контроля вошли 7193 больных. Безопасность нимесулида оказалась выше, чем у других часто используемых НПВП: относительный риск кровотечения для нимесулида составил 3,2, для диклофенака – 3,7, для мелоксикама – 5,7, и для рофекоксиба – 7,2.
В НИИР в 2007–2008 гг. тоже изучались нежелательные явления, связанные с приемом НПВП. С этой цельюанализировались стационарные больные (322 человека) с различными ревматическими заболеваниями, принимавшие нимесулид в течение года до момента госпитализации, а также продолжавшие прием препарата в стационаре [29]. Частота различных нежелательных явлений, возникших на фоне приема нимесулида, представленав табл. 3.
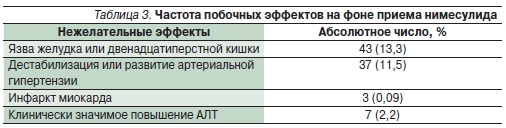
Большинство эндоскопически выявленных язв слизистой оболочки ЖКТ было бессимптомным. Cтойкое повышение АД в период госпитализации было отмечено у 11,5 % больных. Среди лиц, исходно имевших эту патологию, частота дестабилизации АД была существенно выше, чем в целом по группе, и составила 26,8 %. Эти данные аналогичны результатам крупных международных исследований (таких, например, как CRESCEN), в которых изучалось влияние НПВП на АД в группах больных,страдавших артериальной гипертензией, где этот показатель составлял 16–30 % для различных препаратов. Необходимо также учитывать, что многие больные, страдающие артериальной гипертензией, не получают адекватной терапии и не придерживаются назначенных им схем терапевтического контроля АД. В нашем исследовании не было зафиксировано патологии со стороны печени (желтухи, гепатомегалии и печеночной недостаточности), а повышение уровня трансаминаз в 2 раза и более отмечено только у больных ревматоидным артритом, принимавших одновременно с нимесулидом цитостатики (метотрексат и лефлуномид), в связи с чем развитие данного нежелательного явления трудно отнести на счет только нимесулида.
В 1997–2001 гг. Traversa G. и соавт.провели большое популяционное исследование частоты гепатотоксическихреакций. За указанный период былопроанализировано возникновение нежелательных явлений у 397 537 больных.По данным авторов, суммарная частота гепатотоксических реакций на фонеприема различных НПВП составила 29,8на 100 тыс. пациенто-лет. При анализечастоты возникновения данных осложнений для отдельных НПВП получены следующие данные: для нимесулида этот показатель был равен 35,3, для диклофенака – 39,2, для кеторолака – 66,8 и для ибупрофена – 44,6 [30].
В целом с 1985 по 2000 г. зафиксировано всего 192 эпизода клинически значимых осложнений со стороны печени приприеме нимесулида. Суммарная частотагепатотоксических реакций составляетменее 0,1 эпизода на 100 тыс. [31, 32]. Вплоть до настоящего времени появляются лишь отдельные сообщения о тяжелых гепатотоксических осложнениях. И хотя гепатотоксичность нимесулида не является более высокой по сравнению с другими НПВП [30, 33], EMEA (European Medicines Agency) приняло решение рекомендовать странам Евросоюза ограничить непрерывный прием нимесулида в суточной дозе 200 мг сроком 15 дней [34].
К факторам риска гепатотоксичностиНПВП относятся [6]:
• женский пол;
• пожилой возраст;
• патология гепатобилиарной системы (хронический вирусный гепатит илицирроз печени вирусной этиологии);
• тяжелые заболевания, способствующие ухудшению кровотока в печени;
• сочетанный прием препаратов, влияющих на метаболизм НПВП;
• генетические аномалии активностиферментов, определяющих биотрансформацию НПВП и их метаболитов;
• гипоальбуминемия;
• повышение уровня АЛТ и АСТ нафоне терапии НПВП в анамнезе.
Кроме описанных осложнений состороны ЖКТ НПВП могут негативновлиять на сердечно-сосудистую систему и почки. Это особенно актуальнодля больных пожилого возраста, страдающих сопутствующими заболеваниями сердца и почек. Считается, чториск декомпенсации кровообращенияу пожилых пациентов сопоставим с риском желудочно-кишечных осложнений. Прием НПВП может вызывать дестабилизацию артериального давления, особенно у больных артериальнойгипертензией, что требует мониторирования больных и назначения адекватной
антигипертензионной терапии.
Риск развития инфаркта миокарда у больных, получавших терапию нимесулидом, был оценен в эпидемиологическом исследовании, проведенном Helin-Salmivaara A. и соавт. [35]. В исследование вошли 138 949 пациентов.Относительный риск развития инфарктамиокарда для лиц, принимавших нимесулид, составил 1,69. Данный показательсопоставим с таковым для мелоксикама и неселективных НПВП.
Влияние НПВП на систему кровообращения заключается также в небольшом увеличении риска тромбозов.По мнению большинства авторов, данное осложнение не зависит от селективности НПВП и характерно для всего класса препаратов.
Таким образом, нимесулид является эффективным препаратом лечениязаболеваний суставов и позвоночника:
• оказывает быстрое и выраженноеанальгетическое и противовоспалительное действие;
• не обладает хондротоксическимисвойствами;
• по частоте нежелательных эффектовсравним с большинством наиболеечасто используемых НПВП.


