Введение
лей, хорошим распределением в организме, низкой токсичностью и благо приятным соотношением стоимость/эффективность. Первый БЛА, пенициллин, был открыт в 1928 г. Послетого как в середине 1950-х гг. былоустановлено, что основой пенициллина является аминопенициллановая
кислота, состоящая из двух колец – тиазолидинового и β-лактамного [1],модификация β-лактамного кольцапутем присоединения боковых цепейпослужила отправной точкой для создания новых представителей данногокласса антибиотиков. Так, в 1960 г. былсинтезирован метициллин, в 1961 г. –ампициллин, полусинтетический аминопенициллин широкого спектра, кдействию которого оказались чувствительными и некоторые грамотрицательные бактерии [2]. Дальнейшаямодификация препарата привела ксозданию в 1972 г. амоксициллина,отличающегося от своего предшественника значительно улучшенными фармакокинетическими свойствамии большей активностью в отношении ряда микроорганизмов.
был обусловлен способностью E. coli продуцировать β-лактамазы – ферменты, способные осуществлять гидролиз β-лактамного кольца. Продукция данных ферментов является одним из основных механизмов формирования резистентности к БЛА. Наибольшее клиническое значение имеет продукция β-лактамаз грамотрицательными микроорганизмами. Продукци β-лактамаз может быть конституциональной, не зависящей от приема АБП, или индуцированной, связанной с предшествующим приемом пациентом БЛА [4]. Существует несколько типов β-лактамаз. С микробиологической точки зрения наиболее полнойявляется классификация, представленная в обзоре Bush K. и соавт., согласнокоторой все β-лактамазы подразделяются на молекулярные классы A, B, Cи D [5]. Клиническая классификация
β-лактамаз представлена в табл. 1. В ее основе лежат гидролитическая активность, генетическая характеристика, особенности аминокислотных последовательностей, электрофоретическиеособенности ферментов и др. Наиболееважными являются β-лактамазы III и V
классов, т. к. они наиболее часто встречаются в клинической практике.
ингибиторов β-лактамаз.
подавлять активность β-лактамаз ингибиторы защищают от гидролиза чувствительные антибиотики. Несмотряна то что идея о подавлении β-лактамазβ-лактамными структурами возникла еще в 1956 г., первый ингибиторβ-лактамаз – клавулановая кислота –был получен из культуры Streptomyces
clavuligeris только в начале 1970-х гг. [6].
восстановить эффективность амоксициллина в отношении изначально чувствительных микроорганизмов, которые в дальнейшем выработали способность продуцировать β-лактамазы (E. coli, S. aureus, H. influenzae), атакже расширила спектр активностиза счет возбудителей – продуцентов β-лактамаз (K, pneumoniae, B. fragilis,Prevotella spp.) [9–11].
фармакокинетика и приемлемый профиль безопасности позволили амоксициллину/клавуланату стать одним из наиболее популярных АБП, применяемых в лечении большого числа инфекционных заболеваний. На сегодня этот препарат наиболее широко применяется в качестве эмпирической терапии респираторных бактериальных инфекций, таких как внебольничная пневмония (ВП), инфекционное обострениехронической обструктивной болезнилегких (ХОБЛ) бактериальный риносинусит (РС) и острый средний отит (ОСО).
и амоксициллина натрия в пересчете на амоксициллин 562,5 и 437,5 мгсоответственно, а также калия клавуланата в пересчете на клавулановуюкислоту 62,5 мг). Появление новойформы обусловлено как улучшениемфармакокинетических характеристикпрепарата, так и особенностями резистентности возбудителей. Комбинацияамоксициллина и клавуланата в лекартвенной форме с модифицирован-
ным высвобождением была одобрена в США в 2002 г. в качестве лечения ВП и острого бактериального РС, вызванных β-лактамазопродуцирующими бактериями (H. influenzae, M. catarrhalis), а
также S. pneumoniae со сниженной чувствительностью к пенициллину (МПК≤ 2мг/л). Увеличение количества такого рода возбудителей привело к изменению ряда практических руководствпо лечению ВП и острого бактериального РС, в которых рекомендовались более высокие дозы амоксициллина.Данная форма препарата для леченияинфекций дыхательных путей одобрена также в ряде стран Европы, например в Испании в качестве терапии внебольничной пневмонии и Бельгии длялечения острого бактериального РС иинфекционных обострений ХОБЛ.
Фармакология и общая характеристика
стях, а также более высокая активность в отношении S. pneumoniae иH. pylori [20].
β-лактамам способна необратимо связываться с ПСБ бактерий. Отличаетсявысокой стабильностью в жидких средах, возможностью применения каквнутрь, так и парентерально, хорошим проникновением в ткани организма, проявляет собственную активность в отношении ряда анаэробов,N. gonorrhoeae и Acinetobacter spp [8].
Механизм действия
синтеза пептидогликана приводит кгибели бактерии. Поскольку пептидогликан и ПСБ-белки отсутствуют умлекопитающих, специфическая токсичность в отношении макроорганизма для β-лактамов нехарактерна.
синтеза хромосомных β-лактамаз, чтообусловливает низкие темпы ростарезистентности микроорганизмов кпрепарату [22].
Cпектр антимикробной активности
Амоксициллин
Амоксициллин высокоактивен в отношении многих грамположительныхмикроорганизмов, включая S. aureus(только метициллинчувствительныештаммы – MSSA), S. pneumoniae,S. pyogenes, E. faecalis. В отношении грамотрицательной флоры амоксициллин проявляет in vitro активность в отношении H. influenzae, E. coli,P. mirabilis, S. enterica, Shigella spp.,Vibrio spp., N. meningitidis, N. gonorrhoeae
(только пенициллинчувствительныештаммы). Следует отметить, что активность в отношении представителейсемейства Enterobacteriaceae касаетсятолько штаммов, не продуцирующих
β-лактамазы. Он не действует на штаммы Enterobacter spp., Citrobacter spp.,S. marcescens, M. morganii, продуцирующие β-лактамазы класса I, а также нанеферментирующие грамотрицательные микроорганизмы, в частности P.aeruginosa и Acinetobacter spp. Действуетна H. pylori, B. pertussis, B. anthracis,C. diphteriae, T. pallidum, Y. pestis [20].
Амоксициллин/клавуланат
H. influenzae, M. catarrhalis, B. fragilis. В результате сочетания с клавулановой кислотой амоксициллин восстанавливает активность в отношении H. influenzae, M. сatarrhalis, стафилококков, гонококков, неспорообразующих анаэробов. Помимо этого спектрантимикробной активности амоксициллина/клавуланата расширяется засчет действия на ряд грамотрицательных микроорганизмов (Klebsiella spp.и др.) с природной устойчивостью к пенициллину.
устойчивости к метициллину не связан с продукцией β-лактамаз и комбинация с ингибиторами β-лактамаз неприводит к появлению активности вотношении таких штаммов [23, 24]. Среди грамотрицательных бактерий существует значительное большее число видов, продуцирующих
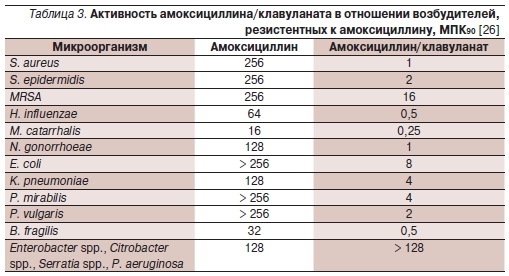
β-лактамазы. Клинически значимыми являются штаммы H. influenzae,M. catarrhalis, E. coli, K. pneumoniae,B. fragilis. В табл. 2 и 3 приведеныпоказатели активности амоксициллина и его комбинации с клавулановойкислотой [25].
в крупнейшем российском многоцен-
тровом исследовании ПеГАС в 1999–
2005 гг., резистентность пневмококков
к пенициллинам составила 8,1–9,7 %,
к макролидам – 6,6–8,2 %, гемофи-
лов к аминопенициллинам – 5,4 %, а
β-гемолитических стептококков груп-
пы А (БГСА) к макролидам – 8–12 %.
Устойчивость S. pneumoniae и
H. influenzae к ко-тримоксазолу в
2005 г. достигла 40,8 и 29,8 %, а к тетраци-
клину – 29,6 и 5 % соответственно. В то
же время устойчивость всех изучае-
мых возбудителей к амоксициллину/
клавуланату в указанный промежуток
времени составила 0–0,1 % [27–29].
Фармакокинетика
ностью (до 95 %) абсорбируется при
приеме внутрь. Прием пищи не влия-
ет на полноту и скорость абсорбции.
Приблизительно на 20 % связывается
с белками плазмы. Быстро распреде-
ляется и создает терапевтические кон-
центрации в бронхиальном секрете,
мокроте, плевре, синусах, миндалинах,
слюне, желчных путях, коже, брюшной
полости, яичниках, простате, синови-
альной жидкости, эндо-, миометрии,
костях и спинно-мозговой жидкости.
Общий объем распределения составля-
ет около 22 л с центральным объемом
распределения порядка 14 л. Большая
часть препарата выводится с мочой в
активной форме. Период полувыведе-
ния (T1/2) амоксициллина составляет
около часа.
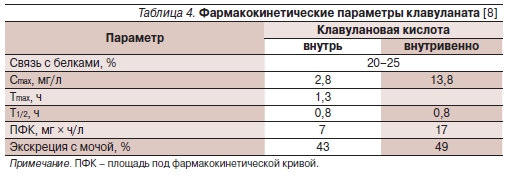
биодоступность на уровне 70 % при
приеме внутрь. Хорошо всасывает-
ся слизистой оболочкой кишечника.
Существенная доля клавулановой кис-
лоты метаболизируется в печени, до
50 % препарата не обнаруживаются в
моче после внутривенного введения
[8]. Через 6 часов после приема внутрь
20–60 % клавуланата обнаруживаются
в неизмененном виде в моче [30, 31],
табл. 4.
амоксициллина и клавуланата сход-
ны и существенно не изменяются
при их комбинированном приеме.
Амоксициллин/клавуланат характери-
зуется высокой биодоступностью при
приеме внутрь, хорошим проникно-
вением в различные ткани и жидкости
организма (исключение составляют
гематоэнцефалический и гематооф-
тальмический барьеры), что позволя-
ет достичь в них концентраций анти-
биотика, многократно превосходящих
значения МПК для чувствительных
микроорганизмов. Отличительной
особенностью новой формы амокси-
циллина/клавуланата является содер-
жание амоксициллина в виде как
амоксициллина тригидрата, который
входит в состав всех предыдущих форм
препарата и характеризуется немед-
ленным высвобождением, так и амок-
сициллина натриевой соли с более
медленным высвобождением. Это
сказывается на улучшении фармако-
кинетического профиля. Так, пиковая
концентрация амоксициллина дости-
гается так же, как и в стандартных
формах ампициллина с немедленным
высвобождением. В то же время мед-
ленное высвобождение амоксицилли-
на натриевой соли позволяет поддер-
живать концентрацию антибиотика в
плазме на более высоком уровне, что
характеризуется большей ПФК. При
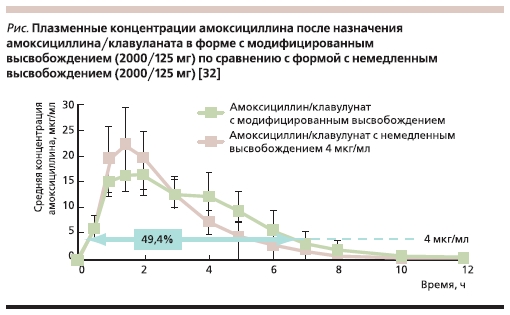
режиме дозирования 2 таблетки 2 раза
в день суточная доза амоксициллина и
клавуланата составляет 4000 и 250 мг
соответственно. При этом обеспечи-
вается содержание амоксициллина в
плазме в концентрации 4 мг/мл на
протяжении 49,4 % 12-часового интер-
вала дозирования, что недостижимо
при назначении амоксицилина/клаву-
ланата с немедленным высвобожде-
нием (см. рисунок). Основываясь на
фармакокинетических и фармакоди-
намических показателях, можно сде-
лать вывод о том, что дозировка новой
формы амоксициллина/клавуланата
2 таблетки 2 раза в день будет эффекти-
вной в отношении возбудителей с МПК
пенициллина ≤ 4 мг/л, в т. ч. многих
пенициллинрезистентных штаммов
пневмококков [33]. Эти данные под-
тверждены результатами исследований
на экспериментальных моделях, вос-
производящих человеческие фармако-
кинетические показатели [34, 35].
линрезистентными пневмококками в
России следует подчеркнуть, что по
данным, полученным НИИ анти-
микробной химиотерапии ГОУ ВПО
“Смоленская государственная меди-
цинская академия” Федерального
агентства по здравоохранению и
социальному развитию и Научно-
методическим центром по монито-
рингу антибиотикорезистентности
нению и социальному развитию в ходе
многоцентровых проектов ПеГАС-I
и ПеГАС-II в 1999–2005 гг., уровень
нечувствительности пневмококков к
пенициллину был относительно ста-
бильным и составил < 10 % (8,1–9,7 %),
МПК90 в отношении изученных штам-
мов не превышала 0,06 мг/л и нахо-
дилась в чувствительном диапазоне.
Однако в 2006–2009 гг., по данным
проекта ПеГАС-III, доля пенициллин-
нечувствительных штаммов составила
11,2 %, а МПК90 увеличилась до 0,125
мг/л, что свидетельствует о значимом
увеличении резистентности к пени-
циллину за исследованный 10-летний
период [36].
Клинические исследования
Внебольничная пневмония
дований с общим числом пациентов
2337 человек, оценивающих эффек-
тивность лекарственной формы с
модифицированным высвобождени-
ем при лечении ВП у взрослых [37,
38]. В одном сравнительном иссле-
довании 347 пациентов рандомизи-
ровались в группу получающих амок-
сициллин/клавуланат (2000/125 мг
2 раза в сутки) с модифицированным
высвобождением и группу получаю-
щих препарат в форме с немедлен-
ным высвобождением (1000/125 мг
3 раза в сутки) в течение 10 дней.
Клиническая эффективность, рентге-
нологическое подтверждение выздо-
ровления и предполагаемая бактерио-
логическая излеченность составили
91,5 и 93 %, 92,4 и 93,9 %, а также 90,6
и 84,4 % в группах с новой и стандарт-
ной формами амоксициллина/клаву-
ланата соответственно.
пациентов в течение 7 или 10 дней по-
лучали новую форму препарата 2 раза
в сутки или амоксициллин/клавуланат
875/125 мг 3 раза в сутки. Клиническая
эффективность составили 94,7 и 88,8 %
у пациентов, получавших форму с
модифицированным высвобождением
и стандартную форму соответственно.
Предполагаемая бактериологическая
составила 85 и 77,3 % соответственно.
Еще в одном исследовании срав-
нивались новая и стандартная формы
препарата в дозе 875/125 мг, каждая
из которых назначалась 2 раза в день в
течение 7 дней. Более чем у 85 % паци-
ентов в группе с модифицированным
высвобождением антибиотика отме-
чены клиническая эффективность,
разрешение рентгенологических при-
знаков заболевания и предполагаемая
бактериологическая эффективность,
тогда как в группе сравнения эти пока-
затели были получены менее чем у
80 % пациентов.
другом сравнительном исследовании
новой и стандартной форм амоксицил-
лина/клавуланата и в несравнительном
исследовании на 1122 пациентах [37].
В последнем из указанных исследова-
ний клиническая эффективность была
достигнута в 85,6% случаев.
линнечувствительных пневмококков в
России следует также учитывать этио-
логическую роль гемофил, что обу-
словливает рекомендации использо-
вания в качестве стартовой терапии
нов [27, 29].
Риносинусит
амоксициллина/клавуланата с моди-
фицированным высвобождением и
стандартной формы препарата оцени-
валась в трех исследованиях с острым
бактериальным РС, одно из которых
было сравнительным. В нем пациенты
рандомизировались в группу получав-
ших левофлоксацин 500 мг/сут или
в группу получавших новую форму
амоксициллина/клавуланата 1000/
125 мг 2 раза в сутки в течение 10 дней
[37, 39]. Положительный клинический
и рентгенологический исход заболе-
вания составил 83,7 % в группе паци-
ентов, получавших амоксициллин/
клавуланат, и 84,3 % в группе левоф-
локсацина. Два других несравнитель-
ных исследования также подтвердили
клиническую эффективность новой
формы амоксициллина/клавуланата у
1554 пациентов [37]. Отмечена эра-
дикация 97,7 % S. pneumoniae, в т. ч.
всех штаммов пневмококков с МПК
пенициллина > 4 мг/мл, а также 94,1 %
H. influemzae и 98,4 % M. catarrhalis.
Клиническая эффективность в этих
исследованиях составила 92,5 и 94 %.
Острый РС является наиболее ча-
стым осложнением острых респиратор-
ных вирусных инфекций. Клинические
симптомы острого РС могут разре-
шаться спонтанно, но существует риск
перехода в рецидивирующую или хро-
ническую форму заболевания, а также
вероятность развития внутричерепных
осложнений.
нии заболевания и необходимости про-
ведения антибактериальной терапии
препаратом выбора является амокси-
циллин. При наличии факторов риска
резистентности возбудителей препара-
том выбора является амоксициллин/
клавуланат [40, 41].
режима терапии в течение 48 часов
рекомендуют провести пункцию
синуса и культуральное исследование
содержимого с определением чувстви-
тельности возбудителей к АБП.
Острый средний отит
дителями ОСО являются S. pneumoniae
и H. influenzae, реже выделяют
M. catarrhalis и БГСА. Определенную
этиологическую роль играют и вирусы.
С учетом доброкачественного течения
заболевания и склонности к само-
излечению определены показания к
назначению антибиотиков при ОСО,
а именно: препаратом выбора при лег-
ком и среднетяжелом течении ОСО
может служить амоксициллин; в случае
тяжелого течения и наличия факторов
риска устойчивости микроорганизмов
(антибактериальная терапия в течение
предшествующих 3 месяцев, рецидив
или обострение хронической формы
инфекции), а также при неэффектив-
ности стартовой антибактериальной
терапии препаратом выбора становит-
ся амоксициллин/клавуланат.
При указании на непереносимость
β-лактамов назначают современ-
ные макролидные АБП (азитроми-
цин, кларитромицин), что является
общим правилом и для других инфек-
ций [40, 41].
Тонзиллит/фарингит
зиллита/фарингита и с точки зрения
распространенности, а также возможно-
сти развития иммунологически опосре-
дованных осложнений является БГСА.
Интересным с экологической точки
зрения является сохранение 100 %-ной
чувствительности БГСА к β-лактамам.
С другой стороны, уровень резистент-
ности к макролидам в России, не превы-
шающий 8 %, позволяет рассматривать
последние в качестве препаратов резер-
ва при непереносимости β-лактамов.
Важно отметить, что тетрациклины,
сульфаниламиды и ко-тримоксазол не
обеспечивают необходимой эрадика-
ции БГСА и не могут применяться для
лечения как вследствие неблагоприят-
ного профиля безопасности, так и из-за
неспособности предупреждения разви-
тия ранних и поздних осложнений [28].
Показанием к назначению амокси-
циллина/клавуланата являются неэф-
фективность стартового режима анти-
бактериальной терапии тонзиллита/
фарингита пенициллинами, а также
рецидив или обострение хроническо-
го тонзиллита/фарингита, когда неу-
дача может объясняться выработкой
β-лактамаз ко-патогенами ротовой
полости.
Эпиглоттит
быстропрогрессирующим воспале-
ниям надгортанника и окружающих
тканей, способным привести к рез-
кой и полной обструкции дыхательных
путей. Отличительной особенностью
является практически полное отсут-
ствие видимых изменений при осмо-
тре глотки. Основным возбудителем
заболевания является H. influenzae ти-
па b. Первоочередной задачей в лече-
нии данной инфекции является под-
держание проходимости дыхательных
путей. При выборе АБП для терапии
следует стремиться к эрадикации воз-
будителя и учитывать его способность
к выработке β-лактамаз, поэтому пре-
паратом выбора может являться имен-
стве стартового эмпирического режима
антибактериальной терапии инфекций
дыхательных путей ингибиторозащи-
щенных пенициллинов, в частности
амоксициллина/клавуланата, являет-
ся полностью оправданным с точки
зрения эпидемиологии резистентности
возбудителей в России.
Переносимость
рынке практически 20 лет, амоксицил-
лин/клавуланат стал одним из самых
изученных препаратов. Согласно
результатам многочисленных клини-
ческих исследований, нежелательные
явления при применении антибиоти-
ка развиваются относительно редко.
По результатам проведенного мета-
анализа нежелательные явления при
применении амоксициллина/клавула-
ната в большинстве случаев являются
дозозависимыми, носят транзиторный
характер и не требуют отмены пре-
парата. Среди них чаще всего фигу-
рируют диарея (9 %), тошнота (3 %),
кожная сыпь (3 %), изменения со сто-
роны гепатобилиарной системы [42].
По риску применения при беремен-
ности амоксициллин/клавуланат отно-
сится к категории В (согласно градаци-
ям Управления по контролю за лекар-
ствами и пищевыми продуктами; FDA,
США), т. е. при изучении у животных
риска неблагоприятного действия пре-
парата на плод выявлено не было [43].
Согласно результатам проспективно-
го исследования, по оценке безопас-
ности применения амоксициллина/
клавуланата в первом триместре бере-
менности у 382 женщин прием пре-
парата оказался безопасным для
плода [44].
лекарственной формы с модифициро-
ванным высвобождением на 4144 паци-
ентах также были сделаны выводы о
безопасности и хорошей переносимости
препарата. Большинство нежелатель-
ных эффектов тоже носят транзиторный
характер, чаще всего встречаются диа-
рея (15,6 %), тошнота (2,2 %), вагиналь-
ный кандидоз (2,1 %) и боль в животе
(1,6 %) [37]. Профиль нежелательных
явлений формы с модифицированным
высвобождением был схож с таковой
препарата с содержанием амоксицилли-
на/клавуланата 875/125 мг при режиме
дозирования 2 раза в сутки [38].
Заключение
формы амоксициллина/клавуланата с
модифицированным высвобождени-
ем являются сопоставимыми со стан-
дартными формами, находящимися
на фармацевтическом рынке уже 20
лет. Более высокая биодоступность и
благоприятные фармакокинетические
показатели повышают эффектив-
ность в отношении менее чувстви-
тельных штаммов S. pneumoniae, наи-
более частых возбудителей серьезных
респираторных инфекций. Новая
форма также остается препаратом
выбора лечения инфекций, вызван-
ных β-лактамазопродуцирующими
H. influenzae и M. catarrhalis, также
вызывающих миллионы инфекций
ежегодно. Поэтому данный препарат
может быть эффективным в эмпири-
ческой терапии в качестве как препа-
рата выбора, так и резерва при терапии
инфекций дыхательных путей, в т. ч.
ВП и острого РС.


