Хронические невропатические синдромы – это гетерогенная группа неврологических заболеваний, характеризующихся развитием хронической боли, связанной с поражением структур нервной
системы, проводящих болевые импульсы. Условно невропатическую боль (НБ) делят на центральную и периферическую. Формирование периферической НБ происходит при повреждении структур периферической нервной системы и развитии периферической, а затем центральной сенситизации. Центральная НБ формируется без участия периферического чувствительного нейрона при повреждении структур спинного мозга, ствола, таламуса, заднего бедра внутренней капсулы, подкоркового белого вещества, а также коры лобной и теменных долей. Несмотря на то что НБ может встречаться при самых различных заболеваниях, она характеризуется развитием специфических чувствительных расстройств – позитивных и негативных (выпадением видов чувствительности различной модальности). Позитивные симптомы могут быть как спонтанными, так и вызванными. Спонтанными позитивными симптомами являются: спонтанная боль, которая может быть постоянной, жгучей или, наоборот, стреляющей; парестезии (патологические ощущения, например, в виде ползания мурашек) и дизестезии (патологические ощущения, неприятные для пациента). К вызванным симптомам относят аллодинию (болевой ответ на неболевой стимул, например прикосновение), гиперестезию (повышенную чувствительность), гипералгезию (усиление ощущения боли) и гиперпатию (выраженную болевую реакцию на повторные болевые стимулы с сохранением ощущения боли после прекращения болевой стимуляции) [6].
Диагностика невропатического синдрома
Алгоритм диагностики невропатического синдрома включает [41]:
А. Сбор жалоб и анамнеза, при котором особое внимание уделяется характеру и локализации боли, соответствующей определению невропатической, а также выявление повреждения или заболевания, способного привести к развитию соответствующего болевого синдрома.
В. Клинический осмотр, направленный на выявление негативных (выпадения чувствительности) и позитивных (гипералгезии и/или аллодинии) чувствительных симптомов для одной или более сенсорных модальностей, отражающих повреждение соматосенсорной системы, и анализ отношения выявленных симптомов к основному заболеванию.
С. Проведение дополнительных методов обследования направлено или на выявление специфического неврологического заболевания (например, нейровизуализация для подтверждения инсульта при постинсультной боли), или на подтверждение наличия чувствительных расстройств в зоне распространения боли (например, биопсия кожи для подтверждения гибели тонких волокон при соответствующей форме полиневропатии).
Исходя из алгоритма диагностики невропатического синдрома, НБ можно разделить на три категории – возможную, вероятную и достоверную. При позитивном диагнозе на этапе А можно говорить о возможной НБ. Вероятная НБ – это позитивный диагноз на этапе А в сочетании с подтверждением или основного заболевания, или зоны распространения боли в соответствии с этапами В или С. Достоверная НБ – это позитивный диагноз на этапе А в сочетании с подтверждением и основного заболевания, и зоны распространения боли в соответствии с этапами В и С [26].
Для скрининговой диагностики невропатического синдрома существует ряд опросников, из которых наиболее широко используются DN4 (83 %-ная чувствительность и 90 %-ная специфичность), Pain-DETECT (85 %-ная чувствительность и 80 %-ная специфичность), LANSS (Leeds Assesment of Neuropathic Symptoms and Signs, 82–91 %-ная чувствительность и 80–94 %-ная специфичность) [26].
Хронические невропатические синдромы часто встречаются в клинической практике, приводят к значительной дезадаптации пациентов и являются значимой медицинской проблемой. Было проведено крупное российское когортное скрининговое двухэтапное эпидемиологическое исследование распространенности НБ, ее причин и характеристик в популяции амбулаторных больных, обратившихся к врачу-неврологу [13]. В исследовании при-няли участие почти 85 923 пациента, оказавшихся на приеме у 322 врачей из 18 городов России. Жалобы на боль предъявляли 39 % (33 664) всех обратившихся пациентов, при этом НБ, по данным опросника DN4, выявлена у 17 % больных. Полученные данные говорят о более высокой распространенности НБ в российской популяции по сравнению с результатами зарубежных исследований, в которых распространенность НБ составила 6–8 % [21, 40]. С одной стороны, в российском исследовании для скрининговой диагностики невропатического синдрома использовалась шкала DN4, тогда как в других исследованиях – S-LANSS и шкала оценки НБ, по-видимому, обладающие более низкой чувствительностью. С другой стороны, в России наибольшая распространенность НБ, в частности, связанной с дорсопатией, отмечается в регионах, где население занято в основном сельским хозяйством: в Ставрополе (49 %), Ростове-на-Дону (48 %), по сравнению с преимущественно промышленными регионами: Владивостоком (12 %), Москвой (28 %). Большинство (58,4 %) пациентов с НБ – лица среднего возраста (40–59 лет), 24 % – лица старшего и пожилого возраста.
Этиология и патогенез невропатической боли
Наиболее частыми НБ являются:боли в поясничном отделе позвоночника (34,7 %), боли в шейном отделе позвоночника (11,9 %), диабетическая невропатия (10,6 %). Реже это тригеминальная невралгия (5,8 %), туннельные невропатии (5,7 %), постгерпетическая невралгия (4,1 %), боли в грудном отделе позвоночника (3,9 %), комплексный регионарный болевой синдром – КРБС (3,7 %) [13]. Необходимо отметить, что НБ, связанная с дорсалгией, чаще встречается у пациентов среднего возраста, тогда как НБ в рамках диабетической невропатии более характерна для лиц старшего возраста.
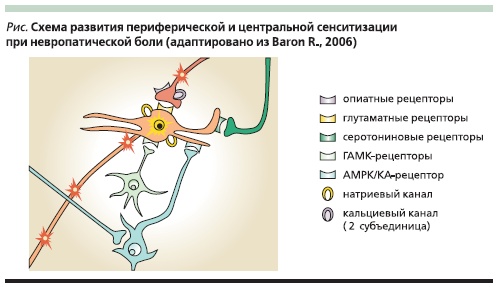
В основе развития НБ лежат такие патофизиологические процессы, как периферическая и центральная сенситизация. В норме болевые импульсы проводятся немиелинизированными С-волокнами и тонкими Аδ-волокнами периферических нервов (см. рисунок). Дендриты ноцицептивнвых С-волокон (на рисунке показаны красным цветом) заканчиваются непосредственно у нейронов II пластины заднего рога спинного мозга (в желатинозной субстанции), тогда как неноцицептивные А-волокна (на рисунке показаны синим цветом) проецируются в более глубокие пластины. Таким образом, нейрон второго порядка (на рисунке показан оранжевым цветом) имеет прямую синаптическую связь с терминалями ноцицептивных волокон, а также мультисинаптическую связь с миелинизированными неноцицептивными А-волокнами. С-волокна связаны с нейронами второго порядка посредством NMDA (N-метил-D-аспартат)рецепторов; медиатором в связи с этим выступают глутамат и субстанция Р. А-волокна связаны с нейроном второго порядка по механизму “воротного контроля”, осуществляемого через АМPА (alpha-amino-3-hydroxy5-methyl-isoxazole-4-propionic-acid)/ КА-рецепторы. Интернейроны (на рисунке показаны светло-зеленым цветом), медиатором которых является γ-аминомасляная кислота (ГАМК), оказывают ингибирующее действие на нейрон второго порядка. Кроме этого ингибирующее влияние на нейрон второго порядка оказывает и нисходящая антиноцицептивная система (на рисунке показана темно-зеленым цветом), ведущая свое начало из околоводопроводного серого вещества, а также ядер шва. Модулирующее действие на нейрон второго порядка оказывают также глиальные клетки спинного мозга. При повреждении аксонов афферентных нейронов первого порядка (ноцицептивных С-волокон и неноцицептивных А-волокон) происходит активация натриевых каналов на поврежденных С-волокнах, что приводит к избыточному поступлению ионов натрия внутрь аксона и возникновению эктопических разрядов [5,
32]. Кроме этого различные нейроактивные субстанции, такие как фактор роста нерва, вазоактивный интестинальный нейропептид, нейропептид Y, продуцирующиеся в результате развития валлеровской дегенерации, воздействуют на рецепторы сохранных волокон: валиноидные TRPV1-рецепторы, адренорецепторы, натриевые каналы, что также приводит к их сенситизации [17, 18, 30].
Спонтанная активность С-волокон приводит к вторичным изменениям центрального звена проведения боли, в частности гипервозбудимости нейронов второго порядка (см. рисунок). Так, импульс, поступающий по механочувствительным А-волокнам (например, при прикосновении), воспринимается пациентом как болевой (феномен аллодинии). В процесс развития центральной сенситизации также вовлечены различные пресинаптические (опиоидные рецепторы, кальциевые каналы) и постсинаптические (глутаматные рецепторы, адренорецепторы, серотониновые рецепторы, ГАМК-рецепторы, натриевые каналы). Так, активность сенситизированных С-волокон вызывает активацию NMDA-рецепторов нейронов второго порядка, что приводит к экспрессии постсинаптических натриевых каналов. Кроме этого активация вольтажзависимых кальциевых каналов, расположенных пресинаптически на терминалях ноцицептивных афферентов, поддерживает выделение глутамата и субстанции Р [1, 2, 12].
Развитие центральной сенситизации сопровождается дисфункцией центральных модулирующих систем, что приводит к дезингибированию нейронов заднего рога, вызывающему еще более выраженную их сенситизацию. Повреждение периферических нервов также приводит к активации глиальных клеток спинного мозга, которые через выделение цитокинов и глутамата дополнительно сенситизируют нейроны второго порядка [43]. Более того, экспериментально было доказано, что повреждение периферических нервов вызывает селективный апоптоз ГАМКергических ингибирующих нейронов (см. рисунок) [35]. Таким образом, при развитии центральной сенситизации на фоне стойкой активации NMDA-рецепторов в сочетании с недостаточностью тормозных систем происходит объединение близлежащих гиперактивных нейронов в единую сеть с самоподдерживающейся актив-
ностью [3].
Клиническая картина невропатической боли
Патофизиологические процессы, происходящие при формировании и развитии невропатического синдрома, четко коррелируют с клинической картиной НБ; следовательно, детальный анализ клиники крайне важен для подбора патогенетически оправданной терапии. В проведенном российском эпидемиологическом исследовании НБ изучали клиническую картину болевого синдрома. Было показано, что 59,2 % пациентов испытывают постоянные боли с выраженными обострениями средней продолжительностью 3,8 месяца. Интенсивность НБ составляет в среднем 5,0–7,2 балла по визуально-аналоговой шкале (ВАШ) – от умеренной до очень сильной боли. Наибольшая интенсивность боли характерна для больных КРБС, дорсалгиями и острой полирадикулоневропатией. Наиболее частыми симптомами у пациентов с НБ были: онемение – 79,7 %, жгучие боли – 64,8 %, стреляющие боли (ощущение удара электрическим током) – 63,4 %, температурная аллодиния – 51,1 % [13].
При осмотре пациента с НБ необходимо тщательно выяснить характер боли: боль возникает спонтанно или вызывается какими-либо неболевыми воздействиями – прикосновением, теплом, холодом (аллодиния). Если боль спонтанная, необходимо спросить у пациента, какая это боль: постоянная, монотонная или стреляющая?
Принципы лечения невропатической боли
В основе спонтанной стреляющей боли лежат гипервозбудимость периферических ноцицепторов, возникновение эктопических импульсов и активация нейронов спинномозговых ганглиев. Следовательно, мишенью фармакологического воздействия должны быть натриевые каналы, на которые воздействуют лидокаин, карбамазепин, окскарбазепин, трициклические антидепрессанты [32, 44].
Механизм постоянной спонтанной боли связан с:
• развитием сенситизации периферических ноцицепторов в результате воспаления [34];
• гипервозбудимостью нейронов заднего рога спинного мозга под действием постоянной афферентации по немиелинизированным С-волокнам и активации С-волокон;
• ингибированием импульсов, проводимых Аβ- и Аδ-волокнами.
В случае сенситизации периферического ноцицептора в результате воспаления показаны нестероидные противовоспалительные средства – НПВС [33]. При развитии гипервозбудимости нейронов заднего рога в результате постоянной афферентации по С-волокнам и активации С-волокон мишенями для фармакологического воздействия могут служить опиатные μ-рецепторы, а также кальциевые каналы (в частности, их α2δ-субъединица); следовательно, препаратами выбора будут опиаты, габапентин и прегабалин. Клиническими маркерами повреждения Аβ-волокон является механическая динамическая аллодиния, а Аδ-волокон – прессорная механическая гипералгезия.
При наличии в клинической картине этих симптомов существует несколько подходов к фармакотерапии. Во-первых, мишенью фармакологического воздействия могут быть постсинаптические NMDA-рецепторы, что обусловливает применение антагониста NMDA-рецепторов кетамина. Во-вторых, это могут быть натриевые каналы, что является основанием для использования селективных блокаторов натриевых каналов, в частности карбамазепина. Кроме этого в данном случае перспективным представляется использование антагонистов NК1-рецепторов и медиаторов МАРК (mitogen-activated protein kinase), хотя в клинической практике такие препараты пока не доступны [18].
С другой стороны, развитие механической динамической аллодинии и прессорной механической гипералгезии может также быть обусловлено функциональным снижением активности или дегенерацией интраспинальных ингибирующих интранейронов и нарушением модуляции боли нисходящими надсегментарными антиноцицептивными системами. Активировать ингибирующие спинальные интранейроны можно путем воздействия на ГАМК-рецепторы, например, агонистом этих рецепторов баклофеном, а на μ-опиатные рецепторы – опиоидными агонистами [18].
Активация нисходящих надсегментарных антиноцицептивных систем осуществляется через α2-адренорецепторы, например, агонистом клонидином, а через серотониновые рецепторы (5-НТ) – трициклическими антидепрессантами (амитриптилином) и ингибиторами обратного захвата серотонина и норадреналина (венлафаксином, дулоксетином) [7, 8]. Повреждение периферических нервов приводит к нарушению структуры не только вольтаж-зависимых натриевых каналов, обусловливающих развитие спонтанной стреляющей и жгучей боли, но и других рецепторов, многие из которых участвуют в развитии болевых ощущений различных модальностей [44]. С этой точки зрения вид аллодинии, имеющийся у каждого конкретного пациента, должен влиять на выбор терапии. Так, в развитии тепловой аллодинии, т. е. возникновения болевых ощущений при воздействии теплом, ключевую роль играют валиноидные рецепторы (TRPV1); следовательно, эффект будет оказывать антагонист TRPV1-рецепторов капсаицин [22]. При холодовой аллодинии большую роль играют меластатиновые рецепторы TRPM8; следовательно, оправданно использование антагониста этих рецепторов ментола [36]. Предполагается, что в развитии статической механической аллодинии принимают участие кислоточувствительные ионные каналы; соответственно, антагонисты этих рецепторов могли бы оказаться эффективными в лечении данного симптома, однако препараты, воздействующие на этот тип рецепторов, пока также находятся в разработке и не доступны практическому здравоохранению [37].
В 2006 г. вышли стандарты Европейской федерации неврологических сообществ по фармакотерапии невропатической боли [11, 15, 16] (см. таблицу).
Таблица. Рекомендации по фармакологическому лечению невропатической боли.
Из таблицы следует, что препаратами выбора в лечении НБ являются антиконвульсанты габапентин и прегабалин, а также трициклические антидепрессанты, а НПВС и анальгетики вообще не рекомендуются в силу их низкой эффективности и высокого риска развития побочных эффектов. Вместе с тем в российском эпидемиологическом исследовании показано, что 67 % пациентов с НБ принимают НПВС, 49 % – ненаркотические анальгетики. При этом антиконвульсанты принимают лишь 12 % больных, антидепрессанты – лишь 17 % [13]. Более того, было выявлено, что 15 % пациентов с НБ вообще не получают никакого лечения [14]. Результаты российского исследования оказались близкими таковым европейского исследования, в котором показано, что 55 % пациентов с хронической болью принимают НПВС, 43 % – простые анальгетики [21]. Полученные результаты свидетельствуют о недостаточно оптимальной терапии НБ. Тем не менее после проведенного исследования 67 % пациентов лечащие врачи планировали назначить антиконвульсанты, а 55 % – антидепрессанты, что несомненно говорит об улучшении качества оказания медицинской помощи пациентам с НБ [10, 14].
Таким образом, все больше пациентов с НБ получают патогенетическое лечение, при этом препаратами выбора выступают лекарственные средства группы антиконвульсантов со специфическим противоболевым действием, что обусловлено их высокой эффективностью в отношении НБ в сочетании с благоприятным профилем безопасности. Это в отличие от ТЦА позволяет использовать антиконвульсанты с противоболевым действием, прежде всего у пациентов старшего и пожилого возраста, среди которых НБ распространена в наибольшей степени. Габапентин, первый препарат данного класса, доказал свою эффективность в отношении НБ в 12 контролируемых исследованиях [25]. равнительный анализ исследований показал, что габапентин, дулоксетин и венлафаксин обладают близкой эффективностью в лечении НБ. Прегабалин несколько превосходит дулоксетин по
воздействию на болевой синдром, но не различается с габапентином и венлафаксином [25].
В настоящее время пациентам с НБ доступен габапентин в форме препарата Габагамма® (Woerwag Pharma, Германия). С препаратом Габагамма® были проведены экспериментальные исследования, показавшие, что эффект препарата на ганглионарные нейроны обусловлен его действием на потенциал-зависимые кальциевые каналы нейронов. При этом Габагамма имеет высокую специфичность к первичным ноцицептивным нейронам с миелинизироваными волокнами как в норме, так и в условиях невропатических расстройств при сахарном диабете. Отличительным свойством препарата Габагамма является отсутствие влияния на нейроны, не принимающие участия в формировании болевых ощущений, что обусловливает его высокую безопасность [9].
Габагамма (габапентин) является синтетическим аналогом ГАМК, и ряд его биохимических свойств позволяет воздействовать на несколько звеньев патогенеза невропатического болевого синдрома [23]. Основной мишенью габапентина являются a2δ2-субъединицы потенциал-зависимых Са2+-каналов. Габапентин препятствует току ионов Са2+ внутрь нейронов, тем самым снижая гипервозбудимость клеточных мембран, синаптическую трансмиссию и сенситизацию ноцицептивных нейронов [19]. Предполагалось также, что еще одной мишенью габапентина являются КАТР-рецепторы, а также активированный гиперполяризацией ток катионов через цАМФ-независимый механизм, хотя экспериментально эти гипотезы не подтвердились [38, 39]. Габапентин ограничивает повторное возникновение Na+-зависимых потенциалов действия, что снижает эктопическую активность поврежденных нервных волокон [42].
В экспериментальной работе выявлено свойство габапентина потенцировать синтез ГАМК, что приводит к повышению активности глутамат декарбоксилазы и активации антиноцицептивной системы [31]. Предполагается также, что габапентин (Габагамма) напрямую воздействует на ГАМКВ-рецепторы, что также обусловливает противоболевое и миорелаксирующее действие препарата [20]. Эффективность габапентина (Габагамма) обусловлена воздействием не только на ГАМКергическую, но и на глутаматергическую системы. Предполагается, что габапентин обладает свойствами антагониста АМРА [24]. Габапентин (Габагамма) не обладает непосредственным действием на NMDA-рецепторы, однако ингибирует синтез глутамата, что также ведет к снижению возбудимости структур ноцицептивной системы [27, 29]. Кроме этого экспериментально было доказано, что габапентин снижает уровень глутамата в головном мозге, что обусловливает его мягкий нейропротективный эффект [28].
Заключение
Российское эпидемиологическое исследование НБ показало, что наличие невропатического синдрома крайне негативно влияет на качество жизни пациентов, в первую очередь на качество ночного сна, снизившееся у 84 % больных [13]. Использование патогенетически оправданных подходов к терапии пациентов с НБ несомненно приведет к существенному улучшению качества оказываемой медицинской помощи.



