Введение
Дисплазии соединительной ткани (ДСТ) – это генетически детерминированные состояния, характеризующиеся дефектами волокнистых структур и основного вещества соединительной ткани, приводящие к нарушению формообразования органов и систем, имеющие прогредиентное течение, определяющие особенности ассоциированной патологии, а также фармакокинетики и фармакодинамики лекарственных средств. ДСТ чаще всего сопровождают пороки и аномалии развития органов [1].
В зависимости от особенностей этиологии различают дифференцированные (наследственные) и недифференцированные формы ДСТ [1–4]. Диагноз недифференцированной ДСТ правомочен, когда у ребенка совокупность внешних (фенотипических) показателей не соответствует клинической картине ни одной из дифференцированных коллагенопатий и выражается диспластическими трансформациями в различных органах и системах [4, 5].
В основе развития ДСТ лежат мутации генов, ответственных за синтез/катаболизм структурных белков соединительной ткани или ферментов, участвующих в этих процессах. В свою очередь реализация генетических детерминант либо определяется внешними условиями, как в случае недифференцированных ДСТ, либо мало зависит от внешних условий, как в случае наследственных нарушений соединительной ткани [1].
В случаях недифференцированных ДСТ заболевание носит полигенно-мультифакторный характер (заболевание с наследственной предрасположенностью), когда имеют место мутации большого числа генов, а случайная перекомбинация аллелей от отца и матери каждый раз приводит к формированию нового уникального генотипа [6].
Методы диагностики ДСТ до сих пор остаются несогласованными. Довольно долго в российской практической медицине использовался упрощенный количественный подход, основанный на выявлении условно избранного числа внешних и/или висцеральных признаков дизэмбриогенеза (МАР – малые аномалии развития). Общее число таких признаков около 300 и в разных исследованиях оценивалось от 16 стигм дизэмбриогенеза до 37. Разным был и диагностический порог, необходимый для выявления ДСТ: от 2 до 6–8. Были попытки введения дифференцированного подхода к выявлению ДСТ среди лиц мужского и женского полов – 4 признака для женщин и 5 для мужчин. В результате полученные разными исследователями данные оказались практически несопоставимыми [7].
В настоящее время пока остается актуальным диагностический алгоритм, согласно проекту российских рекомендаций «Наследственные и многофакторные нарушения соединительной ткани у детей. Алгоритмы диагностики, тактика ведения» (2014). Согласно разработанному проекту, клиническая диагностика проводится в два этапа. Вначале первым этапом оценивается число МАР внешних и висцеральные (выявление ≥6 малых внешних и/или висцеральных признаков системного вовлечения соединительной ткани с вовлечением ≥3 различных органов из разных систем свидетельствовало о наличии ДСТ у ребенка). Вторым этапом проводится оценка степени тяжести ДСТ, согласно специально разработанным таблицам (внешняя и висцеральная оценка); сумма баллов от 12 до 20 расценивается как I степень, от 20 до 30 – как II, более 30 баллов – как III степень.
Нередко у пациентов с ДСТ помимо диспластикозависимых изменений органов мочевыделительной системы (нефроптоз, гипотония чашечно-лоханочной системы, ортостатическая протеинурия) отмечаются аномалии и пороки развития почек [8, 9].
У детей с патологией органов мочевой системы (ОМС) необходимо исключать ДСТ, внешними маркерами которой являются пониженное питание, астеническое телосложение, нарушение осанки, сколиоз, лордоз, плоскостопие, МАР (дефект прикуса и строения зубов, арахнодактилия кистей и стоп, диастаз прямых мышц живота, грыжевые выпячивания и др.) [9, 10].
В литературе, по данным многочисленных исследований, проведенных российскими врачами, указаны особенности течения патологии мочевой системы на фоне ДСТ [5, 9–14]. Так, хронические инфекции мочевой системы (пиелонефрит, цистит) дебютируют довольно рано (до 3 лет), характеризуются рецидивирующим течением (в т.ч. и в периоде полового созревания), чаще носят латентный характер, протекают на фоне обструктивной патологии, плохо поддаются терапии [5, 13]. Кроме того, отмечено раннее формирование очагов фиброза с последующим снижением фильтрационной и парциальных функций почек.
Частыми проявлениями ДСТ во время проведения ультразвуковых исследований ОМС являются гипотония чашечно-лоханочной системы и/или мочеточников, пиелоэктазии, подозрение на пузырно-мочеточниковый рефлюкс, гипотония мочевого пузыря, аномалии положения почек (нефроптоз, дистопия, ротация), врожденные пороки развития – ВПР (удвоенные, подковообразные почки, гидронефроз и др.). При исследовании сосудов почек для хронического пиелонефрита на фоне ДСТ характерно снижение скоростных показателей: максимальной систолической скорости, усредненной скорости кровотока и индексов, характеризующих периферическое сопротивление. Нередко нефроурологическая патология сочетается с ВПР сердца и матки [9, 10, 15–17].
Таким образом, остаются не выясненными вопросы характера ВПР ОМС у детей с недифференцированными ДСТ по сравнению с таковыми без ДСТ, а также тяжесть вовлечения соединительной ткани в этих группах детей.
Цель исследования: установить характер ВПР ОМС и тяжесть вовлечения соединительной ткани у детей с недифференцированной ДСТ.
Методы
В исследование были включены 43 ребенка с ВПР ОМС, в т.ч. 18 мальчиков и 25 девочек. У детей была проведена оценка наличия внешних и висцеральных МАР. В зависимости от числа МАР, которые являются признаком ДСТ, дети были распределены в две группы. В 1-ю группу (основную) были включены 26 пациентов с ВПР ОМС на фоне ДСТ (14,13±2,07 балла), в т.ч. 11 мальчиков и 15 девочек, средний возраст детей – 12,0±3,85 года. Во 2-ю группу (сравнения) были включены 17 пациентов с ВПР ОМС без ДСТ (6,09±2,72 балла), в т.ч. 7 мальчиков и 10 девочек, средний возраст детей – 10,65±2,98 года.
Группы детей были однородными по возрасту (р=0,124) и полу (р=0,941) с незначительным количественным преобладанием девочек в каждой группе (табл. 1).
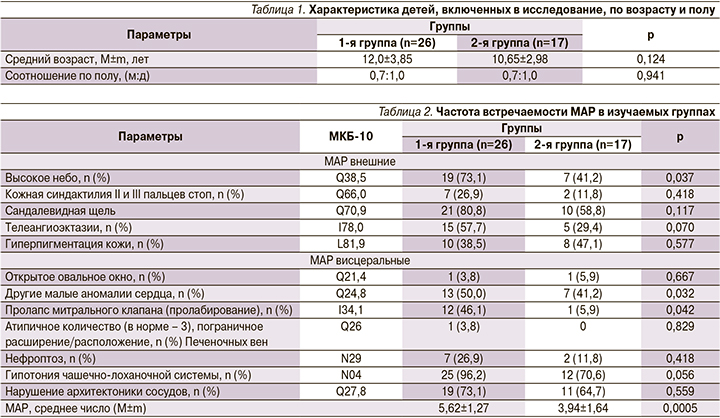
Частота встречаемости различных МАР у детей изучаемых групп представлена в табл. 2.
Среди внешних МАР у детей 1-й группы достоверно чаще, чем в группе сравнения (дети без дисплазии), встречалось высокое небо (р<0,037). Кроме того, у большинства детей 1-й группы наблюдалась сандалевидная щель (80,8%).
Среди висцеральных МАР у детей с дисплазией достоверно чаще, чем в группе сравнения (дети без дисплазии), встречались другие аномалии сердца (р<0,032) и пролапс митрального клапана (р<0,042).
В обеих группах отсутствовали пациенты с мягкими ушными раковинами, макродактилией I пальца стопы, с аномальным расположением ветви/ветвей воротной вены.
Среднее число МАР на 1 пациента было достоверно выше у детей 1-й группы (р<0,0005). У всех детей группы сравнения и у 84,6% детей основной группы выявлены ВПР почек (p>0,05), причем аномалии числа почек и аномалии числа и положения почечных сосудов достоверно чаще наблюдались в группе сравнения (р=0,045 и р=0,020 соответственно), а аномалии расположения почек чаще выявлялись (р=0,004) у детей с ДСТ (табл. 3).
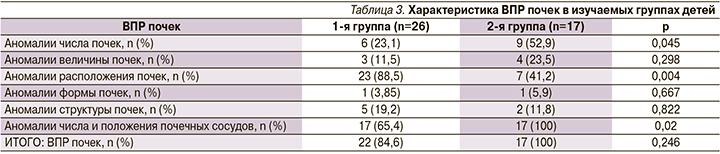
У всех детей основной группы и у 82,4% детей группы сравнения были выявлены ВПР мочевых путей и мочевого пузыря (p>0,05). Достоверных различий между изучаемыми группами по частоте выявления ВПР мочевых путей и пороков развития уретры и мочевого пузыря отмечено не было (р>0,108 и р>0,643 соответственно). Обращает на себя внимание достоверно (р<0,001) более высокая частота ВПР мочевых путей по сравнению с ВПР уретры и мочевого пузыря в обеих группах (табл. 4).
Установлено, что частота аномалий ОМС из расчета на 1 ребенка была недостоверно выше в группе детей с ДСТ: 4,54 и 4,0 соответственно. Однако если в группе сравнения преобладали пациенты с одной и менее аномалий ОМС, то в основной группе в 2,6 раза чаще выявлялись дети, имевшие пять и более аномалий развития ОМС (табл. 5).
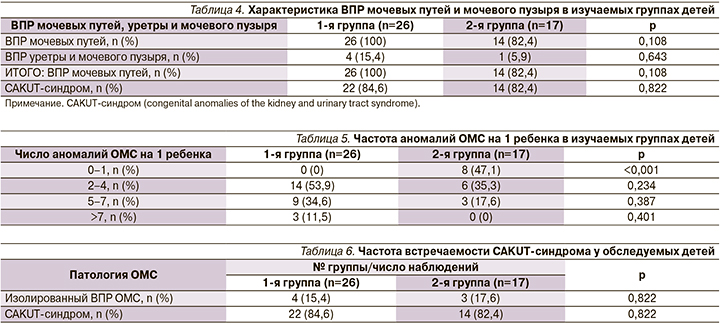
У большинства детей обеих групп одновременно выявлялись аномалии почек и ВПР мочевых путей, уретры и мочевого пузыря, что свидетельствовало о том, что у более 80% пациентов обеих групп имел место CAKUT-синдром (табл. 6).
Таким образом, у детей с ВПР ОМС и ДСТ достоверно выше частота МАР, чем у детей без недифференцированной ДСТ. Комбинированные ВПР почек и мочевыводящих путей одинаково часто выявлялись у детей обеих групп. Однако средняя частота аномалий ОМС из расчета на одного ребенка была выше у детей с ВПР ОМС и ДСТ.
При оценке признаков вовлечения соединительной ткани у детей были выявлены достоверные различия по отдельным костно-суставным внешним признакам по изучаемым группам:
- сколиоз клинически чаще встречался у пациентов с недифференцированной дисплазией (р<0,001), чем у детей без ДСТ;
- гипермобильность суставов чаще встречалась в группе детей с ВПР ОМС с ДСТ (р=0,037), чем у детей без ДСТ;
- плоскостопие чаще встречалась в группе детей с ВПР ОМС с ДСТ (р=0,021), чем у детей без ДСТ.
Остальные костно-суставные нарушения, такие как воронкообразная и килевидная деформации грудной клетки, кифоз и другие деформации грудной клетки, Hallux valgus (пяточно-вальгусная косолапость), встречались в обеих группах редко (р>0,05).
При оценке признаков вовлечения соединительной ткани у детей выявлены достоверные различия по наличию эктодермальных внешних признаков у пациентов с дисплазией (р<0,001). Повышенная растяжимость кожи (р=0,025), «видимая» венозная сеть (р=0,011), аномалии прорезывания зубов (р<0,001) чаще встречались в группе детей с ВПР ОМС с ДСТ, чем у детей без ДСТ. Остальные эктодермальные внешние признаки встречались редко в обеих группах.
При оценке признаков вовлечения соединительной ткани у детей со стороны мышц обращала на себя внимание достоверно более высокая частота выявления диастаза прямых мышц живота (р=0,008) в группе детей с ВПР ОМС с ДСТ, чем у детей без ДСТ.
Среди висцеральных признаков ДСТ пролапс митрального клапана и другие малые аномалии сердца достоверно чаще встречались в группе детей с ВПР ОМС с ДСТ, чем в группе сравнения.
Средний балл ДСТ в 1-й группе наблюдения (дети с врожденной патологией органов мочевой системы на фоне ДСТ) соответствовал 1-й степени тяжести ДСТ (14,13±2,07 балла). Средний балл ДСТ в группе сравнения (дети с врожденной патологией органов мочевой системы без ДСТ) был достоверно (р<0,001) ниже (6,09±2,72) (табл. 7).
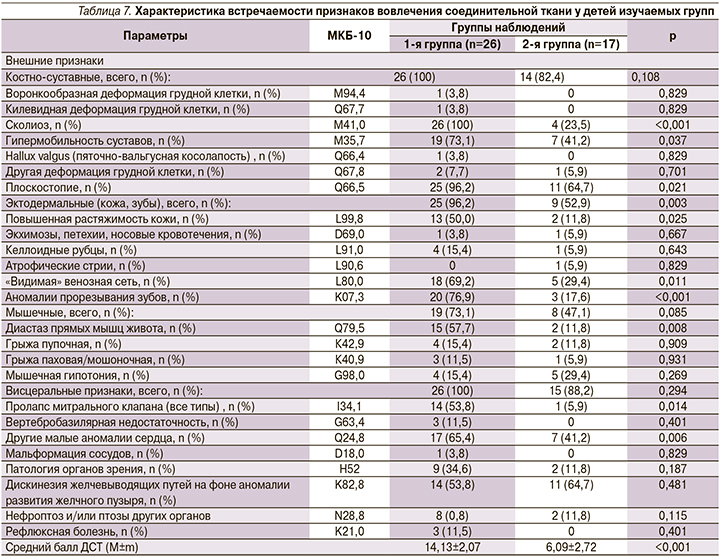
Таким образом, у детей с ВПР ОМС на фоне ДСТ достоверно чаще встречались внешние и висцеральные МАР (р=0,0001), чаще в количестве более 5–6 МАР на 1 ребенка. Среди внешних МАР преобладали высокое небо и телеангиоэктазии, среди висцеральных МАР – пролапс митрального клапана и другие малые аномалии сердца. Такие МАР, как кожная синдактилия II и III пальцев стоп, сандалевидная щель стопы, гиперпигментация кожи, а также нефроптоз, гипотония чашечно-лоханочной системы (чаще в виде пиелоэктазии) и нарушение архитектоники сосудов, встречались одинаково часто у детей с ДСТ и без таковой.
Средний балл у детей с недифференцированной ДСТ достигал 14, в группе сравнения лишь 6 баллов. Среди внешних признаков дисплазии преобладали костно-суставные в виде долихостеномелии, сколиоза, гипермобильности суставов, пяточно-вальгусной косолапости, арахнодактилии, плоскостопия; эктодермальные – в виде повышенной растяжимости кожи, «видимой» венозной сети, аномалий прорезывания зубов; мышечные – в виде диастаза прямых мышц живота. Среди висцеральных признаков дисплазии преобладали пролапс митрального клапана (все типы) и другие малые аномалии сердца, в меньшем проценте наблюдений встречались вертебробазилярная недостаточность, мальформация сосудов, рефлюксная болезнь.
Среди детей с ВПР ОМС одинаково часто вне зависимости от наличия или отсутствия ДСТ встречались пациенты с келлоидными рубцами и атрофическими стриями, пациенты с грыжевыми дефектами (пупочная грыжа, паховая/мошоночная грыжа), дискинезией желчевыводящих путей на фоне аномалии развития желчного пузыря и в небольшом проценте – нефроптозом и/или птозами других органов.
Заключение
Таким образом, у детей с ВПР ОМС наиболее часто наблюдалась костно-суставная патология (у всех детей с ДСТ и у 82,4% детей без ДСТ). Эктодермальная, мышечная и висцеральная патологии встречались реже, но преобладали в группе детей с ДСТ. Пациенты с костно-суставной патологией требуют специального наблюдения специалистов – ортопеда и реабилитолога, а также и мануального терапевта.


