Актуальность проблемы
Атопический дерматит (АтД) является одним из наиболее распространенных хронических воспалительных заболеваний кожи и оказывает выраженное негативное влияние на качество жизни пациентов. АтД различается по клиническому течению, возрасту дебюта, степени тяжести. Нарушение кожного барьера (КБ) не только в очагах патологического процесса, но и в здоровой коже в настоящее время признано ключевым и часто ранним признаком АтД. Выявленные изменения можно объяснить рядом генетически детерминированных нарушений, выявленных как в роговом (РС), так и в зернистом (ЗС) слоях эпидермиса. Однако механизмы, лежащие в основе этих нарушений, изучены лишь частично. Во многих исследованиях воспаление в коже рассматривается как основная причина дисфункции эпидермального барьера. К сожалению, моделирование динамичного и очень сложного процесса дифференцировки эпидермиса кожи человека ex vivo или in vitro все еще затруднено.
Исторические аспекты изучения дефектов КБ при АтД (Исторический взгляд на изучение КБ при АтД)
АтД является многофакторным заболеванием, к наиболее значимым компонентам патогенеза которого относятся генетически обусловленная дисфункция иммунной системы и нарушения барьерных свойств кожи. Дисфункция эпидермального барьера все чаще признается ключевой детерминантой патогенеза АтД. В самых первых публикациях, посвященных данной патологии, исследователи уже отмечали признаки, позволившие предположить нарушение КБ: сухость (ксероз) кожи, потребность в смягчающих и увлажняющих средствах, а также положительная динамика при их использовании и уменьшение порога чувствительности и реактивности кожи. Начиная с конца 1970-х гг. с развитием методологии количественной оценки характеристик КБ накопились доказательства того, что у пациентов с АтД имеется нарушение КБ. Сообщения о признаках, подобных при АтД (например, зуд, экзематозный дерматит), датируются более 2000 лет назад. Возможно, автором первых сообщений является римский историк Светоний (69–140 гг. н.э.). С тех пор многочисленные описания поражений кожи, сходных с АтД, можно проследить на протяжении столетий среди различных рас и этнических групп [1, 2]. В 1892 г. Бенье ввел термин «почесуха, диастазия» как клинически обособленное состояние, которое следует дифференцировать от других аллергических (астма и сенная лихорадка) и кожных заболеваний (крапивница и ихтиоз) [3, 4]. Однако только в начале 1900-х гг. термин «атопический дерматит» получил признание.
В начале 1900-х гг. предприняты первые попытки изучить связь между пищевой аллергией или астмой и сенсибилизацией к пищевым белкам.
K.D. Blackfan отметил, что у пациентов с астмой, сенсибилизированных к пищевым белкам, в младенчестве часто были случаи появления экзематозных высыпаний. Это первое наблюдение, которое позволило заподозрить связь между экзематозными проявлениями и пищевой сенсибилизацией [5]. Основные выводы из его исследований заключались в том, что молодые пациенты с выраженными экзематозными поражениями с гораздо большей вероятностью имели положительную реакцию на несколько пищевых белков. Кроме того, исключение данных белков из пищевого рациона улучшало состояние кожи, отмечался регресс высыпаний [6]. Впоследствии в ряде других исследований также продемонстрирована высокая частота положительной реакции пациентов с АтД на различные пищевые белки. Однако в одном исследовании было обнаружено, что 42 из 46 младенцев с положительной кожной реакцией на яичный белок никогда не употребляли яиц [7].
Это наблюдение в дальнейшем подтвердили и для других распространенных пищевых аллергенов, что позволило предположить, что сенсибилизация может происходить через воспаленную кожу при АтД, а не через желудочнокишечный тракт, как первоначально предполагалось [8–11]
В 1914 г. Rasch ввел термин «почесуха Бенье» и отметил, что даже участки здоровой кожи пациентов с АтД характеризовались ксерозом [3, 4]. При гистологическом исследовании выявлены изменения как в эпидермисе (акантоз), так и в дерме (воспалительные инфильтраты, характеризующиеся мононуклеарными клетками и эозинофилами), которые также наблюдались в коже без поражений.
В 1978 г. проведены исследования на участках пораженной и непораженной АтД кожи на предмет трансэпидермальной потери воды (ТЭПВ). Было выявлено, что у пациентов с АтД изменен КБ по всему кожному покрову вне зависимости от наличия высыпаний [12] и отмечено повышение ТЭПВ [13,14]. Позже исследователи оценили изменения значений ТЭПВ в ответ на постепенную контролируемую механическую травматизацию РС: с использованием первоначально наждачной бумаги, а затем и метода «снятия ленты». Данная оценка КБ теперь называется анализом целостности РС [15–17]. На основании этих и других результатов исследований ультраструктурные и биохимические характеристики РС у пациентов с АтД стали предметом пристального изучения во всем мире.
Нарушения КБ при АтД
Барьерную функцию кожи обеспечивают кератиноциты и водно-липидная пленка (мантия) на поверхности. Кератинизация представляет собой процесс, при котором происходит миграция кератиноцитов через слои эпидермиса с последующими изменениями их строения и состава. При перемещении кератиноцитов через шиповатый и ЗС образуются пластинчатые тельца (ламеллярные тельца – ЛТ, гранулы Орланда) и кератогиалиновые гранулы. ЛТ содержат липиды, гликосфинголипиды, свободные стеролы, фосфолипиды, холестерин и катаболические ферменты, из которых формируются межклеточные липиды [18, 19]. ЛТ ответственны за межклеточную адгезию и полярность эпителия, тем самым регулируя диффузию воды, растворенных веществ и макромолекул. На поверхности всех типов эпителия (например, в кишечнике, дыхательных путях, мочеполовой системе) ЛТ контролируют парацеллюлярный поток (т.е. прохождение молекул через межклеточное пространство между соседними клетками) и проницаемость эпителия (т.е. селективную проницаемость барьера, ограничение проникновения патогенных молекул). ЛТ также участвуют в создании полярности клеточной мембраны. У пациентов с АтД наблюдается увеличенное число именно интактных ламелярных (пластинчатых) телец в самых верхних клетках ЗС. Сообщалось, что у пациентов с АтД имеются наследственные изменения в генах и различные приобретенные дефекты ЛТ [20].
Кератогиалиновые гранулы в ЗС эпидермиса содержат профилаггрин, лорикрин и кератиновые промежуточные филаменты (кератин 1 и 10) [18]. Совместно с молекулами адгезии (десмоглеин 1 и десмоколин 1) и цитоплазматическими якорными белками (плакоглобин, плакофилин, десмоплакин) промежуточные филаменты участвуют в формировании корнеодесмосом, представляющих собой межклеточные контакты, обеспечивающие структурную целостность слоев кожи и предохраняющие глубоколежащие слои от высыхания. Считается, что при АтД нарушено формирование корнеодесмосом, что приводит к увеличению инфильтрации кожи воспалительными клетками, повышению десквамации и ТЭПВ, способствует возникновению зуда.
Миграция кератиноцитов из ЗС в РС приводит к потере клетками ядер, внутрицитоплазматических органелл и сопровождается замещением плазмолемм нерастворимым белковым матриксом и формированием корнеоцитов [21]. В исследовании M. Yokouchi et al. изучали влияние формы клеток ЗС, содержащих ЛТ. Было предположено, что именно модель уплощенного тетракаидекэдра Кельвина (f-TKD) позволяет кератиноцитам ЗС поддерживать гомеостаз КБ в здоровой коже [22]. Комплекс эпидермальной дифференцировки (КЭД) представляет собой участок хромосомы, расположенный в 1q21.3, который содержит более пятидесяти генов, кодирующих белки, экспрессирующиеся при поздней дифференцировке кератиноцитов [23]. Сюда входят гены белков лорикрин, инволюкрин и небольших пролинбогатых белков (SPRR), а также гены, кодирующие кальций-связывающие белки семейства S100A, филаггрин и трихогиалин [24]. В 2005 г. H. Sugiura et al. при анализе ДНК идентифицировали сниженную экспрессию генов филагрина и лорикрина, повышенную регуляцию S100A7 и A8 в коже пациентов с АтД [25]. Другие исследования подтвердили и расширили это наблюдение, продемонстрировав нарушение регуляции ряда генов КЭД как в пораженной, так и в непораженной коже пациентов с АтД.
Мутации филаггрина являются наиболее изученной генетической детерминантой при АтД. Филаггрин связывается с кератином 1-го и 10-го типов и кератиновыми филаментами, образуя тесные связи и «сжимая» клетки ЗС эпидермиса в плоские безъядерные корнеоциты [26]. Также филаггрин наряду с гидрофильными субстанциями в РС ответственны за синтез натурального увлажняющего фактора, стабилизируя водный баланс РС, препятствуя трансэпидермальной потере воды, колонизации патогенов, проникновению токсических веществ и аллергенов [27]. При мутациях в гене филаггрина отмечается и аномальная морфологическая дифференцировка корнеоцитов [28]. Однако и другие мутации генов, таких как КЭД (FLG2, SPRR3, LELP1), приводят к нарушению КБ [29].
Считается, что соотношение липидов и белков в РС, толщина РС также играют важную роль в формировании КБ и препятствуют повышенной ТЭПВ [30]. Благодаря высокому содержанию в эпидермисе липидов через него проникают жирорастворимые вещества, а для воды и водных растворов он практически непроницаем. В дополнение к дефектам белков РС в коже больных АтД в ряде исследований выявлены и липидные аномалии. Как синтез, так и организация эпидермальных липидов имеют решающее значение для поддержания оптимальной функции КБ. Липиды РС на 25% состоят из холестерина, на 25% из свободных жирных кислот и на 50% из церамидов с меньшим количеством сульфата холестерина и фосфолидов [1].
Бердышев и соавт. продемонстрировали повышенную долю короткоцепочечных церамидов, церамидов сфингозина (не являющихся гидроксильными жирными кислотами и состоящих из жирных кислот с углеродной цепью в диапазоне от 14 до 24), сфингомиелинов и лизофосфатидилхолинов и сниженную долю длинноцепочечных жирных кислот в коже при АтД по сравнению с контролем [31]. При нарушениях синтеза физиологических липидов в форме полиненасыщенных жирных кислот, а соответственно, при нарушении синтеза церамидов происходит увеличение бактериальной обсемененности кожи Staphylococcus aureus, снижение антиоксидантной функции [32].
Другим патофизиологическим механизмом нарушения барьерной функции кожи, описанным при АтД, является повышенная плотность интраэпидермальных нервных волокон на фоне воспаления, участвующих в формировании зуда. Исследования in vitro показали, что кератиноциты при АтД продуцируют высокие уровни нейронного фактора роста, увеличивая «разрастание» иммунореактивных нервных волокон. Рост эпидермальных нервных волокон способствует повышенному высвобождению и стимуляции белка, схожему с геном кальцитонина (CGRP), экспрессируемого в кератиноцитах, что приводит к утолщению эпидермиса [33].
Таким образом, при АтД нарушение КБ является генетически детерминированным и пациенты с АтД должны использовать в т.ч. средства, восстанавливающие структурно-функциональную целостность КБ. Многочисленные исследования в настоящее время направлены на разработку высокоэффективных увлажняющих наружных средств, способных восстанавливать барьерную функцию кожи, снижать ксероз и ТЭПВ у пациентов с АтД [30].
Эмоленты при АтД
Современные клинические рекомендации по терапии больных АтД включают обязательное использование специализированной дерматокосметики – эмолентов (сила рекомендаций А) – вне зависимости от степени тяжести процесса и периода заболевания (обострение, ремиссия). При обострении АтД эмоленты назначают в составе комплексной терапии, в период обострения используют в моноварианте.
В 2020 г. в рекомендациях по диагностике и лечению АтД Европейское общество дерматологов впервые указало на необходимость использования увлажняющих средств с дополнительными ингредиентами (антибактериальными, противозудными и пр.), т.н. эмолентов плюс. Примером таких высокоэффективных и оптимальных препаратов могут быть средства дерматокосметики, специально разработанной для пациентов с АтД – Atopi Control (см. таблицу).
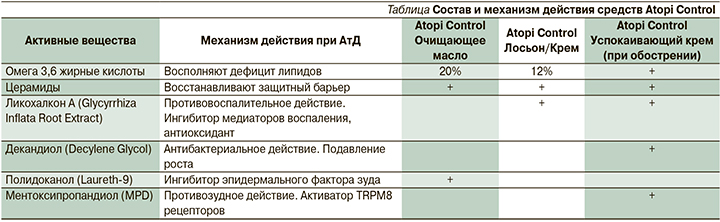
Формула данных средств состоит из уникального комплекса активных веществ: ликохалкон А успокаивает кожу, декандиол оказывает антибактериальное действие, метоксипропандиол купирует зуд. Этот комплекс в сочетании с высокой концентрацией церамидов восстанавливает нарушенный КБ у пациентов с АтД, обладая патогенетически направленным действием на воспаление и зуд (см. таблицу). Линейка дерматокосметики Atopi Control включает очищение (очищающее масло для душа), лосьон, крем (для взрослых, детей и младенцев) и успокаивающий крем (SOS крем).
В ряде исследований показана высокая эффективность средств Atopi Control в лечении АтД. Так, в многоцентровом исследовании (Венгрия, 2018) 320 пациентов с АтД в фазе обострения (возраст: 0–12 лет, 40%; 13–65 лет, 60%) использовали успокаивающий крем Atopi Control на очаги поражения 2 раза в сутки 2 недели (29% с лекарственной терапией). Подтвердили значительное уменьшение зуда 87% пациентов, при этом индекс SCORAD (Scoring of Atopic Dermatitis) снизился на 59% [34]. В другом исследовании показано, что нанесение Atopi Control успокаивающего крема 2 раза в сутки 2 недели аналогично с 1%-ным гидрокортизоном и приводит к значительному снижению выраженности клинических проявлений АтД, а также к улучшению барьерных функций кожи, элиминации S. aureus на пораженных участках кожи [35]. В многоцентровом исследовании (Эстония, Литва, Италия, Германия, 2016 2018) 692 пациента с АтД в фазе обострения использовали лосьон на все тело и успокаивающий крем Atopi Control локально 2 раза в сутки 2 недели. Индекс SCORAD снизился на 61%, зуд уменьшился на 48% [36]. Показана и профилактическая направленность применения лосьона Atopi Control. Так, 26 пациентов с АтД в период ремиссии использовали лосьон Atopi Control 2 раза в сутки на локтевом сгибе одной руки, на второй – базовый эмолент на протяжении 12 недель. Отмечено в 2 раза меньше обострений и снижение выраженности симптомов при обострении [37]. Таким образом, эмоленты Atopi Control обладают доказанной эффективностью при обострениях АтД и профилактической направленностью, что обусловливает целесообразность их применения у пациентов с АтД.
Методы
Под наблюдением находилось 27 пациентов с атопическим дерматитом в стадии обострения в возрасте от 10 до 48 лет (средний возраст 16,2±4,3 года) с выраженной симметричной эритемой и зудом на предплечьях (модифицированный индекс локального поражения SCORAD 10,0±2,0). Всем пациентам в соответствие с клиническими рекомендациями был назначен топический кортикостероид (2 класса активности), лосьон Atopi Control1 2 раза в день на правое предплечье и базовый эмолент2 2 раза в день на левое предплечье. После снятия обострения (через 2 недели) ГКС был отменен, и пациенты продолжили использовать эмоленты в течение 12 недель. Фиксировалось количество рецидивов и выраженность симптомов при каждом обострении (локальный SCORAD) на правой и левой руке с учетом наличия эритемы, экссудации, сыпи, экскориации, лихенизации и сухости кожи. Интенсивность зуда в исследуемой области оценивалась пациентами с помощью визуальной аналоговой шкалы (ВАШ) от 0 (отсутствие зуда) до 10 (сильнейший зуд).
Анализ и обработка статистических данных выполнялись c использованием пакета программ STATISTICA 10.0 и применением методов математической статистики
Результаты
У всех пациентов отмечалась положительная динамика в отношении купирования клинических симптомов АтД (рисунок).
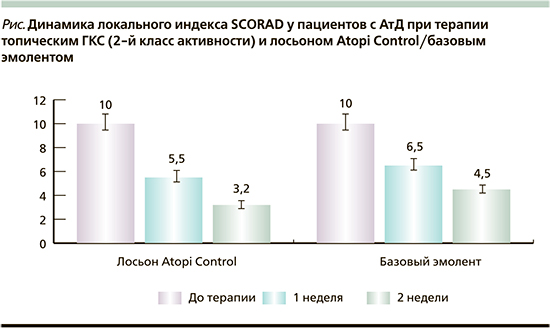
В результате терапии через 2 недели индекс локального SCORAD снизился на 68%. В контрольной области (нанесение базового эмолента) снижение локального SCORAD через 2 недели cоставило –45%.
У 25 пациентов (92,6%) в течение 12 недель по крайней мере на одной руке наблюдался рецидив АД. Итоговое число рецидивов – 30 случаев, из них 8 случаев при использовании лосьона Atopi Control и 22 случая при использовании базового эмолента; разница оказалась значительной (p <0,01) и соответствовала 64% снижению частоты рецидивов при использовании лосьона Atopi Control.
Выраженность зуда при обострении по ВАШ также была достоверно ниже в группе Atopi Control. Все пациенты отметили комфортность применения средств Atopi Control и отличные органолептические свойства, при этом 30% испытуемых отметили неприятные ощущения жирности и липкости при использовании базового эмолента.
Заключение
Таким образом включение в терапию средств Atopi Control обеспечивает контроль над течением АД: позволяет быстрее добиться уменьшения симптомов заболевания при обострении, снизить количество рецидивов и их выраженность.
Конфликт интересов. Соколовская Ю.А. – сотрудник Beiersdorf AG. Остальные авторы заявляют об отсутствии конфликта интересов.



