Введение
В Российской Федерации, как и во всем цивилизованном мире, среди причин смертности традиционно лидируют сердечно-сосудистые заболевания: ишемическая болезнь сердца (ИБС), артериальная гипертензия и нарушения мозгового кровообращения. На протяжении 2012–2019 гг. в стране наблюдалась устойчивая тенденция к снижению смертности от инфаркта миокарда, однако в 2020 и 2021 гг. она снова стала расти. Подобную отрицательную динамику во многом можно объяснить последствиями пандемии новой коронавирусной инфекции [1–3].
Острый коронарный синдром
ИБС в течение многих лет была и остается одной из наиболее актуальных проблем современной кардиологии. Основной причиной госпитализаций при данном заболевании является развитие острого коронарного синдрома (ОКС). Этим термином обозначают любую группу клинических признаков или симптомов, позволяющих подозревать острый инфаркт миокарда (ИМ) или нестабильную стенокардию (НС). ОКС представляет собой предварительный диагноз, выставляемый в первые часы и сутки заболевания, когда специалист еще не располагает достаточными диагностическими данными для окончательного суждения о наличии или отсутствии очагов некроза в миокарде [4, 5]. Развитие ОКС в большинстве случаев считается следствием тромбоза коронарных артерий, что делает его абсолютным показанием к назначению антитромботических препаратов – антиагрегантов и антикоагулянтов [6, 7].
Фармакологическая группа антикоагулянтов прямого действия для парентерального введения представлена нефракционированным гепарином (НФГ), низкомолекулярными гепаринами (НМГ), фондапаринуксом натрия.
Гепарин
Исторически гепарин стал первым лекарственным препаратом группы антикоагулянтов прямого действия. Свое название это соединение получило от греческого слова «hepar» – печень. Это связано с тем, что в 1916 г. данная субстанция с выраженной противосвертывающей активностью была выделена из печеночной ткани. Открытие совершил студент-медик Джей Мак Лин (Jay Mac Lean) в период стажировки у профессора Хоувелла (Howel) университета Джона Гопкинса в ходе экспериментальных научных изысканий. В настоящее время при производстве гепарина для лечебных целей в качестве сырья используют слизистую оболочку кишечника свиней, а также легочную ткань крупного рогатого скота [8, 9]. В 1920-х гг. предпринимались попытки применения гепарина в клинической практике – испытания на добровольцах проводились врачом Массоном (Детройт). И лишь спустя более 20 лет с момента его открытия в преддверии Второй мировой войны гепарин становится полноправным лекарственным препаратом для лечения тромботических осложнений [8, 10].
Гепарин – это линейный гетерополисахарид, который состоит в основном из чередующихся остатков a-Dглюкопиранозилуроновой (глюкуроновой) кислоты и 2-сульфамино-2дезокси-a-D-глюкопиранозы (сульфатированного N-ацетилглюкозамина), связанных a-1,4-гликозидными связями. Кроме сульфатных групп в структуре молекулы гепарина присутствуют также и сульфоэфирные группы. На каждый тетрасахаридный фрагмент приходится приблизительно 5 остатков серной кислоты. Сульфатированные остатки глюкозамина и глюкуроновой кислоты имеют разную длину полимерной цепи и разную молекулярную массу от 2000 до 50000 дальтон [9, 10]. Молекула гепарина имеет полианионный характер, о чем говорит масса отрицательно заряженных групп, расположенных по ходу линейных полимеров. Вследствие этого соединение обладает выраженным отрицательным зарядом. Этим обусловлена способность гепарина образовывать комплексы с определенными белками, что сопровождается изменением их биологической активности [9].
Механизм антикоагулянтного действия гепарина основывается на связывании с антитромбином III (AT-III), который служит физиологическим ингибитором активированных факторов свертывания крови: IХа, Ха, XIa, XIIa и тромбина. Образование комплекса с гепарином повышает активность AT-III примерно в 700 раз. Максимальное ингибирующее действие гепарина отмечается в отношении IIa(тромбин) и Xa-факторов [11, 12]. Высокая аффинность гепарина к АТ-III объясняется уникальной пентасахаридной последовательностью, присутствующей всего лишь примерно в трети всех молекул гепарина. Таким образом, при терапевтических концентрациях, применяемых в клинической практике, почти 2/3 гепарина проявляет минимальную антикоагулянтную активность. Для связывания тромбина гепарин должен сформировать «мост», соединяющий АТ-III и тромбин, в то же время для подавления функции фактора Ха такого взаимодействия не требуется. Молекулы гепарина с числом сахаридных единиц менее 18 не способны одновременно связывать тромбин и АТ-III, а следовательно, не могут катализировать ингибицию тромбина. Фракции гепарина с меньшим числом сахаридов способны катализировать ингибицию фактора Ха, при этом АТ III обеспечивает высокую аффинность пентасахаридной последовательности. НФГ не способен ингибировать фактор Ха, связанный с тромбоцитами [12, 13]. Метаболизируется НФГ преимущественно печенью, около 20% выводятся почками. При дозе 100 ЕД/кг период полувыведения T1/2 составляет около 1 часа, при более высоких дозах его содержание снижается нелинейно. Выраженность антикоагулянтного эффекта зависит от пути введения препарата. При инфузионном введении эффект развивается сразу же, поддерживается непрерывно на необходимом уровне. При прекращении введения или уменьшении его скорости эффект НФГ быстро угасает. При болюсном внутривенном введении действие препарата длится 4–5 часов, а после подкожной инъекции эффект развивается через 40–60 минут и продолжается 8–12 часов.
Для обеспечения системного действия гепарин вводят подкожно или внутривенно. Внутримышечное введение противопоказано, т.к. существует высокий риск образования гематом [14, 15]. Внутривенная инфузия НФГ должна осуществляться в дозе, обеспечивающей удлинение активированного частичного тромбопластинового времени (АЧТВ) в 1,5–2,5 раза по сравнению с контрольным для данной лаборатории. При использовании НФГ во время чрескожного коронарного вмешательства (ЧКВ) рекомендуется ввести внутривенно болюсом 70–100 МЕ/кг. Необходимость повторных болюсов определяется величиной активированного времени свертывания крови [16].
К достоинствам НФГ можно отнести быстроту и непродолжительность действия, возможность нейтрализации протамина сульфатом, многолетний опыт его клинического использования. В то же время у НФГ можно отметить следующие недостатки:
1. Относительно низкая биодоступность при подкожном введении – 15–20%.
2. Быстрая элиминация из организма, что требует частого введения препарата в течение суток.
3. Высокий риск геморрагических осложнений, обусловленный низкой селективностью влияния гепарина на факторы свертывания крови. Неспецифичность действия в отношении ключевых факторов свертывания способствует высокому риску развития избыточной гипокоагуляции на фоне применения препарата.
4. Необходимость мониторирования показателя АЧТВ при использовании лечебных доз препарата. Подбор дозы гепарина требует постоянного проведения лабораторного контроля показателей свертывающей системы. При непрерывной инфузии гепарина натрия АЧТВ определяют каждые 4 часа вплоть до достижения целевого уровня показателя, в дальнейшем – каждые 6 часов. При подкожном пути введения рекомендован контроль АЧТВ через 4–6 часов после инъекции с последующей коррекцией дозы при необходимости. При профилактическом подкожном введении малых доз гепарина (5000 МЕ 2–3 раза в сутки) контроль АЧТВ не обязателен.
5. Высокая вариабельность и относительная «непредсказуемость» клинического эффекта. При этом непрерывная внутривенная инфузия на сегодняшний день считается наиболее эффективным способом применения гепарина, т.к. обеспечивает более стабильную гипокоагуляцию и реже вызывает кровотечения.
6. Возможность развития иммунной тромбоцитопении с парадоксальным повышением опасности тромбозов. Тромбоцитопения, вызванная гепарином, не зависит от дозы и способа введения препарата. Данное осложнение можно заподозрить в случае снижения тромбоцитов ниже 80×109/л, или более чем на 50% от исходного уровня. Такая ситуация требует отмены гепарина натрия. При необходимости в антитромботической терапии далее следует использовать другие препараты.
7. Высокий риск развития остеопороза при длительном применении.
8. «Реактивация» гиперкоагуляции после одномоментного прекращения введения лечебных доз гепарина. Связанный с этим высокий риск тромбоза требует постепенной отмены препарата, что достигается снижением разовой дозы с сохранением кратности введения [11–14].
Фракционированные низкомолекулярные гепарины (НМГ)
Недостаточная избирательность действия в отношении плазменных факторов свертывания крови и связанная с этим вариабельность клинического эффекта – наиболее значимые недостатки НФГ. Посредством химической либо ферментативной деполимеризации НФГ удалось выделить фракции с меньшей длиной полисахаридных цепей и, соответственно, с меньшей молекулярной массой. Таким образом был создан новый класс антикоагулянтов – НМГ. История их клинического применения насчитывает около 20 лет [13].
Первым препаратом в данной группе стал надропарин, который применяется в клинической практике с 1985 г. Далее были созданы дальтепарин, эноксапарин и другие НМГ. Изначально НМГ применяли с целью предупреждения венозных тромбозов при тромбоэмболии легочной артерии и у больных, имеющих высокий риск развития тромбозов (в т.ч. после операций) [17–19].
Различные НМГ имеют среднюю молекулярную массу 4000–7000 Да и различаются диапазоном распределения полисахаридных цепочек (табл. 1). Молекулярная масса определяет степень аффинности того или иного соединения к определенным факторам свертывания крови. Фракции ниже критической длины (молекулярная масса <5400 Да) в большей степени проявляют антагонизм по отношению к активированному фактору свертывания крови Xа (анти-Xa активность). Молекулярная масса более 5400 Да (эквивалентно наличию более 18 дисахаридных остатков) приводит к проявлению антагонизма в отношении как Ха (анти-Xa), так и IIа (анти-IIа) активированных факторов, как это имеет место у НФГ. Соотношение анти-Ха/ анти-IIа-активности для НФГ составляет около 1:1, а для НМГ – обычно в интервале 2:1–5:1 [13, 19].

Молекулярная масса фракций ниже критической не только влияет на избирательность в отношении факторов свертывания крови, но и обусловливает более продолжительный период полувыведения и бóльшую биодоступность после подкожного введения по сравнению с высокомолекулярными фракциями.
НМГ почти полностью всасываются при подкожном пути введения (биодоступность составляет более 90%), проявляют линейную фармакокинетику, а также стационарный объем распределения и процессы клиренса. Объем распределения НМГ близок к объему циркулирующей крови. Биотрансформация НМГ частично происходит путем десульфатации и деполимеризации. Препараты НМГ различаются по степени их непочечного клиренса, что приводит к различиям в показателе периода полувыведения и относительной биодоступности. НМГ по сравнению с НФГ отличаются большей продолжительностью действия и более длительным периодом полувыведения, что позволяет их использовать 1–2 раза в сутки [12–14]. Экскреция лишь незначительно изменяется у пациентов с тяжелой почечной недостаточностью (при клиренсе креатинина менее 15 мл/мин) в случае применения в профилактических дозах. При беременности введение профилактических доз НМГ приводит к очень незначительному проникновению их через плаценту [20–22].
НМГ по сравнению с НФГ меньше связываются с плазменными белками и мембранами эндотелиальных клеток, способными нейтрализовывать их антитромботическую активность. Характерно также, что НМГ в отличие от НФГ способны ингибировать в т.ч. и фактор Ха, связанный с тромбоцитами.
Необходимо отметить, что противосвертывающий эффект НМГ связан не только с анти-Ха-активностью препаратов. Значительная часть антитромботического эффекта осуществляется через высвобождение ингибитора внешнего пути свертывания (TFPI), а также высвобождение из эндотелия простациклина и пр. Каскадом дополнительных эффектов объясняется продолжение антитромботического действия препаратов в течение суток после введения препарата, в то время как анти-Ха-активность через 12 часов уже не определяется. Применение НМГ способствует также активации фибринолиза путем освобождения из эндотелия тканевого активатора плазминогена t-РА. Препараты данной группы меньше подвержены действию антигепаринового фактора 4 тромбоцитов и, соответственно, реже вызывают иммунную тромбоцитопению [23–25].
При подробном рассмотрении механизма действия НМГ становится понятным, что их эффект нельзя оценивать по времени свертывания крови, АЧТВ и другим показателям, отражающим эффективность НФГ. Определение АЧТВ лишь частично характеризует антитромботическую активность НМГ. Оценку антикоагулянтного эффекта НМГ наиболее целесообразно проводить по анти-Хаактивности в плазме крови. В основе теста определения анти-Ха-активности лежит хромогенная аналитика. При проведении исследования происходит выделение специфического красителя после реакций связывания гепарина (НМГ) с антитромбином III и активированным фактором Х (фХа) [26]. Тест является высокочувствительным и специфичным, позволяет точно установить недостаточную или избыточную концентрацию НМГ в плазме крови человека, представляющих опасность развития либо тромботических событий, либо кровотечений. Рутинная стоимость единичного определения анти-Ха-активности примерно в 1,5–2,0 раза ниже стоимости количественного теста «Ддимер» [27]. Для пациентов, получающих НМГ, данный анализ является одним из базовых методов оценки эффективности терапии. Обычно исследование проводят спустя 3–4 часа после введения антикоагулянта [26].
В последнее время пристальное внимание уделяется изучению влияния НМГ на процессы воспаления. Это открывает новые возможности в плане лечения воспалительных заболеваний кишечника, аутоиммунных, сердечно-сосудистых и других заболеваний. Так, НМГ обладают способностью ингибировать лейкоцитарно-эндотелиальные взаимодействия, являющиеся ключевым звеном процессов воспаления. НМГ проявляют антицитокиновую активность – подавляют продукцию провоспалительного цитокина фактора некроза опухоли-α (ФНО-α). НМГ способны подавлять и экспрессию тканевого фактора TF, индуцированную под влиянием провоспалительных цитокинов (ФНО-α, интерлейкина-1b – ИЛ-1b). Доказано также, что гепарины обладают способностью блокировать взаимодействие лейкоцитов помощи Р-селектинов с сосудистой стенкой, что является ключевым этапом воспалительного ответа. При этом препараты НМГ обладают более высокой противовоспалительной активностью по сравнению с НФГ [23–25, 28–29].
При выборе режима дозирования препарата НМГ необходимо ориентироваться прежде всего на массу тела больного. Так, в исследованиях показано, что при четком следовании инструкции при выборе дозы эноксапарина в соответствии с массой тела частота больших кровотечений при нормальной функции почек составляет менее 1%, при ХБП – 2,4%, при ХБП с клиренсом креатинина менее 30 мл/мин – 5% [30]. Однако в реальной клинической практике нередко происходит отклонение от рекомендуемых доз препаратов НМГ. При назначении препарата эноксапарин без взвешивания пациента вероятность ошибки в дозировании препарата составила 42,2% по сравнению с пациентами, которым масса тела измерялась (ошибка составила 24,5%; p<0,001). Исследование было проведено с участием 1944 пациентов [31]. Также показано, что при применении эноксапарина с отклонением дозы препарата более чем на 10% от рекомендуемой происходит увеличение частоты кровотечений до 17%, «больших» кровотечений – до 4% [32].
Помимо массы тела пациента при выборе режима дозирования необходимо учитывать функцию почек, сопутствующую патологию. Так, в ситуациях онкологического заболевания, инфекции COVID-19 часть дозы НМГ с учетом плейотропности действия будет потребляться этими процессами.
Лечебная доза эноксапарина составляет 1 мг/кг каждые 12 часов. В случае пограничной функции почек некоторые авторы предлагают дозировать эноксапарин более точно. Данная схема дозирования может рассматриваться в очень избранных ситуациях (при мониторинге уровней анти-Ха). При уровне СКФ >50 мл/мин эноксапарин назначается по 1 мг/кг каждые 12 часов, при уровне СКФ 40–50 мл/ мин – 0,6 мг/кг каждые 12 часов, при уровне СКФ 30-40 мл/мин – 0,5 мг/кг каждые 12 часов, при уровне СКФ 20–30 мл/мин можно рассмотреть возможность введения 0,4 мг/кг каждые 12 часов [33]. Мониторинг анти-Хаактивности позволяет более тщательно подбирать дозу эноксапарина натрия (табл. 2) [34].
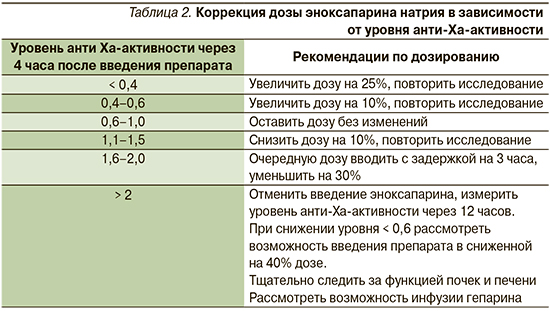
НМГ дозируются в международных единицах (МЕ) активности в отношении Xa-фактора. Препараты имеют минимальный риск рикошетного усиления тромбообразования. По сравнению с НФГ НМГ при длительном применении реже вызывают тромбоцитопению и имеют низкий риск развития остеопороза. Дальнейшее повышение безопасности и эффективности НМГ связано с уменьшением их молекулярной массы и обеспечением однородности полисахаридных цепей [21].
Несмотря на сходные формы выпуска НМГ, необходимо помнить, что эти препараты не взаимозаменяемы. Смена одного лекарственного средства на другое может способствовать развитию геморрагических осложнений. Кроме того, для каждого препарата существует собственная схема режима дозирования для различных клинических ситуаций, поэтому замена препаратов с определением эквивалентных доз различных НМГ на основании их анти-Хаактивности недопустима [13, 19, 21].
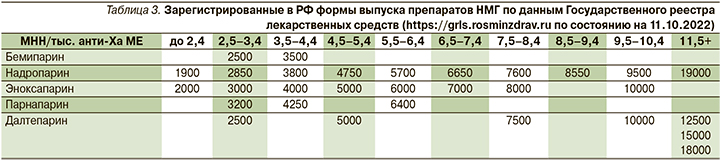
Наиболее широкую линейку дозировок имеют эноксапарин натрия и надропарин кальция (табл. 3).
Антикоагулянты при ОКС
Согласно современным клиническим рекомендациям, пациентам с ОКС в начале лечения рекомендуется тройная антитромботическая терапия (сочетание ацетилсалициловой кислоты, ингибитора P2Y12-рецепторов тромбоцитов и антикоагулянта). Антикоагулянты назначают с целью снижения риска неблагоприятного исхода (сумма случаев смерти и развития ИМ) и вводят парентерально. Применение антикоагулянтов прямого действия рекомендуется вплоть до 8-х суток с более ранней отменой после успешного чрескожного коронарного вмешательства (ЧКВ) или при быстрой выписке, если нет иных показаний к продленной антикоагулянтной терапии [6, 7, 14].
НМГ не имеют преимуществ перед НФГ по способности снижать риск развития ИМ и смерти пациентов с НС и ИМ без зубца Q. В то же время НМГ отличаются простотой применения: вводятся подкожно в фиксированной дозе, не требуя применения инфузионного насоса и лабораторного контроля. Для эноксапарина показано преимущество перед НФГ по уменьшению риска развития суммы «коронарных событий» (смерть, ИМ, рецидив стенокардии) и частоты экстренных операций реваскуляризации миокарда [35–37]. В то же время длительное применение НМГ увеличивает риск кровотечений.
Тактика дозирования НМГ для лечения ОКС, ИМ:
- Дальтепарин натрия – 120-анти-Ха ЕД/кг (максимально 10000 анти-Ха ЕД/кг) подкожно каждые 12 часов.
- Эноксапарин натрия – 1 мг/кг (100 анти-Ха ЕД/кг) подкожно каждые 12 часов. Непосредственно перед первой подкожной инъекцией можно ввести внутривенно болюс в 30 мг (3000 анти-Ха ЕД).
- Надропарин кальция – внутривенно болюс 86 анти-Ха ЕД/кг, сразу за этим подкожно 86 анти-Ха ЕД/кг каждые 12 часов [6, 7].
Надропарин кальция
Надропарин кальция исторически был первым препаратом группы НМГ. Препарат обладает как немедленной, так и продленной антитромботической активностью. По сравнению с НФГ надропарин кальция обладает меньшим влиянием на функции тромбоцитов и их способность к агрегации [13, 21, 25].
Биодоступность надропарина при подкожном введении составляет около 98%. После внутривенного введения препарата максимальная анти-Хаактивность достигается менее чем через 10 минут, T1/2 составляет около 2 часов. После подкожного введения T1/2 составляет около 3,5 часа. Однако антитромботическая активность сохраняется в течение минимум 18 часов [13, 37]. Показано, что надропарин эффективен и безопасен для пациентов, получающих постоянную заместительную почечную терапию по поводу почечной недостаточности [38–40].
Надропарин показал способность оказывать антиоксидантное и противовоспалительное действия. В ряде исследований выявлено также ингибирующее действие надропарина на прогрессирование опухолей. Этот эффект не имеет прямой связи с антитромботическим действием препарата. Известно, что НФГ и НМГ играют важную роль в функции эндотелиоцитов и способны модулировать активность ангиогенных факторов роста. При этом антипролиферативное действие надропарина более выраженно, чем при использовании, например, дальтепарина и фондапаринукса [24, 27, 43–45].
В исследованиях Xibing Zhuang et al. показано, что in vivo комбинированное применение надропарина и фракционированного облучения оказывает выраженное синергетическое противоопухолевое действие [46, 47]. Это может быть связано с активизацией процессов апоптоза, ингибированием секреции трансформирующего фактора роста TGF-β1 (transforming growth factor β1), ИЛ-6 и подавлением CD34.
Одним из современных препаратов надропарина кальция, широко применяемым в клинической практике, является Детромбин. Применение надропарина кальция (Детромбина) показано при следующих клинических ситуациях [48]:
- профилактика тромбоэмболических осложнений при общехирургических и ортопедических вмешательствах, пациентам с высоким риском тромбообразования (при острой дыхательной недостаточности и/ или респираторной инфекции, и/ или сердечной недостаточности), находящимся на постельном режиме в связи с острой терапевтической патологией или госпитализированных в отделения реанимации или интенсивной терапии;
- лечение тромбоэмболии легочной артерии средней/тяжелой степени или проксимального тромбоза глубоких вен нижних конечностей;
- профилактика свертывания крови во время гемодиализа;
- лечение НС и ИМ без зубца Q.
Кроме того, препарат включен во временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Версия 16 от 18.08.2022 [49].
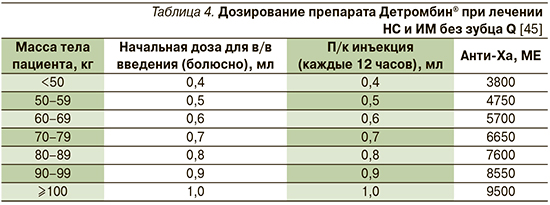
При НС и ИМ без зубца Q начальная доза надропарина вводится внутривенно болюсно однократно, последующие дозы вводятся подкожно (табл. 4). Оптимальный участок для подкожных инъекций – 5–6 см справа или слева от пупка [48–51].
Заключение
Таким образом, антикоагулянты прямого действия парентерального введения являются препаратом выбора для проведения антитромботической терапии при НС и ИМ. НФГ имеет ряд недостатков, в связи с чем предпочтение зачастую отдается НМГ. Надропарин кальция – первый препарат данной группы, нашедший применение в клинической практике. Помимо собственно антикоагулянтного эффекта препарат обладает способностью подавлять ангиогенез, воспалительные процессы, замедлять прогрессирование злокачественных новообразований. Наряду с другими НМГ препарат надропарина кальция Детромбин может быть использован как для профилактики, так и для лечения тромботических осложнений, в т.ч. в кардиологической практике.


