Обоснование
Увеличением числа смертельных случаев при гипоксических состояниях определяется необходимость использования более эффективной антигипоксической инфузионно-трансфузионной терапии, способной защищать организм от осложнений, вызываемых недостатком кислорода [1, 2].
Основополагающим фактором терапии гипоксических состояний является разработка и внедрение в медицинскую практику средств, способных корригировать нарушения энергетического обмена и их последствия, тем самым повышать устойчивость клеток, органов и организма в целом к недостатку кислорода и другим воздействиям, нарушающим энергопродукцию.
Особое значение приобретают работы с использованием полисахаридов и биоэнергетических субстратов, которые помимо минимальной токсичности имеют антигипоксические, антиоксидантные и цитопротекторные свойства [3].
В институте химии растительных веществ им. акад. С.Ю. Юнусова (ИХРВ) АН РУз разработан полисахарид – биологически активное вещество из местного растительного сырья, способное регулировать жизнедеятельность клеток, восстанавливать нарушенные функции органов, обладающее антибиотической, противовирусной, противоопухолевой, антиоксидантной, дезинтоксикационной, антирадиационной, иммуностимулирующей активностью [4, 5]. С использованием полисахарида и биоэнергетического субстрата в Республиканском специализированном научно-практическом центре гематологии (РСНПМЦГ) Минздрава РУз разработан кровезаменитель реоамбрасол, способный защищать клетки от свободно радикального окисления и восстанавливать нарушенный энергетический обмен в клетках при гипоксии [6].
Цель исследования: оценить эффективность действия нового кровезаменителя реоамбрасола на содержание гипоксией индуцированного фактора (HIF-1α), перекисное окисление липидов (ПОЛ) и антиоксидантной системы (АОС) при токсической гипоксии.
Методы
Постановку модели токсической гипоксии осуществляли на 100 беспородных крысах-самцах. Модель острой гемической гипоксии воспроизводили однократным введением под кожу спины крыс 4%-ного раствора нитрита натрия в дозе 90 мг/кг. Выбор доз был обусловлен предварительным титрованием нитрита натрия, а также данными, опубликованными в работах авторов (Н.Ф. Иваницкая, 1976; Д.В. Срубилин, 2004; Р.К. Игбаев, 2006) [7].
Все животные, использованные в эксперименте, были разделены на следующие четыре равные группы: I (интактную) группу составили крысы (n=10), находившиеся на обычном лабораторном рационе. Животные, у которых вызывали гемическую гипоксию, через 48 часов после введения токсиканта были разделены следующим образом: II – контрольная группа, животные с токсической гипоксией без лечения (n=10); III – группа сравнени, крысы с токсической гипоксией после инфузии реополиглюкина (n=15); IV – опытная группа, ткрысы с токсической гипоксией после инфузии реоамбрасола (n=19). Таким образом, эффективность кровезаменителей при токсической гипоксии исследовали на 54 крысах.
Инфузионную терапию в III и IV группах проводили путем введения кровезаменителей в хвостовую вену крысам в дозе 5 мл/кг массы тела в течение 5 дней. Через 24 часа после заключительного введения препаратов для определения состояния монооксигеназной системы печени крыс ввели в гексеналовый сон по общепринятой методике, продолжительность которого определяли после подкожного введения 0,6%-ного водного раствора гексенала в дозе 60 мг/кг, которая отражает детоксицирующую функцию печени [8], и через 24 часа после него животных забивали под легким эфирным наркозом.
В плазме крови подопытных животных определяли содержание HIF-1α. Концентрацию HIF-1α определяли с помощью иммуноферментного анализа (ИФА, ELISA) с использованием набора для иммуноферментного исследования «Cloud-Clone corp.» (США), согласно инструкции, приложенной к набору. Измерения производили при длине волны 450 нм на микропланшетном фотометре MR96 (Mindray, Китай). Полученные результаты выражали в нг/мл.
В сыворотке крови определяли биохимические показатели с использованием тест-систем HUMAN (HUMAN Gmbh, Германия) на полуавтоматическом биохимическом анализаторе BA88A (Mindray, Китай) [9].
Интенсивность ПОЛ в сыворотке крови определяли по уровню малонового диальдегида (МДА) [10]. Определяли активность ферментов АОС: каталазы, супероксиддисмутазы (СОД) [11], глутатионредуктазы (ГР) и глутатионпероксидазы (ГП) [12]. Все измерения производили на спектрофотометре UNICO2800 (United Products and Instruments, Inc., США).
Статистическая обработка полученных данных производилась с использованием программ «Excel» и «Biostat 4.03». Критерием статистической значимости было значение p<0,05.
Результаты
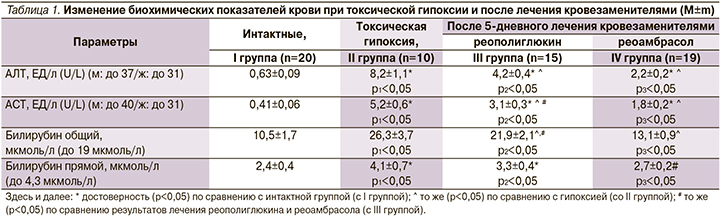
После введения нитрита натрия у животных наблюдалось развитие синдрома цитолиза (повышение в сыворотке крови крыс уровней аланинаминотрансферазы (АЛТ) и аспартат-аминотрансферазы (АСТ) в 13 и 12,7 раза соответственно и холестаза (увеличение общего билирубина в 2,5 и прямого в 4,1 раза) (р<0,05, табл. 1).
Концентрация HIF-1α в крови при токсической гипоксии возрастала в 6,4 раза (p1<0,05) (табл. 2).
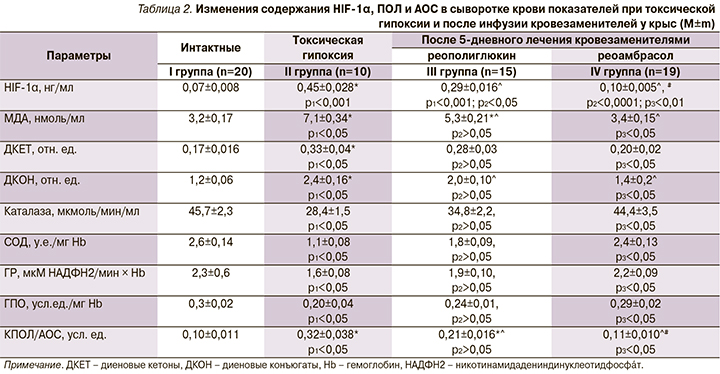
Интересные результаты, полученные при исследовании ПОЛ в крови (уровня МДА, диеновых конъюгатов и диеновых кетонов), показали увеличение как промежуточных, так и конечных продуктов ПОЛ (табл. 2). Так, в плазме МДА повысилось в 2,0 раза (p1<0,05), диеновые кетоны в 1,9 (p1<0,05), диеновые конъюгаты в 2,1 раза (p1<0,05). Гиперлипопероксидация может быть обусловлена дисбалансом в системе АОС. Для этой цели была изучена активность АОС в плазме крови. Активность ферментов системы АОС при гипоксии изменялась следующим образом: каталазы снижалась в 1,6 раза (p1<0,05), ГР понизилась в 1,4 (p1<0,05), глутатиоперкидазы (ГПО) в 1,5 (p1<0,05), СОД в 2,4 раза (p1<0,05).
Таким образом, введение нитрита натрия вызывает цитолиз, холестаз, гипоксию, активизацию процессов ПОЛ и истощение факторов антиоксидантной защиты в крови.
Введение крысам нитрита натрия приводило к гибели 50% животных (p1<0,05). Применение кровезаменителя реоамбрасола, содержащего полисахарид и биоэнергетический субстрат при интоксикации нитритом натрия, приводило к снижению смертности до 5% (p2<0,05), которая после применения реополиглюкина доходила до 25% (p3<0,05).
После введения кровезаменителя реоамбрасола происходило снижение уровня АЛТ в 3,7 раза (p2<0,05), а АСТ в 2,9 (p2<0,05), общего и прямого билирубина в 2,0 (p2<0,05) и 1,5 раза (p2<0,05) соответственно (табл. 1), по сравнению со II группой (токсическая гипоксия). При этом по сравнению со значениями данных биохимических показателей после введения реополиглюкина концентрация АЛТ была ниже на 47,6% (p3<0,05), АСТ на 41,9% (p3<0,05), общего билирубина на 40,2% (p3<0,05) и прямого билирубина – на 18,2% (p3<0,05).
Использование кровезаменителя реоамбрасола приводит к вымыванию токсических метаболитов нарушенного обмена веществ.
После применения реоамбрасола концентрация HIF-1α была ниже в 4,5 раза (p2<0,0001), что по сравнению с результатом, полученным после применения реополиглюкина, было ниже на 65,5% (p3<0,05).
Внутривенная инфузия реоамбрасола восстанавливает показатели ПОЛ и активирует ферменты системы АОС в крови. Показатели ПОЛ в крови после введения кровезаменителя реоамбрасола снизились. Так, содержание МДА, диеновых кетонов, диеновых конъюгатов в крови достоверно снижалось в 1,9 (p2<0,05), 1,7 (p2<0,05) и в 1,8 раза (p2<0,05) соответственно относительно значений животных после интоксикации. Причем они были ниже, чем после введения реополиглюкина, на 35,8% (p3<0,05), 28,6 (p3<0,05) и на 30,0% (p3<0,05) соответственно.
Происходила активация каталазы в 1,6 раза (p2<0,05), СОД в эритроцитах в 2,2 (p2<0,05), ГПО в 1,5 (p2<0,05) и ГР в 1,4 раза (p1<0,05) относительно группы животных с токсической гипоксией, в то время как по сравнению с эффектом от введения реополиглюкина активность каталазы была выше на 27,1% (p3<0,05), СОД на 33,3 (p3<0,05), ГР на 15,8 (p3<0,05) и ГПО на 20,8% (p3<0,05) (табл. 2).
Для всех животных проведен гексеналовый сон, характеризующий эффективность действия нового кровезаменителя. Так, после введения нитрита натрия продолжительность гексеналового сна увеличивалась в 4 раза по сравнению с интактными животными, а после инфузии реоамбрасола в 2 раза короче, в случае реополиглюкина в 1,4 раза по сравнению с интоксикацией.
Обсуждение
Таким образом, инфузия реоамбрасола влияла на структурно-функциональные параметры печени, что проявлялось замедлением процесса цитолиза, холестаза.
Применение кровезаменителей сказывалось на восстановлении детоксицирующей функции печени, что проявлялось ускорением метаболизма гексенала, и это приводило к уменьшению явлений эндогенной интоксикации.
Действие кровезаменителя реоамбрасола проявилось четко, было более эффективным по сравнению с реополиглюкином. Биологически активный состав, включающий полисахарид и биоэнергетический субстрат, обладает хорошими антигипоксическим, антиоксидантным, дезинтоксикационным, мембранопротекторным действиями, что позволяет рекомендовать его при различных гипоксических токсических состояниях.
Выводы
Созданный новый кровезаменитель реоамбрасол, содержащий полисахарид и биоэнергетический субстрат, восстановил структурно-функциональные параметры печени, что проявилось замедлением процесса цитолиза, холестаза при токсической гипоксии.
Новый кровезаменитель обладает антигипоксантным эффектом, снижая уровень гипоксия-индуцибельного фактора HIF-1α в 4,5 раза (p1<0,05).
Реоамбрасол обладает антиоксидантным действием, снижает интенсивность процессов ПОЛ и восстанавливает активность ферментов АОС.


