Введение
Острые респираторные вирусные заболевания (ОРВИ) – это большая этиологически разнородная группа инфекционных болезней, протекающих с поражением верхних и нижних дыхательных путей (ДП), имеющих определенное сходство патологических механизмов и клинической симптоматики: боль в горле, кашель, острый бронхит, риносинусит. ОРВИ – одно из наиболее часто встречающихся заболеваний в практике терапевта.
У взрослых «простуда» встречается от 4 до 6, у детей – от 6 до 8 раз в год; ОРВИ служит причиной 40% случаев временной нетрудоспособности, в 30% – причиной пропуска школьных занятий. На их долю приходятся миллионы дней, пропущенных на рабочих местах и в учебных заведениях, миллиарды долларов, затраченных на медицинскую помощь при кашле и лекарства от «простуды». Так, в 2005 г. в США траты на лечение только взрослых пациентов составили 1,94 млрд долл. [1].
Давно замечено, что в холодное время года (осенние/зимние месяцы) значительно увеличиваются заболеваемость, число госпитализаций и смертность от инфекций ДП (ОРВИ, грипп, «простуда») [2]. В свое время R. Eccles [3] предположил, что сезонное воздействие холодного воздуха вызывает рост заболеваемости ОРВИ именно за счет охлаждения верхних ДП (носо- и ротоглотки). Действительно, вдыхание холодного воздуха вызывает охлаждение эпителия верхних ДП. И этого может быть достаточно для подавления местных механизмов защиты эпителия от инфекции, особенно таких, как мукоцилиарный клиренс (МЦК), фагоцитарная активность лейкоцитов, продукция интерферона и т.д.
Одной из основных функций эпителия ДП является обеспечение биохимической и механической защиты слизистых оболочек ДП посредством секреции слизи и выведения ее согласованными движениями мерцательных ресничек. Тонкий слой жидкой слизи, который располагается на поверхности эпителия, находится в постоянном движении благодаря мерцательным движениям ресничек. Нормальная работа такого «мукоцилиарного эскалатора» (МЦК) обеспечивает очищение ДП и определяет чистоту слизистых оболочек. И только когда МЦК перестает выполнять роль первой линии защиты эпителия ДП от микробных и вирусных возбудителей, развивается инфекционно-воспалительный процесс. Известно, что вдыхаемый холодный воздух, охлаждение поверхности тела и холодовой стресс вызывают такие патофизиологические реакции, как сужение (спазм) сосудов слизистых оболочек ДП и последующее подавление иммунных реакций. Пораженные клетки эпителия выделяют цитокины, в т.ч. интерлейкины, количество которых коррелирует как со степенью привлечения фагоцитов в подслизистый слой и эпителий, так и с выраженностью симптомов [4]. Иммунный ответ на инфекцию чаще, чем повреждение слизистой оболочки ДП, служит главным фактором развития симптомов ОРВИ.
Этиология ОРВИ
ОРВИ («простуда») может быть вызвана более чем 200 типами вирусов, однако к наиболее распространенным возбудителям относятся рино-, корона-, реже аденовирусы, вирусы гриппа и парагриппа, респираторный синцитиальный вирус (РСВ). Именно вирус, повреждая эпителиальную выстилку, создает условия для активации микробной флоры (пневмококк, гемофильная палочка и др.), возникновения вирусно-бактериальных ассоциаций [5].
Передача инфекции происходит главным образом контактным путем – через прикосновение к зараженным поверхностям с последующим попаданием в респираторный тракт, а не воздушно-капельным путем, как это было принято считать ранее. Иногда передача возбудителя инфекции возможна через предметы обихода, игрушки, белье или посуду [6].
Гистологические эффекты вирусных инфекций варьируют от значительной эпителиальной деструкции слизистой оболочки ДП до виртуального отсутствия каких-либо патологических изменений. Также различается и клиническая картина заболевания, развивающегося при инфицировании различными вирусами [5]. В большинстве случаев воздействие инфекции приводит к развитию вазодилатации, отека слизистых оболочек и последующей гиперпродукции вязкого секрета (бронхиальный и/или назальный секрет). Например, при поражении верхних ДП в первую очередь страдает слизистая оболочка полости носа и придаточных пазух, т.е. развивается риносинусит. В результате клинический синдром ОРВИ включает боль в горле, заложенность носа, ринорею, чихание, постназальный затек, потребность в прочищении горла (откашливании) и кашель.
Вирусное инфицирование слизистых оболочек ДП часто служит лишь первой фазой заболевания, способствуя присоединению бактериального воспаления, которое зачастую и обусловливает тяжесть заболевания. Первичная вирусная инфекция может приводить к активации эндогенной условно-патогенной флоры.
Клиническая картина ОРВИ
Несмотря на большую частоту и большое число болеющих ОРВИ (гриппом, «простудой») клиническая картина заболевания – последовательность развития симптомов, их продолжительность, тяжесть и т.д., все еще недостаточно изучены. Несомненно, в первую очередь это связано и с остротой развития заболевания, и кратковременностью течения заболевания.
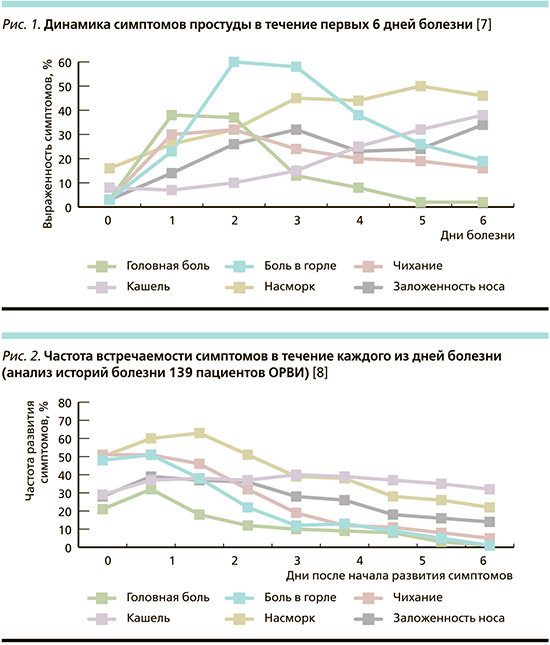
Тем не менее G. Jackson, H. Dowling, I. Spiesman и A. Boand (1958) удалось проанализировать 226 эпизодов «простуды», развивающихся на протяжении 4 лет у 104 человек [7]. По результатам их исследования стало ясно, что первые симптомы манифестировали в течение первых 24 часов после переохлаждения и/или инфицирования (рис. 1). Первым симптомом болезни, как правило, была боль в горле. Затем развивались и другие симптомы, такие как заложенность носа, насморк, сухой кашель и головная боль. Симптомы риносинусита выходят на первый план на 2–5-е сутки болезни. В это же время могут появляться шум в ушах и понижение слуха. В первые дни болезни сухой кашель был не самым частым признаком болезни (рис. 2) [8], но с течением времени постепенно нарастала тяжесть кашля и его интенсивность, становясь все более и более «надоедливыми» к 6–7-м суткам болезни, тогда как остальная симптоматика к этому времени уже стихала (рис. 1, 2). Несомненно, риносинуситы, отиты существенно влияют на самочувствие «простуженных». Однако именно кашель чаще всего приводит больного ОРВИ к врачу [9].
Согласно одному из наиболее популярных определений, кашель – суть «…рефлекторный акт, играющий большую роль в самоочищении дыхательных путей как от инородных тел, попавших извне, так и от эндогенно образовавшихся продуктов (слизь, кровь, гной, продукты тканевого распада)» [10]. Рефлекторная дуга кашля начинается со стимуляции рецепторов кашлевого рефлекса, как правило, это медиаторы вирусного воспаления (брадикинин, простагландин Р и др.) в носо- и ротоглотке. Импульс по афферентным нервам поступает в центр кашлевого рефлекса и по эфферентным нервам приходит к мышцам-эффекторам. Система характеризуется выраженной избыточностью, пластичностью и адаптацией [11]. Эта избыточность особенно ярко проявляется в сезоны острых респираторных инфекций. Сухой непродуктивный кашель – один из самых мучительных симп-томов, заметно нарушает качество жизни, снижая активность пациента и препятствуя нормальному сну и отдыху.
Уже давно известно, что развитие воспалительного процесса слизистой оболочки ДП при ОРВИ заметно увеличивает чувствительность рецепторов кашлевого рефлекса, которая угасает при купировании воспаления [12, 13]. Дальнейшие многочисленные исследования показали, что как острый, так и хронический кашель развивается в результате повышенной чувствительности рецепторных окончаний n. vagus, т.е. по сути служит проявлением синдрома кашлевой гиперчувствительности. Чувствительность афферентных путей дуги кашлевого рефлекса повышается как на периферическом, так и на центральном уровне [11, 14]. Однако еще недостаточно изучена зависимость между продуктивным кашлем и синдромом гиперчувствительности кашлевого рефлекса, хотя для острого кашля при ОРВИ эта проблема как будто решена: лечение сухого и влажного кашля может быть одинаковым, тем более что орган-мишень (80–85% случаев) при ОРВИ – это верхние ДП, при которых априори не развивается продуктивный кашель [15].
Лечение ОРВИ
Проблема лечения ОРВИ не решена до сих пор. R. Eccles et al. [16] суммировали основные направления лечения – 7 категорий лекарственных препаратов (табл. 1). В результате пациент с «простудой» вынужден принимать целую пригоршню препаратов.

В то же время новая концепция патогенеза кашля как проявление гиперчувствительности предполагает заложить в основу лечения препараты, демонстрирующие одновременно и противовоспалительные и противокашлевые свойства. Как правило, такой комбинацией эффектов обладают фитопрепараты, предназначенные для лечения кашля. Однако следует отметить, что эта большая группа лечебных препаратов применяется для лечения продуктивного (влажного) кашля, облегчения откашливания и носит общее название экспекторантов. При этом необходимо отметить, что растительное происхождение лекарственных средств еще не означает полной безопасности их применения, особенно в отношении детей. Детям раннего возраста, особенно с поражением центральной нервной системы, с высоким риском рвоты и аспирации, противопоказаны отхаркивающие лекарственные средства, увеличивающие объем секрета и усиливающие рвотный рефлекс (например, препараты ипекакуаны и термопсиса). А фитопрепараты, содержащие солодку, анис и душицу, обладают еще и довольно выраженным слабительным эффектом [17].
С учетом важной роли периферических участков рефлекторной дуги кашлевого рефлекса наиболее целесообразным может быть применение лекарственных форм препаратов, непосредственно воздействующих на очаг воспаления: наружных лекарственных средств, содержащих в качестве действующих веществ извлечения из растительного сырья. Практический опыт показывает, что такие препараты оказываются более эффективными, им свойственно пролонгированное и разностороннее фармакологическое действие [18]. Одним из таких препаратов является НеоНатур Исландика*, созданный на основе водного экстракта лишайника Cetraria islandiсa.
Применение Cetraria islandiсa
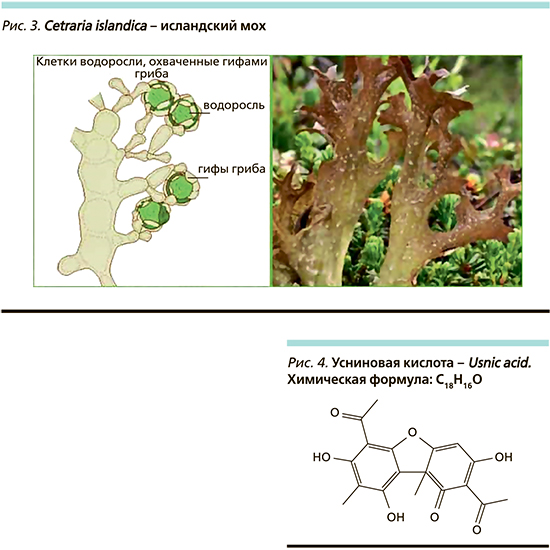
Цетрария исландская, или исландский мох (Cetraria islandica – CI), принадлежит к роду Cetraria семейства Пармелиевых. На самом деле это многолетнее растение относится к обыкновенным лишайникам. Исландский мох представляет собой небольшой ветвистый куст с листовым талломом (слоевищем) буро-зеленого цвета с белыми пятнами (рис. 3). В высоту обычно достигает 12–15 см. Слоевище состоит из плоских, свернутых в виде желобка лопастей. Этот ветвистый куст крепится к субстрату (почве, коре деревьев или старых пней) ризоидами. Как и любой лишайник, он представляет собой симбиотическую систему, включающую гриб (микобионт) и водоросли и/или цианобактерии (фикобионт). Лишайники продуцируют два основных типа соединений: первичные и вторичные метаболиты (табл. 2).

Фитотерапевтическая эффективность растения СI использовалась в народной медицине в качестве домашнего лечебного средства в течение многих веков. Среди показаний на первом месте лечение бронхолегочных заболеваний, туберкулеза, за что получил еще одно название «легочный мох». В старину поранившиеся охотники обкладывали рану лишайником и могли больше не беспокоиться о ее чистоте – гной в ране не образовывался. При этом первые печатные сведения об использовании исландского мха в медицине европейских народов относятся к середине ХVII в., их можно найти в Указателе медицинских веществ 1672 г. Лекарственные препараты, приготовленные из CI, использовались в борьбе с весьма широким спектром заболеваний (в т.ч. воспалительных) и, как правило, в виде экстрактов. В XIX в. Карл Энгельхард изготовил из этих лишайников лекарственное средство от кашля и осиплости голоса – «паста из исландского мха» [19].
В исследовании, опубликованном C. Kempe et al. [20], сообщалось, что лечение CI ведет к уменьшению таких симптомов, как сухость или раздражение слизистой оболочки полости рта у пациентов после септопластики. В обсервационном исследовании M. Hecker et al., включившем 3143 детей и подростков в возрасте от 4 до 12 лет с сухим кашлем и сухим раздражением полости рта и глотки на фоне ОРВИ, у 90% пациентов через 7 дней ежедневного употребления пастилок, содержащих экстракт лишайников, наблюдалось отсутствие жалоб и симптомов [21].
Терапевтическими действующими веществами CI являются полисахариды, крахмалящие вещества (лихенин и изолихенин), лишайниковые кислоты (усниновая кислота и др.), а также низкие дозы витамина А и С (табл. 2).
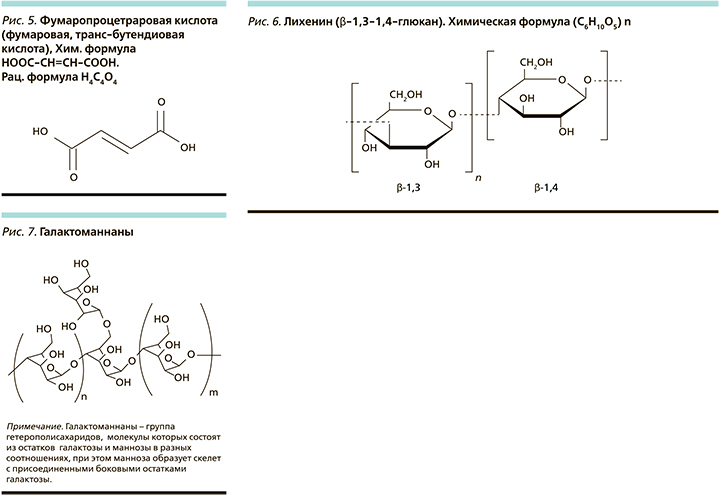
Среди первичных метаболитов CI наибольшую ценность представляют лишайниковые кислоты, особенно усниновая кислота (УК), которая не встречается в других группах организмов (рис. 4). Впервые она была выделена в 1843 г. Многочисленные исследования показали, что УК обладает широким спектром биологической активности. До открытия пенициллина УК активно исследовалась как антибиотик широкого спектра действия. Со времени окончания Второй мировой войны до конца 1950-х гг. большинство научных публикаций по УК были связаны с изучением ее антимикробной активности. После 1980-х гг. интерес к антибактериальной активности УК вновь повысился из-за выраженной тенденции развития у бактерий резистентности к антибиотикам, вызванной их чрезмерным использованием [18].
Как было установлено, УК обладает сильным антибактериальным действием по отношению к грамположительной микрофлоре (Staphylоcoccus, Streptococcus, Enterococcus, Bacillus, Corynebacterium, Propionibacterium acnes, Listeria monocytogenes, Micrococcus luteus, Peptococcus magnus, Clostridium perfringens). Исследования показали, что натриевая соль УК обладает бактериостатическими свойствами даже в разведении 1:2 млн, а в более высокой концентрации убивает туберкулезные микобактерии. Тем самым научно подтверждается опыт эффективного использования CI народной медициной для лечения туберкулеза. Очень любопытно также, что УК оказывает умеренное дозозависимое ингибирующее действие и на грамотрицательную флору (Bacteroides, Proteus vulgaris, Yersinia enterocolitica, Fusobacterium nucleatum, Prevotella intermedia, Porphyromonas gingivalis, Helicobacter pylori). Интерес представляет изучение практического применения УК как антибиотика – препятствие образованию биопленок микроорганизмов Staphylococcus аureus, Cobetia marina и Marinobacter hydrocarbonoclasticus. Несомненно УК оказывает синергическое действие при совместном применении с антибиотиками.
По результатам многочисленных исследований установлено, что механизм антибактериального действия УК обусловлен ингибированием синтеза и роста бактерий за счет прекращения окислительного фосфорилирования бактерий, синтеза РНК и ДНК бактерий, а также разрушения мембраны и клеточных стенок бактерий [22].
Противовирусный эффект УК был доказан для вирусов гриппа А, H5N1 и H3N2, вируса герпеса 1-го типа, вируса полиомиелита 1-го типа. Механизм антивирусной активности кислоты связан с ее способностью угнетать процесс вирусной транскрипции.
А такие лишайниковые кислоты, как D-протолихестериновая кислота и ее производные, являются мощным ингибитором фермента ДНК-полимеразы человеческого вируса HIV-1 RT, что предполагает их эффективность в лечении ВИ-заболеваний [23, 24].
Есть сведения, согласно которым многие лишайниковые кислоты проявляют умеренную антигрибковую активность, особенно в отношении дрожжеподобных грибов рода Candida [25].
Особое место среди лишайниковых кислот занимает фумаропроцетраровая кислота (фумаровая) кислота (рис. 5). Она является интермедиантом в цикле Кребса. Как и УК, она является природным антисептиком, принимает участие в работе иммунной системы человека, входит в состав препаратов для лечения псориаза, применяется и в пищевой промышленности как пищевая добавка Е297, заменитель лимонной кислоты.
Противокашлевое и противорвотное действия препаратов, полученных из CI, обусловлены наличием вторичных метаболитов – полисахаридов. Клеточная стенка микобионта содержит три полисахарида с отличающейся структурой, а именно: β-глюканы (лихенин), α-глюканы (изолихенин) и галактоманнаны, которые имеют линейную, незначительно замещенную и разветвленную структуру (рис. 6, 7).
Основные полисахариды CI – лихенин (β-D-глюкан) и изолихенин (α-D-глюкан) галактоманнан – носят еще одно название: лишайниковые крахмалы. Благодаря своим желирующим свойствам с водой они образуют вязкий коллоидный раствор, обладающий биоадгезивным действием: способностью адсорбироваться на клетках слизистых оболочек полости рта, глотки и верхних дыхательных путей. Гистологические исследования мембран, инкубированных с флуоресцентно-меченым рамногалактуронаном, показали наличие отчетливых полисахаридных слоев на апикальной поверхности мембраны (рис. 8). Эти результаты продемонстрировали адсорбционные эффекты полисахаридов на слизистых оболочках глотки [26].
Таким образом, для гидроколлоидсодержащих ЛП, таких как исландский мох, были описаны т.н. слизистые эффекты. Этот термин в целом подразумевает, что тонкие слои полисахаридов покрывают и защищают раздраженные слизистые оболочки. Известно, что при воспалительных заболеваниях слизистых оболочек глотки нарушается функция слоя эндогенного муцина на поверхности эпителия, что приводит к последующему физическому и микробному раздражению слизистой оболочки. Есть данные, свидетельствующие о том, что такие слои слизистых полимеров обеспечивают регидратацию, снижение чувствительности периферических рецепторов [27], активности локального воспаления [28] и таким образом – уменьшение выраженности сухого кашля [29]. Рассасывание пастилок с водными экстрактами исландского мха стимулирует секрецию слюны и обеспечивает равномерное распределение ингредиентов в ротовой полости и глотке. Водные экстракты полисахаридсодержащих растений широко используются для лечения раздражения слизистых оболочек в области глотки [20, 21]. Клейкие слизистые вещества лихенин и изолихенин покрывают слизистую оболочку верхних ДП защитным слоем, препятствуя дальнейшему раздражению, ускоряют регенерацию поврежденных тканей и таким образом оказывают противовоспалительное и успокаивающее действия для горла, глотки и верхних ДП. Противовоспалительный эффект определяется присутствием лихенина. Установлено, что водный экстракт этого полисахарида стимулирует в клетках организма выработку цитокина интерлейкина-10 (ИЛ-10), который гасит очаги воспаления и устраняет причины их возникновения. Таким образом реализуется противокашлевое действие. Именно лихенин и изолихенин создают ту слизь, которая формирует защитный слой на воспаленной слизистой оболочке верхних ДП и успокаивает «сухой» кашель, уменьшает охриплость, увлажняет слизистые оболочки, поддерживает голосовые связки при нагрузках.
Однако этим не ограничивается спектр эффектов полисахаридов. Описан антиоксидативный эффект – водный экстракт CI является мощным средством, препятствующим процессам окисления клеток человеческого организма, которые способствуют наступлению преждевременного старения.
В результате исследований выяснилось, что CI демонстрирует активность, в 10 раз более высокую, чем широко используемый в фармакологии антиоксидант α-токоферол, являющийся продуктом животного происхождения [30].
Из-за высокого содержания полисахаридов (70–80%) в сочетании с микроэлементами CI является ценным иммуномоделирующим средством. Этот эффект создает прежде всего галактоманнан. Показано, что его спиртовой экстракт повышает активность фагоцитов, что в свою очередь приводит к усилению защитных реакций организма, направленных на борьбу с различными стрессами и болезнями. Результаты всех научных работ, посвященных этой проблеме, проведенных на сегодняшний день, показывают, что полисахариды, полученные из лишайников, усиливают фагоцитарную активность макрофагов, содействуя увеличению выработки NO, который является цитотоксичным для инвазивных патогенов. Плюс к этому изменяют уровни выработки различных про- и противовоспалительных цитокинов (ИЛ-10, -12, -1β, фактор некроза опухоли-α и интерферон-α/β – ИФН-α/β) макрофагами и дендритными клетками. Провоспалительные цитокины, такие как ИФН-γ и ИЛ-12, способствуют ответу клеток Th1, которые отвечают за уничтожение внутриклеточных паразитов. Таким образом, иммунотропная направленность действия CI вносит существенный вклад в улучшение результатов стимуляции фагоцитоза и генерации макрофагов, а также активации местного иммунитета легких. Полисахариды исландского мха обладают антигипотоксическими свойствами, относятся к интерфероностимуляторам и адаптогенам. Следовательно, эти данные позволяют предположить, что полисахариды лишайников могут быть потенциальным источником иммунопрофилактических препаратов [30–32].
Принимая во внимание удивительные свойства CI (антимикробные, противовирусные, иммуномодулирующие и т.д.), можно не сомневаться в том, что лекарственные препараты, созданные на ее основе, широко применяются в клинической практике. Несомненно, принимая во внимание желирующие свойства полисахаридов, следует предпочесть лекарственные формы, предназначенные для рассасывания.
В состав пастилок НеоНатур Исландика помимо водного экстракта сушеного мха входят еще пантотеновая кислота (витамин В5) и глюконат цинка. В состав таблетки входят 12,26 мг пантотеновой кислоты и 1,6 мг глюконата цинка. Их количество при приеме 3–6 таблеток не превышает рекомендуемого уровня суточного потребления.
Эти добавки способствуют укреплению местного иммунитета, заживлению слизистых оболочек. Кроме того, витамин В5 в организме превращается в пантетин, входящий в состав кофермента А (KoА). И в дополнение к ингредиентам CI оказывает регенерирующее, метаболическое и слабое противовоспалительное действия.
Препарат рекомендован взрослым и детям старше 14 лет – по 1 таблетке каждые 2–3 часа по необходимости. Суточная доза не должна превышать 3–6 таблеток в сутки. Принимать после еды, рассасывая во рту до полного растворения. Курс лечения не более 1–2 недель. Если боль в горле не проходит более 2–3 дней, необходимо проконсультироваться у врача.
Заключение
Таким образом, препарат будет полезен в следующих случаях:
- Острые и хронические воспалительные заболевания верхних и нижних ДП – фарингит, ларингит, трахеит, бронхит, пневмония.
- Постинфекционный сухой кашель и раздражение горла (после перенесенного ОРВИ.
- При синдроме постназального затекания – синуситы, риносинуситы.
- При аллергическом кашле – бронхиальной астме, поллинозе.
- При профессиональном сухом кашле – у дикторов, преподавателей, лекторов и артистов, при работах на вредных производствах (парикмахеров, парфюмерная промышленность и др.).
- При сухом кашле у курильщиков.


