Введение
Шизофрения – инвалидизирующее психическое расстройство со сложной этиологией [1]. Заболевание часто проявляется в виде острого психотического эпизода, требующего назначения антипсихотиков [2]. Эти препараты в свое время совершили прорыв в лечении острых психозов при шизофрении и считаются эффективными в предупреждении повторных эпизодов [2–3]. Однако известно, что реакция на терапию заметно варьируется у разных пациентов и может быть непредсказуемой, особенно у детей и подростков, более склонных к метаболическим нарушениям и другим неблагоприятным побочным эффектам [4].
В последние десятилетия множество исследований было направлено на поиск связи между генетическими факторами и индивидуальной восприимчивостью к действию антипсихотиков. Активно изучались гены фармакокинетических и фармакодинамических факторов [5–6]. Отдельные полиморфные варианты в настоящее время уже включены в рекомендации для врачей по персонализированному подбору психофармакотерапии. Так, например, существуют клинические рекомендации по генотипированию изофермента CYP2D6 при подборе антипсихотиков и антидепрессантов [7].
В настоящее время благодаря методу полногеномного поиска ассоциаций (GWAS – Genome-Wide Association Studies) выявлены другие связанные с предрасположенностью к шизофрении гены [8–9]. Их функции еще не до конца изучены и, вероятно, могут влиять на развитие заболевания за пределами известных биологических механизмов, на которых основано терапевтическое действие антипсихотиков [10].
Одним из наиболее известных примеров является полиморфный вариант rs1344706 гена ZNF804A, экспрессирующего белок группы «цинковых пальцев» – фактора транскрипции в нейронах головного мозга. Предполагается, что снижение его экспрессии при носительстве варианта rs1344706 приводит к нарушениям строения и функционирования как эмбриональных, так и зрелых нервных клеток [11]. Результаты клинических исследований свидетельствуют о том, что люди с полиморфизмом ZNF804A rs1344706 не только более предрасположены к шизофрении, но и хуже отвечают на терапию [12]. В частности, в группе больных шизофренией (европеоиды, средний возраст – 33,6 года) после 4-недельной терапии антипсихотиками второй генерации гомозиготные носители полиморфного варианта rs1344706 показали значительно меньшую редукцию продуктивных симптомов по сравнению с носителями «дикой» аллели G [12].
В другом исследовании (уже среди больных шизофренией китайского происхождения с первым психотическим эпизодом) обнаружено, что носители аллели T по сравнению с гомозиготами GG ZNF804A rs1344706 демонстрировали значительно худшую динамику общего психического состояния после 4 недель приема антипсихотиков [10]. В данном исследовании участвовали всего 54 участника, что считается небольшой выборкой для фармакогенетического исследования [10].
Другой новый фармакогенетический маркер, исследуемый как предиктор эффективности антипсихотиков, – полиморфный вариант rs7968606 гена ANKS1B [13]. Он кодирует белок, который является частью постсинаптических комплексов, содержащих рецепторы серотонина 5HT2A [13]. Полиморфный вариант приводит к снижению активности этого белка, что влияет на эффективность антипсихотиков, однако собранная на настоящий момент доказательная база не достаточно убедительна [7, 14].
Так, в одном из самых крупных рандомизированных контролируемых клинических исследований эффективности антипсихотиков при шизофрении (CATIE, США) в выборке из 738 пациентов (средний возраст – 40,9 года) rs7968606 ANKS1B ассоциировался большей редукцией негативных симптомов при приеме оланзапина (р=3,2×10–7) [15].
В другом исследовании полиморфизм rs7968606 проанализирован среди 154 пациентов корейского происхождения [14]. Была выявлена значимая ассоциация (р<0,05) с терапевтическим ответом на амисульприд.
В крупнейшем на сегодняшний день исследовании GWAS эффективности и безопасности применения антипсихотиков, проведенном Китайским консорциумом фармакогеномики антипсихотиков CAPOC (Chinese Antipsychotics Pharmacogenomics Consortium), авторы обнаружили пять локусов, связанных с ответом на антипсихотики, которые прошли порог GWS [13]. Авторы изучили несколько генов-кандидатов, включая ANKS1B, на предмет ассоциации с ответом на терапию. Наибольшая значимость (p=3,0×10–4) получена для ассоциации с эффективностью применения оланзапина, что согласуется с результатами исследования CATIE [15].
В целом полученные на сегодня результаты фармакогенетических исследований ZNF804A и ANKS1B выглядят многообещающе. Все упомянутые выше исследования проводились в основном с участием взрослых и не учитывают специфики терапии детей и подростков [7]. Чтобы внедрить данные биомаркеры в клинические рекомендации по фармакогенетике антипсихотиков, требуется больше исследований.
Цель настоящего исследования: изучить предиктивную роль полиморфных вариантов генов ZNF804A и ANKS1B для ранних признаков неэффективности и непереносимости антипсихотиков у подростков с острым психотическим эпизодом.
Методы
Исследование одобрено заседанием локального этического комитета ФГБОУ ДПО РМАНПО «Российская медицинская академия непрерывного профессионального образования» Минздрава РФ (Протокол № 3 от 06.06.2018) и ГБУЗ «Научно-практический центр психического здоровья детей и подростков им. Г.Е. Сухаревой» ДЗМ (Протокол № 2 от 14.06.2018).
Дизайн исследования: проспективное обсервационное. В исследовании участвовали пациенты, госпитализированные в детскую психиатрическую больницу (ГБУЗ «Научно-практический центр психического здоровья детей и подростков им. Г.Е. Сухаревой» ДЗМ). В исследовании участвовали пациенты, госпитализированные в больницу с 20.06.2018 по 20.03.2020.
В исследование был включен 101 подросток с установленным диагнозом «острое полиморфное психотическое расстройство» на момент поступления (F23.0-9, согласно МКБ-10). Включение производилось в срок от 1 до 3 дней после госпитализации пациента в психиатрическую больницу. Каждый пациент или его законный представитель подписал добровольное информированное согласие на участие в исследовании. Персональные данные, позволявшие идентифицировать пациента, не были внесены в базы данных. Все пациенты идентифицировали себя этнически русскими.
Критерии включения: возраст от 10 до 18 лет, клинически верифицированный острый психотический эпизод, назначение антипсихотика в качестве основного вида фармакотерапии, согласие пациента и родителя (законного представителя) на участие в исследовании. Критерии невключения: наличие соматического или инфекционного заболевания в состоянии декомпенсации, положительный результат теста на употребление психоактивных веществ, что указывает на экзогенный характер психотического расстройства, противопоказания к приему антипсихотиков, отказ пациента или его родителя (законного представителя) от участия в исследовании.
Наблюдение за пациентами проводилось в течение 14 дней. Психическое состояние пациента оценивали дважды: на момент включения и на момент окончания периода наблюдения. Безопасность психофармакотерапии оценивалась на 14-й день наблюдения.
Для оценки тяжести психического состояния применялись специальные шкалы: CGAS (Children’s Global Assessment Scale) [16], PANSS (Positive and Negative Symptoms Scale) [17], CGI-S (Clinical Global Impression Severity) и CGI-I (Improvement) [18]. Динамические изменения данных шкал использовались для оценки эффективности психофармакотерапии.
Безопасность психофармакотерапии оценивалась при помощи шкал UKU SERS (UKU Side Effects Rating Scale) [19], SAS (Sympson-Angus Scale) [20], BARS (Barnes Akathisia rating scale) [21]. Эти шкалы имеют числовые значения: чем выше значение, тем больше выраженность симптомов. Но UKU SERS также позволяет оценивать наличие отдельных неблагоприятных побочных эффектов у пациента.
Исследователь не мог влиять на назначение психофармакотерапии лечащим врачом. Все получаемые пациентом психотропные препараты были учтены в исследовании. Все пациенты получали антипсихотик в качестве основной терапии. Некоторым пациентам дополнительно назначали второй антипсихотик, антидепрессант, нормотимик, антихолинергический препарат или транквилизатор. Подобные случаи рассматривались как полипрагмазия и обязательно учитывались при анализе. Для анализа учитывали суточную дозу антипсихотика, не разделяя один и тот же препарат по пути введения. Дозы антипсихотиков были переведены в хлорпромазиновый эквивалент для унификации дальнейшего анализа [22]. В анализ включались только те лекарственные средства, которые назначались пациенту не менее чем на 3 дня.
У каждого пациента был взят соскоб эпителия внутренней стороны щеки (буккального эпителия) в день включения в исследование с целью генотипирования. Биоматериал замораживали, транспортировали в лабораторию и в дальнейшем хранили при температуре -77°С.
Лабораторная часть исследования проводилась на базе НИИ молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО Минздрава России (Москва). Выделение ДНК и генотипирование образцов происходили по мере их поступления в период с 25 апреля 2019 по 15 мая 2020 г. Выделение ДНК из буккального эпителия проведено сорбентным методом.
Определение полиморфных вариантов генов ZNF804A rs1344706 (A>C) и ANKS1B rs7968606 (C>T) осуществлялось методом ПЦР в реальном времени с применением коммерческих наборов реактивов (ООО «Синтол»); оборудование: детектирующий амплификатор CFX96 TouchTM Real-Time PCR Detection System (Bio-Rad, USA).
Статистическая обработка проведена в программе SPSS Statistics 21.0.
С учетом небольшого размера выборки для сравнения количественных переменных между группами применялись непараметрические критерии (Манна–Уитни, Крускала–Уоллеса). Ввиду малочисленной выборки средние значения представлены в результатах как медиана и квартили – Me [Q1; Q3] Частоты категориальных переменных сравнивали между собой при помощи χ2-критерия Пирсона, для сравнений 2×2 использовался точный критерий Фишера. Для коррекции множественных сравнений вводилась поправка Бонферрони.
Расчет соответствия распределения генотипов закону Харди–Вайнберга выполнен при помощи on-line-калькулятора [23].
Носители разных аллелей были разбиты на две группы: гомозиготы «дикого» типа и носители полиморфной аллели в гомо- и гетерозиготном состояниях. Для ANKS1B rs7968606 выделены группы CC и CT+CT, для ZNF804A rs1344706 – AA и AC+CC.
Гаплотипический анализ выполнен при помощи программы SNPStats [24].
При анализе данных всегда учитывали влияние демографических и клинических характеристик пациентов на изучаемые исходы, в т.ч. влияние полипрагмазии. Это сделано с целью установить значимость ассоциаций полиморфных вариантов исследуемых генов с параметрами эффективности и безопасности антипсихотиков.
Результаты
Средний возраст пациентов составил 15,2±1,7 года. Все пациенты идентифицировали себя этнически русскими. Соотношение мальчиков и девочек было примерно одинаковым (51,5 и 48,5% соответственно).
При поступлении пациенты соответствовали критериям диагноза F23 по Международной классификации болезней 10-го пересмотра «Острое полиморфное психотическое расстройство». Наиболее часто в качестве ведущего синдрома диагностировали галлюцинаторно-параноидный (61,4%), примерно поровну – параноидный (14,9%), депрессивно-параноидный (11,9%), маниакально-параноидный (10,9%), у одного пациента ведущим синдромом был кататонический.
Анализ фармакотерапии показал, что большинству пациентов в качестве основного антипсихотика назначали галоперидол (55,4%), реже – рисперидон (13,9%), оланзапин (8,9%), клозапин (6,9%), трифлуоперазин (6,9%), зуклопентиксол (4%), кветиапин (2%), хлорпромазин (1%), левомепромазин (1%). Второй антипсихотик дополнительно к основному назначали 52 пациентам, и чаще всего это был хлорпромазин (14,9%) или левомепромазин (19,8%) для дополнительной седации. Присоединение антидепрессанта отмечено в 25,7% случаев, нормотимика – в 18,8%.
В выборке частоты генотипов изученных полиморфных вариантов распределились следующим образом. Для ANKS1B rs7968606: 81 пациент с генотипом СС, 19 – гетерозиготы СТ и 1 – гомозиготный носитель ТТ. Для ZNF804A rs1344706: 39 – носители генотипа АА, 41 – гетерозиготы АС и 21 – носители генотипа СС. Распределение не отличалось от равновесия по Харди–Вайнбергу (p>0,05).
Значимые отличия клинических характеристик между носителями разных генотипов полиморфных вариантов ANKS1B rs7968606 и ZNF804A rs1344706 показаны в табл. 1.
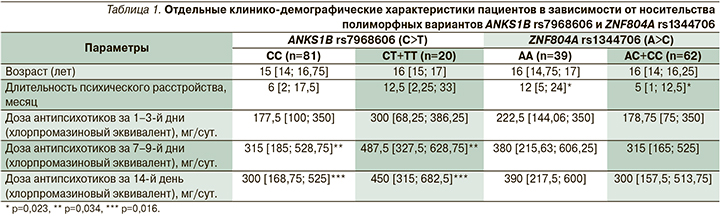
Анализ фармакотерапии носителей разных генотипов установил, что нормотимик значимо чаще назначался носителям «дикого» генотипа АА полиморфного варианта ZNF804A rs1344706 по сравнению с носителями АС+СС (33,3 против 9,7% соответственно; р=0,004). Других ассоциаций между полиморфными вариантами и психофармакотерапией не выявлено.
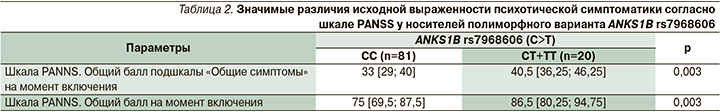
Сравнение степени выраженности психотической симптоматики на момент включения в исследование позволило установить, что носители полиморфной аллели T ANKS1B rs7968606 отличались значимо бόльшим баллом шкалы PANSS, а также ее подшкалы «Общие симптомы» (табл. 2).
Проведенный анализ параметров эффективности и безопасности психофармакотерапии в зависимости от носительства полиморфных вариантов ANKS1B rs7968606 и ZNF804A rs1344706 не выявил значимых ассоциаций.
Обсуждение
В результате проведенного исследования значимых ассоциаций ZNF804A rs1344706 и ANKS1B rs7968606 с эффективностью терапии острого психотического эпизода у подростков обнаружено не было. Тем не менее продолжать изучение роли данных маркеров в лечении расстройств шизофренического спектра безусловно важно, поскольку среди проведенных ранее исследований есть положительные результаты. В частности, полиморфный вариант rs1344706 гена ZNF804A продемонстрировал значимые ассоциации с риском шизофрении среди этнических европеоидов в крупном GWAS-исследовании [11]. Позднее среди взрослых пациентов разных этнических групп (европеоиды, азиаты) были найдены значимые ассоциации ZNF804A rs1344706 со значительно меньшей редукцией продуктивных симптомов, а также с худшей динамикой улучшения общего психического состояния на фоне приема антипсихотиков [10, 12]. Полиморфный вариант rs7968606 гена ANKS1B в свою очередь ассоциировался с большей редукцией негативных симптомов при приеме оланзапина взрослыми пациентами [13, 15]. Стоит отметить, что данные исследования проводились на взрослых и в отличие от нашей работы не учитывали особенностей терапии детей и подростков, что может быть причиной несоответствия результатов.
Также особый интерес вызывают функции приведенных генов и соответствующих им белков. Хотя, по имеющимся данным, мы можем сделать некоторые предположения, точные механизмы участия rs1344706 ZNF804A и rs7968606 ANKS1B в возникновении острых психотических эпизодов и их фармакотерапии пока не выявлены [11, 13].
Соответственно, на основании существующей доказательной базы небезосновательно предполагать, что данные гены могут влиять на характер течения шизофрении у их носителей. Также они служат потенциальным фармакогенетическим маркером прогноза эффективности и безопасности антипсихотиков, хотя в настоящий момент, конечно, не могут быть рекомендованы для коррекции терапии. Именно поэтому необходимо собрать больше клинических данных и продолжать исследования, несмотря на наличие отрицательных результатов.
Заключение
В результате проведенного исследования не было выявлено значимых ассоциаций параметров эффективности и безопасности фармакотерапии в зависимости от носительства полиморфных вариантов ANKS1B rs7968606 и ZNF804A rs1344706 у подростков с острым психотическим эпизодом.
Планируется дальнейшее проведение исследований о влиянии полиморфных вариантов генов на эффективность и безопасность фармакотерапии пациентов с расстройствами шизофренического спектра.
Финансирование. Исследование выполнено при финансовой поддержке Российского научного фонда, проект № 18-75-00046.


