Введение
Псориаз – это хроническое, иммуноассоциированное, системное, воспалительное заболевание рецидивирующего характера с поражением кожи и ее придатков, суставов, а также приводящее к заболеваниям сердечно-сосудистой, нервной, выделительной, эндокринной и других систем и метаболическим нарушениям, таким как ожирение, сахарный диабет, метаболический синдром, дислипидемия. Обусловлены данные явления т.н. псориатическим или воспалительным маршем. Помимо поражения внутренних органов псориаз часто является причиной расстройств со стороны нервной системы и психоэмоциональной сферы человека [1]. На подбор препаратов для лечения псориаза влияет не только степень его тяжести, но и наличие сопутствующей патологии.
Длительное время изучается патогенез псориаза, более 20 лет назад установлено, что ключевым звеном в данном процессе являются Т-хелперы. С каждым годом выявляют новые звенья патогенеза, который изучается на молекулярном уровне, в связи с чем появляются новые препараты, действующие на различные этапы развития болезни.
Под влиянием эндогенных и экзогенных факторов кератиноциты продуцируют антимикробные пептиды, такие как β-дефенсины, белки S100 и кателицидин. Кателицидин LL-37 и белок ADAMTSL5 (a disintegrin and metalloprotease domain containing thrombospondin type 1 motif-like) выступают в роли аутоантигенов, взаимодействуя с рецепторами плазматических дендритных клеток. Комплексы LL-37-ДНК стимулируют плазматические дендритные клетки к выработке интреферона α (ИФН-α), а комплекс LL-37-РНК, стимулируя миелоидные дендритные клетки, приводит к синтезу ИФН-α, интерлейкина-12 (ИЛ-12), -23, фактора некроза α (ФНО-α). ИЛ-23 стимулирует клетки Th17, а клетки Th17 продуцируют синтез ИЛ-17 и -22 посредством пути JAK-STAT (Janus kinases – JAKs), STATs (signal transducer and activator of transcription proteins). Клетки Лангерганса также секретируют ИЛ-23 и стимулируют клетки Th17. Влияние данных провоспалительных молекул на нейтрофилы, эндотелиальные рецепторы приводит к формированию очагов воспаления и нарушению процессов кератинизации [2].
Установлено, что ИЛ-23 является ключевым компонентом патогенеза псориаза и представляет собой гетеродимерный цитокин, состоящий из субъединиц p19 и p40. Ось ИЛ-23/Th17 является центральным звеном в развитии заболевания. Первым одобренным биологическим препаратом для ингибирования этого пути был устекинумаб, полностью человеческое моноклональное антитело против общей субъединицы p40 цитокинов ИЛ-12 и -23, за которым последовало одобрение нескольких ингибиторов ИЛ-17.
Хотя эти методы лечения эффективны, последующее открытие ИЛ-23 в качестве «главного регулятора» клеток Th17 привело к разработке нескольких антагонистов субъединицы p19 ИЛ-23 для селективного ингибирования ИЛ-23 без нарушения функции ИЛ-23. В настоящее время три ингибитора субъединицы p19 ИЛ-23 были одобрены FDA (Food and Drug Administration) и Европейским агентством по лекарственным средствам (EMA – European Medicines Agency): гуселькумаб, тилдракизумаб и рисанкизумаб. Еще один препарат, мирикизумаб, находится на 3-й стадии разработки [3].
В настоящее время в Российской Федерации арсенал для системного медикаментозного лечения псориаза состоит из базисных препаратов (метотрексат, синтетические ретиноиды, циклоспорин А), ингибитора фосфодиэстеразы 4 (апремиласт), генно-инженерных биологических препаратов – ГИБП (ингибиторы ФНО-α, ИЛ-12, ИЛ-17, ИЛ-23) и ингибиторы JAK [4].
Проходят изучение и клинические испытания такие группы препаратов, как ингибитор RORγt (Retinoic acid receptor-related orphan nuclear receptor gamma t) – ключевой фактор транскрипции для дифференцировки клеток Th17 [5], антагонист рецептора ИЛ-36 [6], агонист сфингозин-1-фосфата (S1P) [7], ингибитор Rho-ассоциированной киназы (ROCK2) [8].
С 2000-х гг. биологические препараты начали широко применяться в терапии ревматологических заболеваний (ревматоидный артрит, анкилозирующий спондилит), а затем были одобрены и для лечения воспалительных заболеваний кишечника (болезнь Крона, язвенный колит) и кожи (псориаз и псориатический артрит). ГИБП применяются для терапии псориаза средней и тяжелой степеней, показывают бόльшую эффективность и меньший спектр нежелательных лекарственных реакций по сравнению с традиционной системной терапией [9].
Также при подборе препарата как для врача, так и для пациента важны долгосрочная эффективность и безопасность лечения.
Рассмотрим особенности одного из ингибитора ИЛ-23 – гуселькумаба (Тремфея).
В 2017 г. препарат Тремфея был одобрен FDA и EMA, а в 2019 г. зарегистрирован в Российской Федерации для лечения взрослых пациентов (старше 18 лет) с псориазом средней и тяжелой степеней. С 2021 г. у препарата Тремфея одобрено показание псориатический артрит.
Гуселькумаб – полностью человеческое моноклональное антитело, является специфическим ингибитором субъединицы p19 ИЛ-23 [10]. Он избирательно связывается с субъединицей p19 ИЛ-23 и блокирует связывание ИЛ-23 с его рецептором, тем самым подавляя нижестоящую внутриклеточную передачу сигналов и последующую продукцию цитокинов клетками Th17 [10,11].
Препарат предназначен для подкожного введения в дозировке 100 мг/мл, вторая инъекция осуществляется через 4 недели, далее – 1 раз каждые 8 недель.
Эффективность, безопасность, побочные эффекты, переносимость терапии гуселькумабом оценивались в нескольких исследованиях.
В клинических испытаниях VOYAGE-1, VOYAGE-2 принимали участие взрослые пациенты (старше 18 лет) с бляшечным псориазом умеренной и тяжелой степеней по шкале Глобальной оценки исследователя IGA (Inves-tigator Global Assessment) ≥3 баллов, по площади и индексу тяжести псориаза PASI (Psoriasis Area Severity Index) ≥12 и ≥10% площади поверхности тела, пораженной псориазом, с длительностью псориаза не менее 6 месяцев и подходящие для получения системной медикаментозной и фототерапии (исключены онкологические и инфекционные заболевания). Из исследования были исключены пациенты, ранее получавшие гуселькумаб, адалимумаб или другие ингибиторы ФНО-α (в течение 3 месяцев) и ингибиторы ИЛ-12/23, -17 или-23 (6 месяцев) или любые системные иммунодепрессанты (например, метотрексат) или фототерапию (4 недели) [11].
Испытания были рандомизированными двойными слепыми плацебо-контролируемыми исследованиями, проведены в 101 (VOYAGE-1) и 115 (VOYAGE-2) центрах по всему миру (в 10 и 9 странах соответственно). VOYAGE-1 и VOYAGE-2 были разработаны для оценки непрерывного и прерванного лечения соответственно гуселькумабом 100 мг каждые 8 недель. Исследования были идентичными до 24-й недели, а затем разошлись с 28-й по 72-ю неделю, чтобы ответить на различные научные вопросы. К 76-й неделе все пациенты в обоих исследованиях получали гуселькумаб каждые 8 недель. Эффективность терапии оценивалась по индексам PASI, IGA, DLQI (Dermatology Life Quality Index), ведению дневника признаков и симптомов псориаза (PSSD); безопасность – путем сбора информации о побочных эффектах, контролем лабораторных показателей и определением уровня антител к гуселькумабу.
В исследовании приняли участие 1829 пациентов. Дизайн исследования был идентичен до 24-й недели.
В VOYAGE-1 было рандомизировано 837 пациентов (гуселькумаб: n=329; плацебо: n=174; адалимумаб: n=334), а в VOYAGE-2 были рандомизированы 992 пациента (гуселькумаб: n=496; плацебо: n=248; адалимумаб: n=248).
Пациенты получали гуселькумаб 100 мг на 0-й, 4, 12 и 20-й неделях, плацебо на 0-й, 4, 12-й неделях, затем гуселькумаб в дозе 100 мг на 16-й, 20-й неделях, или адалимумаб 80 мг на 0-й неделе, 40 мг на 1-й и 40 мг каждые 2 недели до 24-й недели. После 16-й недели все пациенты, получавшие плацебо, переведены на гуселькумаб в дозировке 100 мг каждые 8 недель. Таким образом, на 16-й неделе оценивалась эффективность лечения псориаза гуселькумабом по сравнению с плацебо, а на 24-й неделе – сравнение с адалимумабом [12].
Таким образом, можно выделить 3 периода исследований – с 0-й по 16-ю неделю (плацебо-контролируемый период), с 0-й по 48-ю неделю (период сравнения с активным веществом, т.е. с адалимумабом), с 16-й по 48-ю неделю (переход пациентов из группы плацебо в группу приема гуселькумаба).
По результатам исследования VOYAGE-1 были определены следующие показатели эффективности терапии: гуселькумаб превзошел (р<0,001) плацебо на 16-й неделе – 85,1 против 6,9% (по оценке IGA) и 73,3 против 2,9% (улучшение показателя PASI на 90% или больше от исходного уровня). Гуселькумаб также превосходил адалимумаб (р<0,001) по IGA 0/1 и PASI-90 на 16-й неделе (85,1 против 65,9% и 73,3 против 49,7%), на 24-й неделе (84,2 против 61,7% и 80,2 против 53,0%) и на 48-й неделе (80,5 против 55,4% и 76,3 против 47,9%) [11, 12].
Исследование VOYAGE-2 дало следующие показатели эффективности терапии: на 16-й неделе бόльшее число пациентов, получавших гуселькумаб, достигли высшего балла IGA (84,1 против 8,5%) и PASI-90 (70,0 против 2,4%) по сравнению с плацебо. Гуселькумаб превзошел адалимумаб на 16-й неделе (оценка IGA 0/1, улучшение показателя PASI на 75% по сравнению с исходным уровнем) и на 24-й неделе (оценка IGA 0/1 и 0, PASI-90, 100% улучшение PASI; р<0,001). С 28-й по 48-ю неделю более стойкий ответ наблюдался в группах с поддерживающей терапией гуселькумабом по сравнению с группами отмены (р<0,001). Пациенты, не ответившие на адалимумаб (66,1%), перешедшие на гуселькумаб, достигли PASI-90 на 48-й неделе [13].
Значительное улучшение индекса качества жизни (DLQI) отмечено в группе гуселькумаба уже к 16-й неделе (среднее изменение -11,2 против -0,6) по сравнению с группой плацебо, как и доля пациентов, достигших показателя DLQI 0/1 (отсутствие влияния псориаза на качество жизни) (оба р<0,001). На 24-й и 48-й неделях улучшение значения индекса DLQI по сравнению с исходным уровнем, как и доля пациентов, достигших DLQI 0/1, были значительно выше для гуселькумаба по сравнению с адалимумабом (р<0,001) [11].
При оценке эффективности по шкале PSSD на 16-й неделе по сравнению с плацебо улучшение было значительно больше в группе пациентов, получавших гуселькумаб (среднее изменение -41,9 у группы гуселькумаба против -3,0 у группы плацебо). Аналогичным образом на 24-й и 48-й неделях средние изменения показателей PSSD для гуселькумаба были значительно выше, чем для адалимумаба (р<0,001). Доля пациентов, достигших 0 баллов по шкале PSSD при приеме гуселькумаба и адалимумаба, соответственно, составляла 36,3 и 21,6% на 24-й неделе, а значительно лучший ответ на гуселькумаб сохранялся на 48-й неделе (р<0,001).
Результаты оценки безопасности
В течение плацебо-контролируемого периода (0–16 недель) доля пациентов хотя бы с одним побочным эффектом была сопоставимой в группах лечения. Чаще всего выявляли назофарингит и легкие инфекции верхних дыхательных путей. Серьезные побочные эффекты и состояния, требовавшие прекращения приема исследуемого препарата, возникали редко и у одинакового числа пациентов при каждом лечении. Показатели общих инфекций и инфекций, требовавших лечения антибиотиками, были сопоставимыми в группах лечения. Два пациента группы адалимумаба перенесли серьезные инфекции (целлюлит). Сообщалось об одном немеланомном раке кожи (базальноклеточной карциноме) в группе гуселькумаба. В каждой из групп (гуселькумаба и адалимумаба) до 16-й недели был однократно зарегистрирован инфаркт миокарда.
В течение остального периода лечения группы заболеваний, выступавших в качестве осложнений, были идентичными осложнениям в течение плацебо-контролируемого периода.
В период с 16-й по 48-ю неделю серьезные инфекции были зарегистрированы у 2 пациентов группы гуселькумаба (абсцесс бедра и целлюлит с инфекцией послеоперационной раны) и у 2 пациентов группы адалимумаба (абсцесс брюшной полости и стафилококковая пневмония с летальным исходом). Два дополнительных немеланомных рака кожи (по 1 базальноклеточной карциноме в каждой из групп гуселькумаба и адалимумаба) и 2 злокачественных новообразования (простаты и молочной железы в группе гуселькумаба) были зарегистрированы в течение 48 недель. Никаких серьезных сердечно-сосудистых заболеваний после 16-й недели отмечено не было. Сообщалось об одной попытке самоубийства пациента, принимавшего адалимумаб. Показатели заболеваемости кандидозом и нейтропенией были низкими и сопоставимыми между группами. Случаев болезни Крона в течение 48 недель терапии не зарегистрировано.
В течение 48 недель у 2,2% пациентов группы гуселькумаба отмечалась местная воспалительная реакция в области инъекций препарата и у 9% – в группе адалимумаба.
Частота отклонений в лабораторных результатах была низкой, различий между группами замечено не было. Антитела к гуселькумабу были обнаружены у 26 (5,3%) из 492 пациентов до 44-й недели, в 81% случаев титры были низкими (≤1:320). Связи между выработкой антител и снижением эффективности или возникновением местной воспалительной реакции не наблюдалось.
Исследование VOYAGE-2 подтверждает результаты VOYAGE-1, согласно которым гуселькумаб продемонстрировал более высокую эффективность по сравнению с плацебо и адалимумабом. Отражено успешное лечение псориаза волосистой части головы и ногтей. Также во втором варианте исследования было продемонстрировано, что поддерживающая терапия гуселькумабом превосходит прерванную терапию. В отличие от VOYAGE-1, в котором пациенты продолжали лечение в течение 48 недель, в VOYAGE-2 респонденты PASI-90 были рандомизированы на 28-й неделе в 2 группы: продолжавшие прием гуселькумаба и получавшие плацебо. Пациенты, получавшие гуселькумаб, сохранили ответ, включая PASI-90, PASI-100 и IGA-0, тогда как у пациентов, получавших плацебо, отмечался рецидив псориаза, и снижалось качество жизни. Среднее время потери ответа PAS-90 для пациентов с отменой составило 15,2 недели [13].
Целью многоцентрового рандомизированного двойного слепого исследования NAVIGATE, в котором приняли участие 872 пациента, была оценка эффективности и безопасности применения гуселькумаба для пациентов с псориазом средней и тяжелой степеней, которые не получили должной положительной реакции при лечении устекинумабом (ингибитором ИЛ-12/23). Пациенты, получавшие терапию устекинумабом в дозе 45 или 90 мг (в зависимости от массы тела) и имевшие индекс IGA≥2 к 16-й неделе терапии, были рандомизированы для приема гуселькумаба в дозе 100 мг или для продолжения приема устекинумаба. Эффективность лечения оценивалась путем подсчета индексов IGA, PASI и DLQI. В результате установлено, что индекс IGA 0/1 был выше у пациентов, рандомизированных для приема гуселькумаба, по сравнению с устекинумабом (1,5 против 0,7; p<0,001). Ответ с PASI-90 на 28-й неделе был выше в группе гуселькумаба, чем в группе устекинумаба (48,1 против 22,6%; p<0,001). Бόльшая часть пациентов, получавших гуселькумаб по сравнению с устекинумабом, достигли PASI-90 (51,1 против 24,1%; p<0,001) и PASI-100 (20,0 против 7,5%; p<0,001), а также оценку DLQI 0/1 (38,8 против 19,0%) на 52-й неделе[14].
В многоцентровом двойном слепом рандомизированном исследовании, контролируемом компаратором ECLIPSE, приняли участие 1048 пациентов с распространенным псориазом средней и тяжелой степеней. Исследование было направлено на сравнение эффективности гуселькумаба с секукинумабом (ингибитор ИЛ-17A) на 48-й неделе терапии. Участники получали либо гуселькумаб 100 мг и инъекции плацебо, либо секукинумаб 300 мг. При оценке индекса PASI-90 на 48-й неделе гуселькумаб показал лучший результат, чем секукинумаб (84 против 70%; p<0,001). Помимо оценки PASI-90 на 48-й неделе в исследовании ECLIPSE были оценены шесть вторичных конечных точек. Первая, основная вторичная конечная, точка измеряла долю пациентов в группах гуселькумаба и секукинумаба, которые достигли ответа PASI-75 как на 12-й, так и на 48-й неделе, 84,6% пациентов группы гуселькумаба по сравнению с 80,2% пациентов в группе секукинумаба достигли положительного результата. Пациенты группы гуселькумаба по сравнению с группой секукинумаба достигли более высоких пропорций ответа PASI-100 к 48-й неделе (58,2 против 48,4%), IGA-0 (62,2 против 50,4%) и IGA 0/1 (85,0 против 74,9%). Основные вторичные конечные точки, измеренные на 12-й неделе, показали сдвиг в сторону увеличения доли пациентов в группе секукинумаба: 89,3% пациентов группы гуселькумаба достигли PASI-75 на 12-й неделе по сравнению с 91,6% пациентов группы секукинумаба. Ответ PASI-100 на 12-й неделе в группе гуселькумаба составил 69,1% по сравнению с 76,1% в группе секукинумаба. Исследование показало высокую долгосрочную эффективность лечения гуселькумабом по сравнению с секукинумабом [15].
В исследовании ORION, в котором приняли участие 78 пациентов, оценили эффективность, безопасность, фармакокинетику и приемлемость гуселькумаба, вводимого с помощью нового инъектора (One-Press), для пациентов с псориазом средней и тяжелой степеней. В двойном слепом рандомизированном плацебо-контролируемом исследовании ORION гуселькумаб вводился с помощью нового инъектора One-Press, который позволяет пациенту вручную контролировать скорость инъекции, а не использовать его в качестве автоинъектора. Пациенты были рандомизированы для получения гуселькумаба в дозе 100 мг на 0-й, 4, 12, 20 и 28-й неделях или плацебо на 0-й, 4 и 12-й неделях с переходом на гуселькумаб 100 мг на 16-й, 20-й и 28-й неделях. К 16-й неделе лечения 80,6% пациентов группы, получавшей гуселькумаб, и 0% группы плацебо достигли ответа IGA 0/1 (p<0,001) и 75,8% группы гуселькумаба достигли PASI-90 против 0% группы плацебо (p<0,001) IGA-0 (56,5% группы гуселькумаба и 0% группы плацебо; p<0,001) и PASI- 100 (50,0% группы гуселькумаба и 0% группы плацебо; p<0,001. 99% пациентов были удовлетворены или очень удовлетворены One-Press на 28-й неделе. Стабильные концентрации в сыворотке были достигнуты к 20-й неделе с помощью устройства One-Press, что согласуется с исследованиями с использованием шприца UltraSafe Plus (автоинъектор) [16].
В многоцентровом рандомизированном двойном слепом исследовании в параллельных группах IXORA-R (n=1027) проведено сравнение скорости раннего и полного очищения кожи при лечении пациентов с псориазом тяжелой и средней степеней с помощью иксекизумаба (ингибитор ИЛ-17) и гуселькумаба. Пациенты были рандомизированы в две группы: получавших иксекизумаб (начальная доза 160 мг, затем 80 мг каждые 2 недели) и гуселькумаб (100 мг на 0-й, 4-й и 12-й неделях). Через 12 недель доля пациентов, достигших PASI-100 для иксекизумаба и гуселькумаба, составила 41 и 25% соответственно (p<0,001). Иксекизумаб был более эффективным, чем гуселькумаб, на 1-й неделе лечения (среднее улучшение PASI по сравнению с исходным уровнем 34% по сравнению с 17%). На 24-й неделе гуселькумаб и иксекизумаб дали одинаковые ответы PASI-100 (52 против 50%; p=0,41). Ответ PASI-100 был более быстрым при применении иксекизумаба, чем гуселькумаба, к 12-й неделе, но к 24-й неделе гуселькумаб и иксекизумаб были одинаково эффективными [17].
POLARIS (n=119) – многоцентровое рандомизированное открытое слепое исследование, контролируемое активным компаратором, целью которого стало сравнение эффективности и безопасности применения гуселькумаба с эфирами фумаровой кислоты (препарат рекомендован Европейскими рекомендациями) пациентами с бляшечным псориазом умеренной и тяжелой степеней, ранее не получавшими системной терапии. Пациенты были рандомизированы для ежедневного перорального приема препарата фумаровой кислоты в виде диметилфумарата (индукция 30 мг и поддерживающая дозировка 120 мг) или гуселькумаба (100 мг на 0-й, 4-й неделях, а затем каждые 8 недель). На 24-й неделе гуселькумаб был более эффективным, чем диметилфумарат, по оценке PASI-75 (90 против 27%), PASI-90 (82 против 14%), PASI-100 (32 против 3%) и баллами DLQI 0/1 (62 против 17%) (все p<0,001). Кроме того, скорость положительного ответа на лечение гуселькумабом превосходила скорость ответа на диметилфумарат [18].
T. Yamamoto et al. представили результаты двойного слепого многоцентрового плацебо-контролируемого исследования фазы 3 с участием японских пациентов с ладонно-подошвенным пустулезом, в котором оценивали эффективность применения гуселькумаба в подгруппе пациентов с пустулезным артроостеитом (син. синдром SAPHO – это комбинация гиперостоза грудино-ключичного сочленения с пустулезом ладоней и/или подошв, пустулезным/вульгарным псориазом или глубокими угрями, на фоне которых также отмечают поражение позвоночника, остеит и артрит, в т.ч. сакроилеит). Среди 159 пациентов с ладонно-подошвенным пустулезом 66 пациентов с пустулезным артроостеитом были рандомизированы в группы, получавшие гуселькумаб 100 или 200 мг на 0-й, 4-й, 12-й и каждые 8 недель и плацебо с переходом на гуселькумаб 100 или 200 мг с 16-й недели. Эффективность оценивалась на 52-й неделе лечения по результатам магнитно-резонансной томографии (МРТ), показателей индекса EuroQOL-5 (EQ-5D), показателей боли/дискомфорта EQ-5D и уровня С-реактивного белка (СРБ мг/л).
К 52-й неделе лечения число заключений МРТ, характеризовавших тяжелое поражения суставов и костей, снизилось с 23,8% (по сравнению с исходными данными) до 5,4% в группе гуселькумаба. Среднее значение изменения по сравнению с исходным уровнем на 52-й неделе в баллах индекса EQ-5D составило 0,20 среди пациентов с пустулезным артроостеитом и 0,15 среди пациентов без пустулезного артроостеита в группе гуселькумаба. Среди всех пациентов с пустулезным артроостеитом пропорции с оценкой боли/дискомфорта по шкале EQ-5D, состоявшей из отсутствия или незначительной боли/дискомфорта в группе гуселькумаба, увеличились по сравнению с исходным уровнем до 52-й недели (33,3 по сравнению с 87,5%). Среднее значение СРБ снизилось у всех пациентов с пустулезным артроостеитом в группе гуселькумаба на 52-й неделе по сравнению с исходным уровнем. Согласно этому исследовательскому анализу, лечение гуселькумабом привело к улучшению признаков и симптомов пустулезного артроостеита у японских пациентов, лечившихся по поводу сопутствовавшего ладонно-подошвенного пустулеза. Эти данные свидетельствуют о том, что гуселькумаб имеет потенциал как новый терапевтический вариант для лечения пустулезного артроостеита [19].
Таким образом, принимая во внимание вышеизложенные данные, можно отметить, что препарат гуселькумаб имеет высокий и надежный профиль эффективности и безопасности в лечении пациентов с распространенным псориазом средней и тяжелой степеней.
Клинический случай
В отделение дерматовенерологии и косметологии Поликлиники № 1 УДП РФ обратился пациент Т. 1973 г.р. (48 лет) с жалобами на зудящие высыпания на коже туловища, конечностей, волосистой части головы, половых органах; изменение ногтевых пластин стоп и кистей, боли в суставах. Из анамнеза известно, что с 18 лет страдает псориазом, псориатической ониходистрофией стоп и кистей. С 2016 г. стал отмечать появление болей в коленных и голеностопных суставах, диагностирован псориатический артрит. С 2017 г. наблюдался у дерматовенеролога и ревматолога, получал терапию таблетированным метотрексатом в дозе 10 мг/нед., фолиевую кислоту, периодически нестероидные противовоспалительные средства (НПВС) с улучшением. Обострения отмечались 1–2 раза в год. Однако в течение последнего месяца отмечает обострение заболевания и отсутствие положительного эффекта от терапии метотрексатом. Также гастроэнтерологом был диагностирован медикаментозно-индуцированный стеатогепатит минимальной степени активности. Обратился на прием для подбора системной терапии псориаза.
На момент первичного осмотра общее состояние удовлетворительное, кожный покров физиологической окраски, нормальной влажности, тургор сохранен, видимые слизистые бледно-розового цвета, влажные, свободны от патологических высыпаний, периферические лимфатические узлы не увеличены. Патологический кожный процесс носил распространенный симметричный подостровоспалительный характер, расположен на коже волосистой части головы с переходом на кожу лба и заушных складок («псориатическая корона»), туловища, конечностей, в области паховых и подмышечных складок, наружных половых органов. Высыпания представлены инфильтрированными эритематозно-сквамозными папулами и бляшками розово-красного цвета с обильным серебристо-белым шелушением. Субъективно беспокоит зуд в области высыпаний и боли в области суставов, внешне суставы не изменены. Положительная «псориатическая триада», определяется феномен Кебнера. Ногтевые пластины стоп и кистей изменены, с выраженным онихолизисом, подногтевым гиперкератозом, белесоватого и желтого цветов, положительные симптомы «наперстка» и «масляного пятна».
При первичном осмотре, а также на последующих приемах с целью контроля эффективности терапии и определения активности псориаза проводился подсчет следующих индексов: PASI – индекс распространенности и тяжести псориаза, BSA (Body Surfase Area) – для определения площади поражения кожи и sPGA – для оценки очагов поражения псориазом у конкретного больного, NAPSI (Nail Psoriasis Severity Index) – для оценки состояния ногтевых пластинок, DLQI – дерматологический индекс оценки качества жизни больных для определения того, насколько сильно заболевание влияет на качество жизни пациента.
На первичном приеме индекс PASI составил 41,2, что соответствует тяжелому течению псориаза, BSA – 68, также говорит о тяжелом течении и sPGA – 4 (тяжелая степень проявления заболевания), NAPSI – 52 балла, DLQI – 25 баллов (что подтверждает негативное воздействие заболевания на качество жизни).
С учетом анамнеза заболевания, клинической картины, тяжелого течения псориаза пациенту была рекомендована генно-инженерная биологическая терапия (ГИБТ) препаратом гуселькумаб (Тремфея).
Перед началом терапии пациент прошел стандартные обследования для выявления наличия возможных противопоказаний к применению ГИБП: обследования на ВИЧ, сифилис, гепатиты В, С, туберкулез (консультация пульмонолога, диаскинтест, рентгенография легких), исключение онкологического процесса, клинические анализы крови и мочи, биохимическое исследование крови, включающее такие показатели, как глюкоза, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), γ-глутамилтрансфераза (ГГТ), креатинин, липидный профиль, общий билирубин, щелочная фосфатаза, СРБ. Пациент консультирован ревматологом – подтвержден диагноз «псориатическая артропатия, двусторонний сакроилеит (клинически)». Также пациент был направлен на консультацию к гастроэнтерологу и терапевту, выявлены сопутствовавшие заболевания: НПВС-гастропатия: эрозивный гастрит, хронический некалькулезный холецистит (стихающее обострение), полипы желчного пузыря, билиарный сладж, литическая терапия, хронический гепатит (неуточненный умеренной степени активности), гемангиома печени, кисты печени.
При обследовании исключены туберкулез и другие инфекционные заболевания, данных за онкологические заболевания не выявлено. При лабораторном обследовании до лечения в биохимическом анализе крови отмечалось незначительное повышение уровня трансаминаз: АЛТ до 169,3 ЕД/л, АСТ до 93,2 ЕД/л, ГГТ до 115,5 ЕД/л. В клинических анализах крови и мочи до лечения показатели находились в рамках референсных значений, СРБ – 3,8 мг/л. Пациент в течение 3 месяцев проходил лечение у гастроэнтеролога, и после нормализации уровня трансаминаз было принято решение о начале ГИБТ псориаза. С января 2021 г. пациент получает терапию препаратом гуселькумаб по стандартной схеме (подкожно в дозировке 100 мг/мл, 2-я инъекция через 4 недели, далее – 1 раз каждые 8 недель) с ежемесячным контролем клинического и биохимического анализов крови, клинического анализа мочи и дерматологических индексов.
Результаты терапии. Общее состояние пациента на фоне терапии удовлетворительное. На осмотре спустя 4 недели после 1-й инъекции новых высыпаний нет, процесс перешел в стационарную стадию, инфильтрация и эритема высыпаний на коже живота, спины и подмышечных складок значительно уменьшилась, на коже волосистой части головы сохраняется умеренное шелушение в затылочной и височной областях, симптом псориатической короны не определяется, сохраняются высыпания на коже в области голеней, коленных и локтевых суставах, поясницы, купирован зуд, боли в суставах беспокоят редко – после физической нагрузки. Через 8 недель от начала терапии высыпания на коже волосистой части головы, спины и живота, верхних конечностей, подмышечных и паховых складок полностью разрешились, местами сохраняется поствоспалительная гиперемия бледно-розового цвета, единичные псориатические папулы розоватого цвета, с шелушением, без инфильтрации на коже в области поясницы, коленных и голеностопных суставов; субъективных ощущений в области высыпаний нет. Отмечается рост здоровых ногтевых пластин кистей и стоп. Динамика заболевания на фоне лечения представлена на фото (рис. 1–5). Контрольные показатели биохимического анализа крови, клинического анализа крови и мочи в норме.
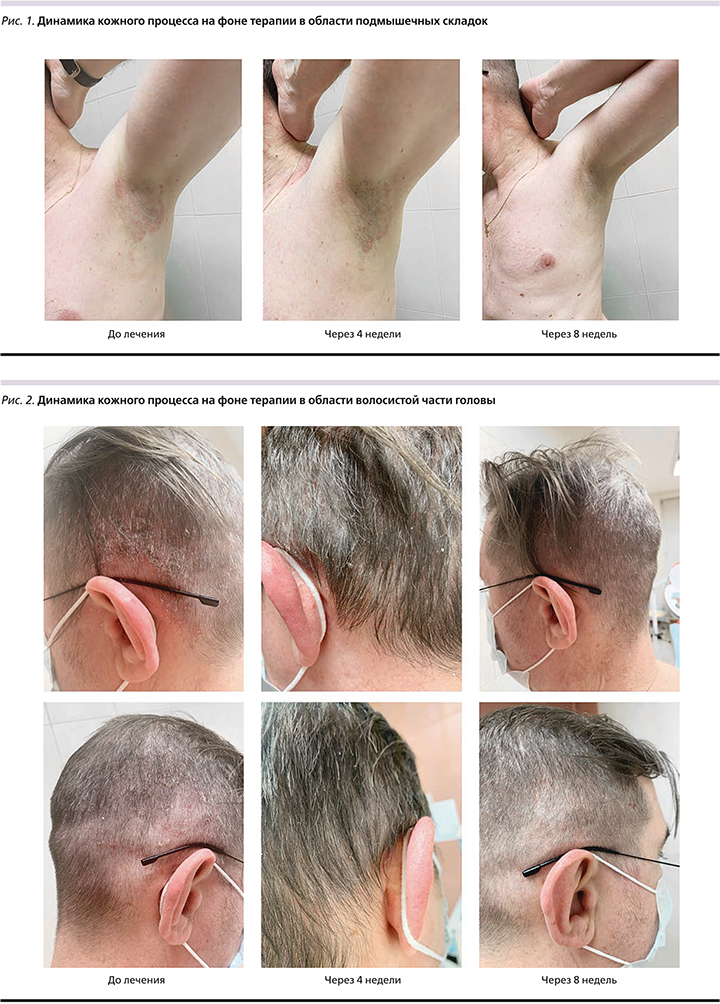
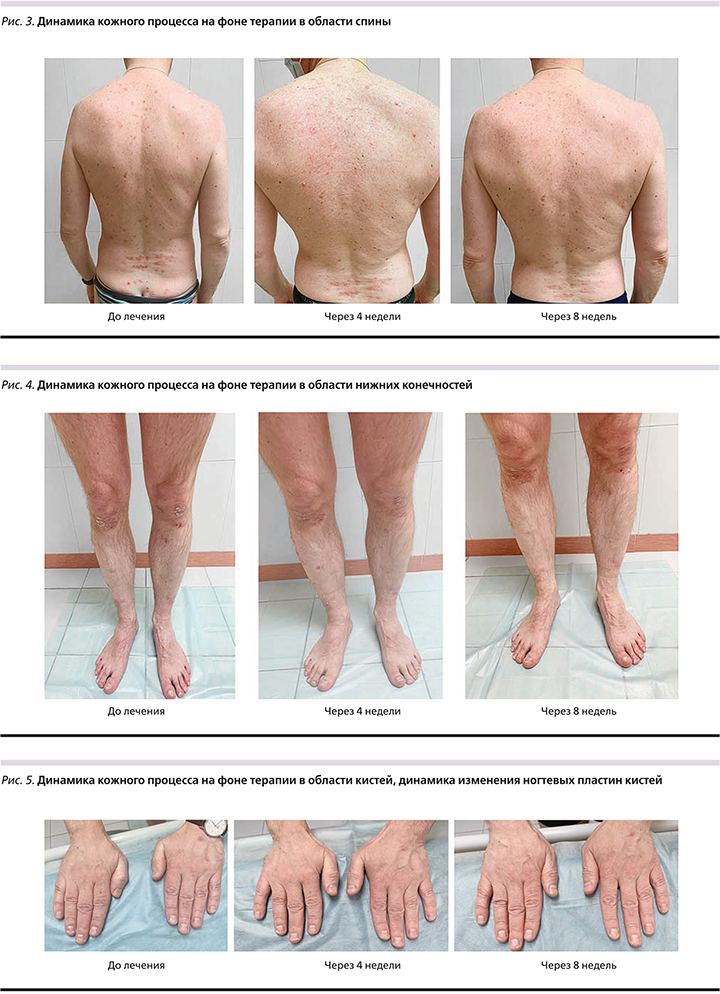
На момент написания статьи пациент получил две инъекции гуселькумаба, но уже сейчас мы смогли оценить довольно быструю динамику со стороны кожного процесса путем подсчета дерматологических индексов (см. таблицу). В частности, спустя 8 недель после 1-й инъекции удалось добиться PASI-90, т.е. терапия считается эффективной. Также видно, что степень тяжести псориаза, оцененная с помощью PASI, коррелирует со значением дерматологического индекса качества (DLQI), который уже через 4 недели от начала терапии снизился в 5 раз. Чтобы оценить влияние терапии на состояние ногтевых пластин (индекс NAPSI), требуется более длительный период наблюдения, но уже спустя 8 недель от начала лечения отмечается появление здоровых участков в зоне роста ногтей.

За данный период наблюдения (8 недель) побочных эффектов от терапии выявлено не было. Пациент продолжает лечение.
Выводы
Таким образом, можно сказать, что ГИБП гуселькумаб (ингибитор ИЛ-23) является эффективным препаратом для пациентов с бляшечным псориазом тяжелой степени, с поражением ногтевых пластин, волосистой части головы, складок, в т.ч. в сочетании с псориатическим артритом и другой коморбидной патологией. Препарат улучшает показатели качества жизни и трудоспособности, обладает благоприятным профилем безопасности. Терапия гуселькумабом характеризуется удобным режимом дозирования, а также низкими показателями иммуногенности и позволяет существенно повышать эффективность и переносимость проводимой терапии. Гуселькумаб показан пациентам при плохой переносимости или наличии противопоказаний к применению системных противовоспалительных препаратов (метотрексата, ацитретина, циклоспорина или ГИБП) и обладает меньшим спектром противопоказаний и побочных эффектов благодаря особенностям механизма действия.


