Введение
Достижения последних лет в молекулярной биологии и генетике позволили выделить различные подтипы рака молочной железы (РМЖ), определить мишени для лекарственного воздействия. Персонализация терапии не только значимо улучшила показатели выживаемости больных метастатическим РМЖ (мРМЖ), но и позволила сохранить высокое качество жизни. Для абсолютного большинства пациентов классическая химиотерапия больше не является опцией выбора в ранних линиях лечения. Так, для HER2-положительного мРМЖ приоритетное значение играет непрерывная блокада HER2 на всех этапах лечения вне зависимости от терапевтического партнера. Современным стандартом лечения гормон-рецептор положительного мРМЖ (ГР+-мРМЖ) является эндокринотерапия, предпочтительно в комбинации с CDK4/6-ингибиторами, а химиотерапия откладывается на случай висцерального криза или доказанной эндокринорезистентности. Трижды негативный подтип РМЖ по-прежнему остается самым прогностически неблагоприятным вариантом. Химиотерапия остается основным методом лечения таких пациентов, однако медиана продолжительности жизни крайне низкая и составляет около года [1]. Выделение подгруппы больных PD-L1-позитивными опухолями позволило успешно применять иммунотерапию и улучшить показатели выживаемости [2].
Перспективным является направление генетической диагностики, благодаря которой медицинское сообщество приближается к пониманию механизмов развития РМЖ и разрабатывает эффективные методы терапевтического воздействия. Нарушения в системе репарации ДНК, такие как мутации в генах BRCA1 и BRCA2, впервые описаны в семьях с предрасположенностью к раку яичников и молочной железы. Оба эти гена при нормальном функционировании являются супрессорами опухолей и вовлечены в процесс репарации посредством гомологичной рекомбинации, отвечающей за восстановление двунитевых разрывов ДНК. [3–5]. Наличие же мутации повышает уровень хромосомной нестабильности, способствуя опухолевой трансформации клеток, определяет агрессивное течение болезни [6]. Присутствие герминальной мутации в данных генах сопряжено с 60–80%-ным повышением риска развития РМЖ. Однако среди общей популяции больных РМЖ данные мутации определяются лишь у 5–10% [3].
PARP-ингибиторы в лечении BRCA-ассоциированного РМЖ
Наличие мутаций в генах BRCA1/2 перестало нести сугубо прогностическое значение. В современной практике мутационный статус определяет объем хирургического вмешательства, служит показанием к проведению профилактических операций, влияет на выбор лекарственной терапии. Дефектные белки BRCA1/2 не способны обеспечить репарацию двунитевых разрывов ДНК. Однако однонитевые разрывы ДНК восстанавливаются посредством функционирования PARP, что позволяет клетке поддерживать жизнедеятельность и сохранять способность к делению [7, 8]. Теоретические предпосылки к ингибированию PARP, предполагающие гибель клетки на фоне утраты возможности восстановления разрывов ДНК, и как следствие – к гибели клетки подтвердились на практике.
Первым зарегистрированным PARP-ингибитором для лечения BRCA-ассоциированного мРМЖ стал олапариб (Линпарза®), также одобренный для лечения рака яичников, рака предстательной железы и рака поджелудочной железы. Целью международного рандомизированного исследования III фазы OlympiAD (NCT02000622) стала оценка эффективности и безопасности терапии олапарибом больных HER2-негативным мРМЖ с герминальными мутациями в генах BRCA1/2 по сравнению с химиотерапией по выбору врача [9]. В исследование включались пациенты, ранее получавшие химиотерапию не более 2 линий по поводу метастатической болезни или в нео/адъювантном режиме. Допускалось включение больных, ранее получавших платиносодержащие режимы, но без признаков платинорезистентности. Исследование достигло своих конечных точек. Терапия олапарибом позволила достичь значимого увеличения медианы выживаемости без прогрессирования (ВБП) до 7,0 месяцев против 4,2 в контрольной группе (отношение рисков [ОР]=0,58, 95% доверительный интервал [ДИ]: 0,43–0,80; p<0,001). Данный тренд сохранялся во всех проспективно заданных подгруппах. Терапия олапарибом имела достоверные преимущества над химиотерапией по выбору врача вне зависимости от суррогатного подтипа опухоли, мутированного гена (BRCA1 или BRCA2), числа линий предшествовавшего лечения, терапии препаратами платины в анамнезе, локализации метастазов. Наибольшие различия медианы ВБП отмечены в группе пациентов с поражением центральной нервной системы (ЦНС): 8 месяцев на фоне терапии олапарибом против 2,8 в контрольной группе [10]. Объективный ответ на проводимую терапию в 2 раза чаще регистрировался в группе больных, получавших PARP-ингибитор, и составил 59,9 по сравнению с 28,8% в контрольной группе.
Анализ показателей общей выживаемости (ОВ) не выявил достоверных различий в исследованной популяции больных, медиана ОВ составила 19,3 месяца против 17,1 в группах терапии олапарибом и химиотерапии соответственно (ОР=0,90, 95% ДИ: 0,66–1,23; p=0,513) [11]. Однако при подгрупповом анализе получено значимое увеличение медианы ОВ у больных, получавших олапариб в первой линии лечения мРМЖ, 22,6 против 14,7 месяца в контрольной группе (ОР=0,51, 95% ДИ: 0,29–0,90; p=0,02).
Терапия олапарибом была сопряжена с меньшей частотой нежелательных явлений (НЯ): НЯ 3-й степени и более отмечены в 38% случаев против 49,5 в контрольной группе [10]. Отмена терапии в связи с токсичностью олапариба потребовалась в 4,9% наблюдений по сравнению с 7,7% на химиотерапии. Наиболее частыми осложнениями терапии олапарибом стали тошнота (58%), рвота (32,2%) и анемия (40%). Качество жизни пациентов, получавших олапариб, по всем анализируемым параметрам было выше, чем в контрольной группе [12].
Полученные положительные результаты исследования OlympiAD стали основанием для ряда крупных рандомизированных исследований эффективности PARP-ингибиторов при раке РМЖ в различных клинических ситуациях. Эффективность применения олапариба доказана в подтверждающем исследовании IIIb-фазы LUCY (NCT03286842), результаты которого полностью сопоставимы с таковыми в исследовании OlympiAD. Медиана времени до прогрессирования составила 8,1 месяца. Новых данных по безопасности применения олапариба получено не было [13].
Клиническое наблюдение
Результаты клинических исследований PARP-ингибиторов при BRCA-ассоциированном мРМЖ впечатляют, однако опыт применения препаратов в рутинной клинической практике еще невелик. В данной публикации мы хотим поделиться собственным успешным наблюдением.
В нашем центре наблюдается молодая пациентка 32 лет с отягощенным семейным анамнезом по РМЖ и раку легкого. История ее болезни началась в 2015 г., когда она самостоятельно обнаружила образование в правой молочной железе, на тот момент ей было всего 27 лет. С предполагаемым диагнозом «атерома правой молочной железы» в мае 2015 г. в частной клинике выполнено иссечение новообразования. При гистологическом исследовании – РМЖ. Пациентка обратилась в НМИЦ онкологии им. Н.Н. Блохина, где при пересмотре гистологического материала верифицирован инвазивный рак неспецифического типа G2, РЭ – 7б, РП – 5б, Ki-67 – 30%, HER2- 2+, при FISH-исследовании амплификации гена не выявлено. При обследовании выявлены 2 узловых образования в ткани правой молочной железы – 1,1 и 0,7 см, измененные лимфатические узлы в аксиллярной области до 1,0 см.
При цитологическом исследовании пунктатов из опухолевых узлов и подмышечного л/узла – рак во всех образцах. Методом полимеразной цепной реакции (ПЦР) типичных мутаций в генах BRCA1/2 и CHEK2 выявлено не было.
Лечение начато с неоадъювантной химиотерапии в режиме четырех циклов АС (доксорубицин 60 мг/м2+циклофосфамид 600 мг/м2 каждые 3 недели)+4 цикла паклитакселом 175 мг/м2 каждые 3 недели с частичным регрессом. В апреле 2016 г. выполнена кожесохраняющая радикальная мастэктомия справа с установкой экспандера. При гистологическом исследовании послеоперационного материала обнаружено 2 опухолевых узла (1,5 и 1,0 см) в диаметре – инвазивный дольковый рак с метастазами в 6 из 16 лимфатических узлах, с признаками умеренно выраженного лечебного патоморфоза. Проведен курс адъювантной лучевой терапии (на переднюю грудную стенку и зоны лимфоотока СОД 50 Гр) и с мая 2016 по май 2019 г. проведена адъювантная эндокринотерапия тамоксифеном на фоне овариальной супрессии аналогами лютеинизирующего гормона релизинггормона (ЛГРГ). В конце 2016 г. выполнена пластическая операция по замене экспандера на имплантат, аугмента-ционная маммопластика левой молочной железы, пациентка вернулась к привычному образу жизни, регулярно проходила контрольные обследования.
При плановом ультразвуковом исследовании в мае 2019 г. выявлено узловое образование до 2 см в левой молочной железе, выполнена биопсия, морфологически подтвержден инвазивный рак. С учетом ряда неблагоприятных факторов, таких как метахронный РМЖ, молодой возраст, семейный анамнез, выполнено секвенирование экзома методом NGS (New generation sequencing, секвенирование нового поколения), при котором выявлена патологическая герминальная мутация в гене BRCA2 c.6494delT в гетерозиготном состоянии.
В июне 2019 г. выполнена биопсия сигнального л/узла и кожесохраняющая мастэктомия с одномоментной реконструкцией имплантом. При гистологическом исследовании в ткани молочной железы обнаружено два опухолевых узла (2,0 и 1,0 см) – инвазивный дольковый рак G2, в 3 сигнальных л/узлах – без метастазов, РЭ – 7б, РП – 0б, Her2 – 0, Ki-67 – 65%. Адъювантно проведено 6 циклов химиотерапии в режиме ТС (доцетаксел 75 мг/м2+циклофосфамид 600 мг/м2 каждые 3 недели). Продолжена овариальная супрессия гозерелином, с сентября 2019 г. в адъювантном режиме проводилась эндокринотерапия ингибиторами ароматазы.
При контрольном обследовании в июле 2020 г. спустя 13 месяцев после операции подтверждено прогрессирование заболевания, выявлены множественные метастазы в печени и множественные очаги смешанного характера в костях. Начата терапия в режиме фулвестрант+CDK4/6-ингибитор, терапия бисфосфанатами. Через 2 месяца пациентка самостоятельно отметила появление увеличенного лимфатического узла в правой подключичной области. Выполнена эксцизионная биопсия, удален тотально замещенный метастазом узел с некрозом до 80% – признаки лечебного патоморфоза 3-й степени, РЭ – 0б, РП – 0б, Her2 – 0, Ki-67 – 18%. При комплексном обследовании отмечено прогрессирование заболевания за счет появления метастатических очагов в легких, л/узлах средостения, появление новых очагов в печени, рост всех ранее определяемых метастазов (рис. 1). Пациентка обсуждена на консилиуме Центра компетенции по лечению РМЖ с учетом клинического течения болезни: раннее прогрессирование на фоне адъювантной терапии, прогрессирование в течение 3 месяцев на первой линии эндокринотерапии, данные ИГХ (иммуногистохимического) заключения, полученные при биопсии подключичного л/узла, принято решение о биопсии очагов в печени. При гистологическом исследовании верифицирован метастаз РМЖ, РЭ – 5б, РП – 0б, Her2 – 0, Ki-67 – 28%. Состояние пациентки прогрессивно ухудшалось, появился и быстро нарастал болевой синдром, преимущественно в костях таза, появились внутрикожные очаги на передней грудной стенке и в послеоперационном рубце слева, отмечен постепенный рост уровня печеночных ферментов.
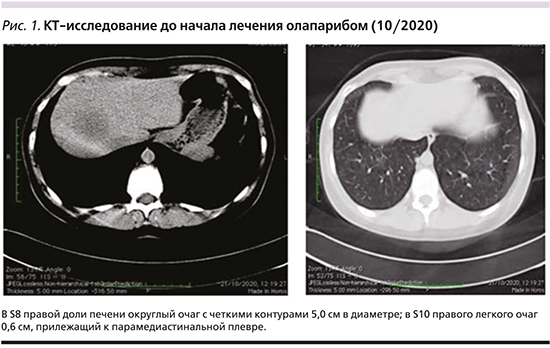
Учитывая наличие герминальной мутации гена BRCА2 начата терапия олапарибом в дозе 300 мг (таблетки) 2 раза в сутки внутрь ежедневно с 15.11.2020, продолжены введения бисфосфанатов. На момент начала терапии отмечалось повышение уровня АЛТ и АСТ 2-й степени, пациентка получала нестероидные противовоспалительные средства и трамадол до 200 мг/сут в качестве обезболивания, ECOG-1 (Eastern Cooperative Oncology Group). В течение первых 4 дней приема олапариба отмечено усиление болевого синдрома, потребовавшего увеличения дозы трамадола до 300 мг/сут. Однако уже на 6-й день терапии болевой синдром полностью купирован, пациентка отказалась от использования любых анальгетиков. Через 2 недели приема отмечено снижение уровней АЛТ и АСТ до 1-й ст., через 4 недели показатели полностью нормализовались. Эффект терапии был подтвержден при контрольном обследовании в 02/2021 (рис. 2), когда по данным компьютерной томографии (КТ) перестали определяться очаги в легких, отмечено уменьшение размеров л/узлов средостения, очаги в печени значимо сократились в размерах (наибольший очаг уменьшился с 5,0 до 2,0 см), бόльшая часть из них перестала определяться. В костях отмечено нарастание выраженности и размеров пластического компонента. При осмотре внутрикожные очаги на грудной стенке перестали определяться.
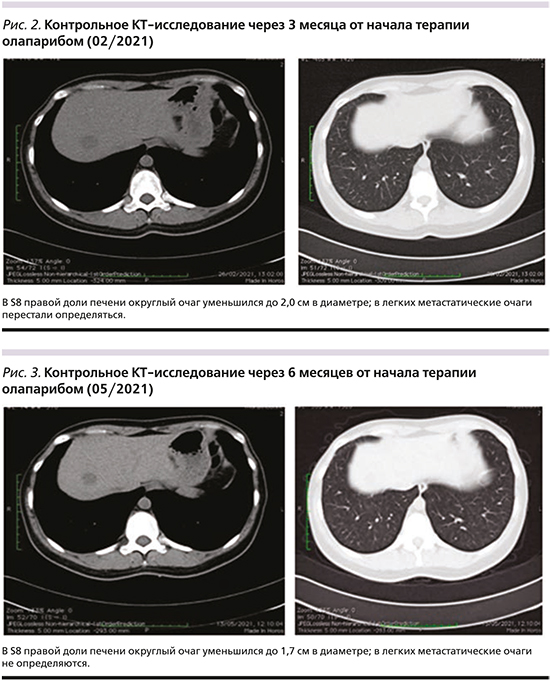
Продолжена терапия олапарибом в прежнем режиме. При контрольной КТ, выполненной 13.05.2021 (рис. 3), нарастает достигнутый частичный регресс, наиболее крупный очаг в печени уменьшился до 1,7 см, очаги в легких и внутрикожные очаги по-прежнему не определяются. Биохимические показатели крови в норме, статус по шкале ECOG – 0. За время лечения значимых НЯ не отмечено. В течение первых 3 недель приема олапариба отмечалась тошнота 1-й ст., которая самостоятельно регрессировала.
Обсуждение
PARP-ингибиторы – современная опция лечения BRCA-ассоциирован-ного HER2-негативного мРМЖ. За счет таргетного действия достигается высокая эффективность и безопасность проводимой терапии. Однако назначение PARP-ингибиторов сопряжено с рядом важных клинических аспектов.
Так, генетическая диагностика должна проводиться при наличии хотя бы одного фактора риска [14]:
- женщины и мужчины с наличием семейного анамнеза онкологических заболеваний у родственников до третьей степени родства включительно;
- ранний возраст манифестации заболевания: РМЖ, диагностированный до 45 лет, или второй РМЖ, диагностированный независимо от возраста;
- морфологический и гистологический подтипы опухоли (при РМЖ наиболее часто BRCA1/2m встречаются в ТН-подтипе, билатеральность РМЖ);
- первично множественные формы рака;
- мужской пол;
- этническая принадлежность (особенно в отношении евреев-ашкенази).
Проведение скрининг-теста методом ПЦР с целью определения типичных для российской популяции мутаций (c.185delAG, c.4153delA, c.5382insC, c.3819delGTAAA, c.3875delGTCT, c.300T>G, c.2080delA – BRCA1 и c.6174delT – BRCA2) зачастую оказывается недостаточным. Как в случае с нашей больной, клиническая картина болезни которой свидетельствовала о наследственном характере, для выявления мутации в гене BRCA2 потребовалось выполнение исследования полной кодирующей последовательности генов BRCA1 и BRCA2 методом NGS (Next Generation Sequencing).
Не стоит пренебрегать выполнением генетического тестирования при люминальных подтипах, как показывают результаты клинических исследований, данная подгруппа имеет достоверное улучшение показателей ВБП и частоты достижения клинического ответа при проведении терапии олапарибом по сравнению с химиотерапией. При анализе зависимости ОВ от фенотипа РМЖ показано, что она была выше в группе больных, чьи опухоли экспрессировали рецепторы эстрогена (РЭ) и/или прогестерона (РП). Медиана ОВ составила 21,8 месяца против 17,4 в группе опухолей с ТН-фенотипом [11]. Место PARP-ингибиторов при гормон-рецептор положительном мРМЖ до сих пор не определено. Остается открытым вопрос о последовательном проведении эндокринотерапии или назначения PARP-ингибиторов в более ранних линиях. Однозначно можно сказать о приоритетном по отношению к химиотерапии назначении PARP-ингибиторов больным, исчерпавшим возможности эндокринотерапии; как видно из результатов клинических исследований, такая опция позволяет достоверно улучшать показатели выживаемости.
В описанном клиническом наблюдении опухоль на низком уровне экспрессировала РЭ, а один из очагов (метастаз в подключичном л/узле) полностью утратил рецепторы половых гормонов. Проведение эндокринотерапии первой линии оказалось неэффективным. Обычно такие пациенты рассматриваются как кандидаты на проведение химиотерапии. Однако знание о наличии патогенной герминальной мутации и возможность проведения терапии олапарибом позволило достигнуть значимой клинической эффективности при сохранении высокого качества жизни для молодой больной. Важным является факт назначения PARP-ингибитора в первой линии лечения, именно такие пациенты, по результатам клинических исследований III фазы OlympiAD и IIIb-фазы LUCY, имели наибольший выигрыш относительно показателей выживаемости.
Заключение
Внедрение в клиническую практику PARP-ингибиторов не просто расширило возможности лечения больных метастатическим HER2-негативным РМЖ с герминальными мутациями в генах BRCA1 и BRCA2, но стало приоритетной опцией для больных данной подгруппы, позволив значимо улучшить показатели выживаемости и качества жизни пациентов.


